Конспект урока «ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ» по химии для 11 класса
ТЕМА: ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ.
ЦЕЛЬ: Изучить факторы, влияющие на скорость химической реакции.
ЗАДАЧИ:
1.Закрепить знания учащихся о гомогенных и гетерогенных
реакциях, о скорости химической реакции.
2. Экспериментально изучить влияние некоторых факторов на
скорость химической реакции.
3. Дать понятие о катализаторах и ингибиторах.
4. Продолжить формирование умений учащихся наблюдать,
анализировать, сравнивать, обобщать, работать с лабораторным
оборудованием.
5. Работать над накоплением словаря по теме.
6. Контролировать правильность произношения.
7. Развивать слуховое восприятие у слабослышащих учеников.
8. Развивать у школьников логическое мышление, творчество и
интерес к предмету.
СЛОВАРЬ: степень окисления, скорость химической реакции, концентрация
веществ, интенсивнее, поверхность соприкосновения веществ.
ОБОРУДОВАНИЕ: Периодическая система химических элементов, опорные таблицы, колбы, пробирки, штатив, спиртовка, растворы серной, соляной и уксусной кислот, цинк, сера, оксид меди (II), кусочки мрамора, мела, 5% раствор пероксида водорода, оксид марганца(IV), лучинка.
ХОД УРОКА.
1.Организационный момент. Проверка слуховых аппаратов.
2.Речевая работа.
Контроль звуков Ц-С.
а) Прочитать и произнести правильно:
- степень окисления,
- скорость химической реакции,
- концентрация веществ,
- интенсивнее,
- поверхность соприкосновения веществ.
б) Назвать химические элементы, в названии которых есть звуки Ц, С.
Кальций, сера, свинец, стронций, кислород, осмий и т.д.
3.Закрепление раннее изученного материала. Фронтальный опрос.
Вступительное слово учителя. Мы продолжаем изучать основные закономерности протекания химических реакций. Настало время поговорить о продолжительности химической реакции, т.е. о протекании химического процесса во времени, за которое он происходит. И задачами сегодняшнего урока является выявление факторов, которые влияют на скорость химической реакции.
Запишите тему, число.
-
Известно, что одни химические реакции протекают за малые доли секунды, другие же за минуты, часы, дни.
Скажите, а вы встречались в своей жизни с реакциями идущими очень быстро?
а) горение; б) сода + уксус;
Эти реакции высокой скорости.
-
А какие реакции идут медленно?
а) ржавление железа; б) скисание молока.
Для полного гниения брошенной в лесу газеты нужен 1 год.
Ржавление консервной банки происходит в течение 10 лет.
Стекло практически не разрушается в течение столетий.
Эти реакции низкой скорости.
Чтобы характеризовать быстроту химической реакции, пользуются понятием скорость химической реакции.
-
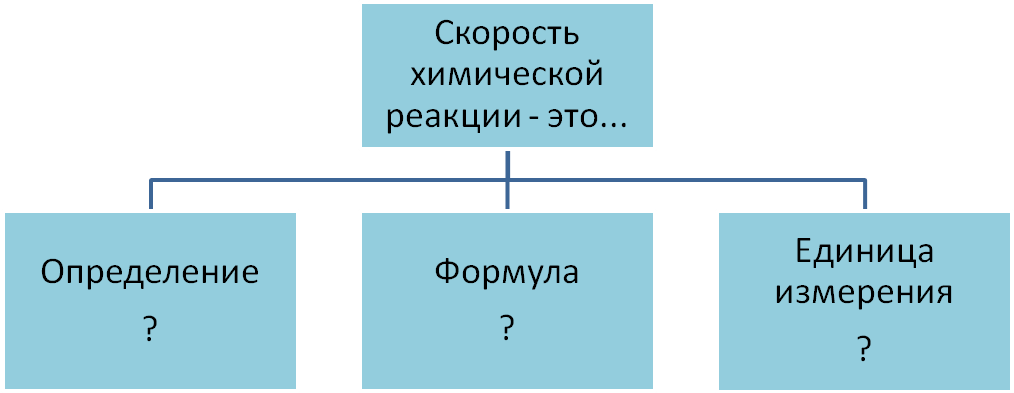
Что такое скорость химической реакции?
Скорость химической реакции – это изменение концентрации вступившего в реакцию или образовавшегося вещества в единицу времени.
-
По какой формуле находят скорость химической реакции?
V = C2 – C1 / t2 – t1 = ΔC/Δt
-
Какие бывают химические реакции?
Реакции бывают гомогенные и гетерогенные.
-
Что такое гомогенные реакции?
Гомогенные реакции – это реакции, в которых вещества образуют однородную систему. К этим реакциям относятся реакции между газами, между жидкими веществами.
-
Что такое гетерогенные реакции?
Гетерогенные реакции – это реакции, в которых реагенты находятся в разных фазах. Они протекают между твердыми веществами и газами, твердыми веществами и жидкостями.
4. Работа над темой урока.
Факторы, влияющие на скорость химической реакции.
а) ПРИРОДА РЕАГИРУЮЩИХ ВЕЩЕСТВ.
Демонстрация взаимодействия цинка с соляной и уксусной кислотами.
- Какая реакция идет быстрее? (Реакция с соляной кислотой.)
- Какой газ выделяется в пробирке 1?( Выделяется водород.)
- Напишите уравнение реакции.
Zn + 2 HCl = ZnCl2 + H2↑
- Вывод: скорость реакции зависит от природы реагирующих
веществ.
б) КОНЦЕНТРАЦИЯ РЕАГИРУЮЩИХ ВЕЩЕСТВ.
- Рассмотрим горение серы на воздухе и в кислороде.
Учитель демонстрирует опыт горения серы на воздухе и в колбе с кислородом.
- Где реакция идет интенсивнее? ( Интенсивнее сера горит в кислороде.)
- Напишите уравнение реакции горения серы.
S + O2 = SO2
- Какая это реакция: гомогенная или гетерогенная? (Это гетерогенная реакция)
- Вывод: скорость реакции зависит от концентрации реагирующих веществ.
в) ТЕМПЕРАТУРА РЕАКЦИИ.
- Рассмотрим взаимодействие оксида меди (II) и серной кислоты.
Что наблюдаем?
- Нагреем пробирку.
- Что вы отметили? (Голубой цвет раствора.)
- Напишите уравнение этой реакции.
CuO + H2SO4 = CuSO4 + H2O
- Почему изменилась окраска раствора? (Черный осадок оксида меди растворился в кислоте, образуя сульфат меди голубого цвета.)
- На скорость реакции влияет еще и площадь поверхности соприкосновения тел. Опыт, доказывающий это, вы проведете сами.
Повторение правила техники безопасности при работе в химическом кабинете. Работа по опорным таблицам.
Следующую реакцию ученики проводят самостоятельно.
г) ПЛОЩАДЬ ПОВЕРХНОСТИ СОПРИКОСНОВЕНИЯ ВЕЩЕСТВ.
- Проведите реакцию взаимодействия карбоната кальция с соляной
кислотой.
- Налейте в две пробирки соляной кислоты и опустите в одну кусочек
мрамора, а в другую мраморную крошку.
- Как протекают реакции в пробирках? В чем разница? ( В пробирке с
мраморной крошкой реакция идет интенсивнее.)
- Почему реакции идут с разной интенсивностью? (Площадь поверхности
измельченного вещества больше.)
- Напишите уравнение реакции.
CaCO3 + 2 HCl = CaCl2 + CO2↑ + H2O
- Какай газ выделяется? ( Выделяется углекислый газ.)
- В какой пробирке реакция закончилась быстрее? (В пробирке с мраморной
крошкой.)
- Какая это реакция: гомогенная или гетерогенная? (Это гетерогенная
реакция)
д) ПРИСУТСТВИЕ КАТАЛИЗАТОРА.
Демонстрация опыта разложения пероксида водорода в присутствии оксида марганца.
- Нальем пероксид водорода в стаканчик и внесем тлеющую лучинку, она не загорается, т.к. при обычных условиях реакция разложения протекает очень медленно. Если же внести в стаканчик немного оксида марганца (IV), то начинается бурное выделение газа, внесенная тлеющая лучинка загорается ярким пламенем.
- Напишите уравнение реакции.
H2O2 = 2H2O + O2́́́́↑
- МпО2 – катализатор, он не расходуется в реакции.
- Откройте учебники на странице 90, прочитайте текст и найдите ответы на вопросы:
1. Дать определение катализатора.
2. Какие реакции называют каталитическими?
3. Что такое ингибиторы?
5. Использование знаний о скорости реакции в быту.
-
Почему продукты хранят в холодильнике?
(Чтобы замедлить химические реакции, ведущие к порче продуктов)
-
Что происходит при тепловой обработке пищевых продуктов?
В каком случае приготовление пищи происходит быстрее?
(При тепловой обработке продуктов происходят химические реакции.
Пища готовиться быстрее при большем нагревании)
-
Для консервирования продуктов используют вещества консерванты.
Какое другое название можно дать этим веществам? (Это ингибиторы. Они замедляют скорость химических реакций)
6. Заключение.
Подведение итогов урока.
- Какая была тема нашего урока?
- Перечислите факторы, влияющие на скорость химической реакции?
- Как мы можем использовать свои знания о скорости химической реакции в быту?
- Есть ли у нас вопросы? Все ли понятно?
Оценка работы учеников.
7. Домашнее задание.
§16.3 прочитать, выучить уравнения реакций и определения.
Открытый урок на тему:
«Факторы, влияющие на скорость химической реакции. Катализаторы»
Из опыта работы
учителя химии Куксовой М. А.
ГСОУ школа-интернат I, II вида г. Тихорецка
Здесь представлен конспект к уроку на тему «ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (11 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

