Презентация "Химические свойства солей" (8 класс) по химии – проект, доклад
Презентацию на тему "Химические свойства солей" (8 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 23 слайд(ов).
Слайды презентации
Список похожих презентаций
"Электрохимический ряд напряжений металлов. Общие химические свойства металлов". 11-й класс
Цель урока:. Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ. Задачи урока:. Повторить общие химические свойства ...Металлы. Химические и физические свойства металлов
Физические свойства металлов. Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они ...Физические и химические свойства оснований
Цель урока:. Рассмотреть физические и химические свойства оснований. НАЗОВИТЕ ОСНОВАНИЯ:. Ca(OH)2 NaOH Zn(OH)2 Cu(OH)2 Fe(OH)3. СОСТАВЬТЕ ФОРМУЛЫ ...Физические и химические свойства бензола
Цель и задачи урока: систематизировать знания учащихся о строении молекулы бензола, о способах его получения; - сформировать представление о физических ...Физические и химические свойства кислот
Ожидаемые результаты:. Знать состав формул, определение кислот, индикаторов, физические и химические свойства кислот. Совершенствовать: учебные умения ...Алкены. Строение. Изомерия. Химические свойства. Получение
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Физические и химические свойства воды
Цели урока:. Изучить химические свойства воды. Начать формировать представления о важнейших классах неорганических соединений: кислотах и основаниях. ...Физические и химические свойства кислот. 8-й класс
Классификация кислот. 1. По составу (по наличию атомов кислорода). кислоты бескислородные. кислородосодержащие. HCl, HBr, HI, HF,H2S HNO3, H2SO4, ...Физико-химические свойства алкинов
Физические свойства алкинов. С2 – С4 газы С5 – С 15 жидкости Свыше С16 – твердые вещества tпл и t кип алкинов увеличиваются с ростом молекулярной ...Алкены. Строение. Изомерия. Химические свойства
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Кремний, его физические и химические свойства
Цели урока: - рассмотреть положение кремния в периодической системе Д.И.Менделеева и строении его атома; - рассмотреть нахождение кремния в природе; ...Алкины-способы получения и химические свойства
Тема и цели урока:. Тема: «Ацетилен. Алкины». Цель урока: Дать представления об углеводородах с тройной связью. О их физико-химических свойствах и ...Основания. Химические свойства. Способы получения
Химические свойства. Гидроксид – ионы (ОН-), образующиеся при диссоциации оснований, обуславливают их химические свойства 1. Действие на индикаторы. ...Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Сера. Ее физические и химические свойства
«В древней магии присутствую при рождении огня, называют серой издавна меня". 1вариант –О2 2вариант-О3. Газ без запаха Проявляет окислительные и восстановительные ...Алюминий – металл ХХ века. Физические и химические свойства
Алюминий. Алюминий вы найдете В ложке, кружке, самолете. Нужен легонький металл, Чтобы самолет летал! Самолет парит легко, Небосвод пронзает синий, ...Основания. Химические свойства оснований
Классификация оснований. Растворимые в воде (щелочи). Нерастворимые в воде. NaOH Ca(OH)2 Al(OH)3 Сu(OH)2. Название оснований. Гидроксид +. Название ...Понятие об углеводах. Моносахариды. Химические свойства глюкозы
Классификация углеводов. Углеводы Cn(H2O)m Моносахариды Дисахариды Полисахариды. Моносахариды – углеводы, не подвергающиеся гидролизу. триозы тетрозы ...Вода и ее химические свойства
Молекулярное строение воды. Молекула воды состоит из 2 молекул водорода и 1 молекулы кислорода, которые находятся друг относительно друга под углом ...Получение и химические свойства кислорода
Цели и задачи урока:. Выяснить источник кислорода в природе; познакомиться с лабораторными и промышленными способами получения кислорода Познакомиться ...Конспекты
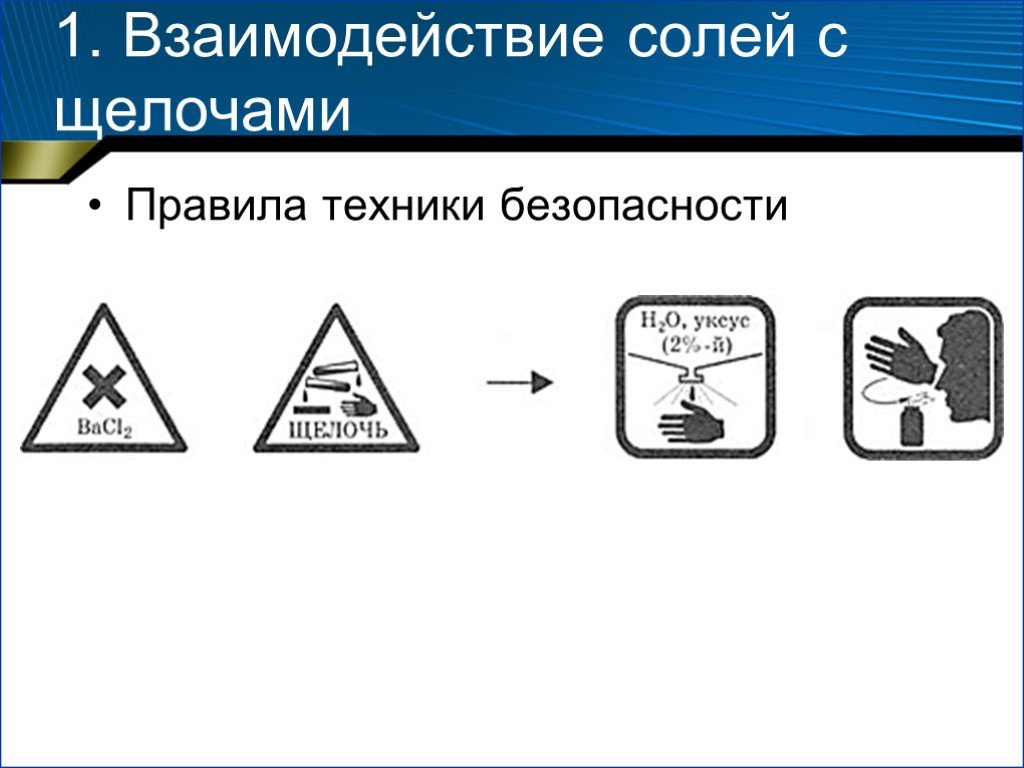
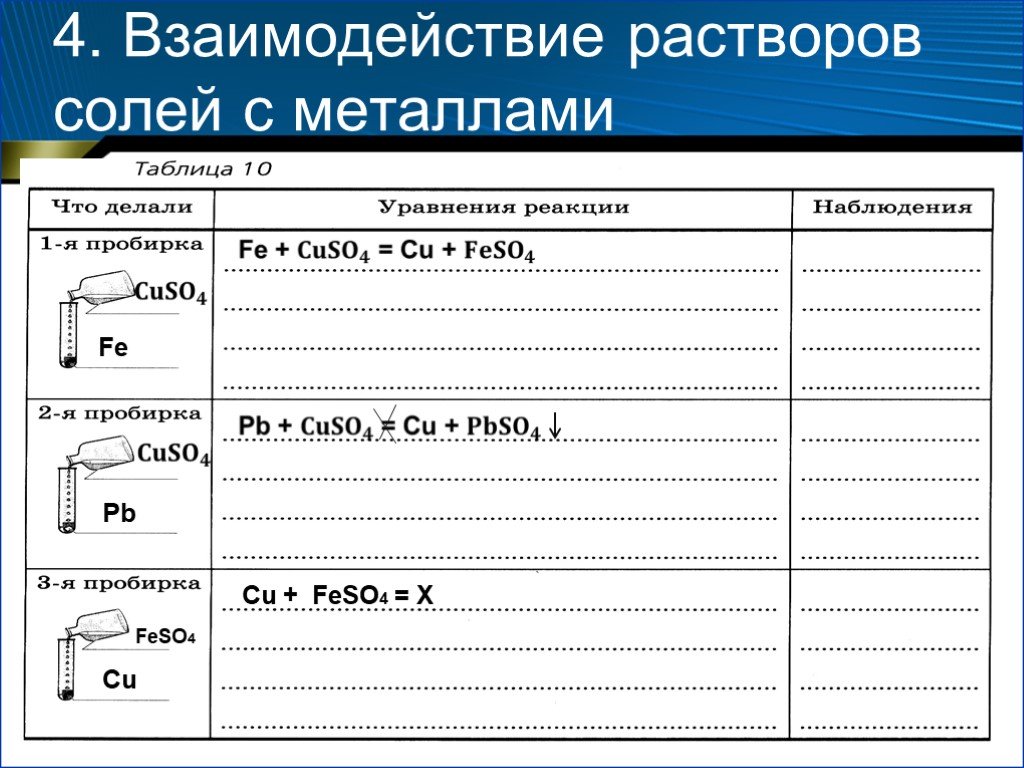
Физические и химические свойства солей
Химия 8 класс. Методическая разработка урока. «Физические и химические. . свойства солей». Выполнила. учитель химии. ОШ № 30 ...Химические свойства растворов солей с точки зрения теории электролитической диссоциации
9 класс. Химия. . Тема: химические свойства растворов солей с точки зрения теории электролитической диссоциации. . Цель:. формировать представления ...Химические свойства серной кислоты
. Химические свойства серной кислоты. Данный урок- презентация по теме « Химические свойства серной кислоты» позволяет реализовать ...Азот положение в ПСХЭ. Строение атома и молекулы. Физические и химические свойства
Опорный конспект по теме: «Азот положение в ПСХЭ. . Строение атома и молекулы. Физические и химические свойства. I. .Положение азота в ПСХЭ:. ...Химические свойства оснований
Автор:. Голикова Ирина Викторовна, учитель химии, МБОУ «Сергеевская СОШ». Класс:. 8в. Раздел программы:. «Классы неорганических веществ». Тема ...Химические свойства предельных одноатомных спиртов
МОУ « Лицей № 47» г. Саратов. . Никитина Надежда Николаевна - учитель химии. ПОДГОТОВКА К ЕГЭ ( 10, 11 класс). Лекция по теме: Химические свойства ...Химические свойства предельных карбоновых кислот. Разработка урока-исследования
МБОУ «Гимназия №44» г. Курска. «Химические свойства. . карбоновых кислот». (урок - исследование). Учитель химии высшей категории:. ...Химические свойства оксидов
Чиркова Марина Юрьевна. МБОУ СОШ № 22. Г. Узловая Тульской обл. Тема урока: «Химические свойства оксидов». Тип урока:. Объяснение нового ...Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия
Дата_____________ Класс_______________. Тема: Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические ...Алюминий, его физические и химические свойства
План – конспект урока. Тема урока:. Алюминий, его физические и химические свойства. Тип урока:. изучение нового материала. Цель:. обучающиеся ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:1 октября 2018
Категория:Химия
Классы:
Содержит:23 слайд(ов)
Поделись с друзьями:
Скачать презентацию