Презентация "Химический элемент - водород" по химии – проект, доклад
Презентацию на тему "Химический элемент - водород" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 11 слайд(ов).
Слайды презентации
Список похожих презентаций
Химический элемент водород
Цели и задачи урока. повторить и закрепить знания, умения и навыки по теме «Свойства водорода и кислот. Формулы солей»; продолжить формирование познавательных ...Викторина "Узнай химический элемент"
1.Какой элемент входит в состав костей? 2.Какой элемент входит в состав хлорофилла? 3.Какой элемент входит в состав белка крови - гемоглобина? 4.Какой ...Химический элемент фосфор
Цель: рассмотреть особенности фосфора как химического элемента и простого вещества. Задачи:. 1)Изучить теоретический материал о фосфоре ( строение ...Алюминий как химический элемент и как простое вещество
AL. Элемент III(A) группы таблицы Д.И.Менделеева. Элемент с порядковым № 13. Элемент 3 -его периода. Третий по распространенности в земной коре. Впервые ...Викторина "Узнай химический элемент"
1.Какой элемент входит в состав костей? 2.Какой элемент входит в состав хлорофилла? 3.Какой элемент входит в состав белка крови - гемоглобина? 4.Какой ...Химический элемент алюминий
Тема урока: «Алюминий». Нахождение в природе. Физические свойства. Химические свойства. Применение. Какими физическими свойствами обладает алюминий? ...Химический эксперимент в школе – элемент формирования исследовательской компетенции
Тема. Химический эксперимент в школе – элемент формирования исследовательской компетенции. Девиз. Просто знать- мало Знания нужно уметь использовать ...Кислород - химический элемент
познакомиться с историей открытия кислорода; рассмотреть распространение кислорода в природе; дать общую характеристику элементу кислород; изучить ...Кислород как химический элемент и простое вещество
Тема урока. «Кислород как химический элемент и простое вещество». «Dum spiro spero»…… Пока дышу, надеюсь…. Кислород – это вещество, вокруг которого ...Углерод – химический элемент и простое вещество
Цели урока:. Познакомить учащихся с распространением химического элемента углерода в природе Вспомнить электронное строение атома углерода Закрепить ...Сера как химический элемент и простое вещество
Основные вопросы. 1.Истрия открытия и изучения серы. 2. Распространение серы в природе. 3. Аллотропия и физические свойства серы. 4.Химические свойства ...Химический состав клетки: ультрамикроэлементы
Химический состав клетки. Каждая клетка содержит множество химических элементов, участвующих в различных химических реакциях. Химические процессы, ...Химический элементы в нашей жизни
Какие вещества важны для жизнедеятельности человека? Минеральные вещества - химические элементы, необходимые организму человека или животного для ...Химический состав клетки
Вода 75-85%. Минеральные вещества 1,0-1,5%. Белки 10-20%. Органические вещества. Жиры 1-5% Углеводы 0,2- 2,0%. Нуклеиновые Кислоты 1-2%. 98%. Кислород ...Химический состав клетки
Н (водород). Входит в состав воды и всех биологических соединений. В (бор). Необходим некоторым растениям. С (углерод). Входит в состав всех биологических ...Химический салон красоты
…Искусство косметики постоянно менялось…. При раскопках пещер археологами были найдены стержни для окрашивания губ, палочки для чернения бровей и ...Химический состав, строение и структура белков.
Цель:. Узнать, из чего построен белок Задачи: Рассмотреть химический состав белков Изучить строение и структуру белковых молекул. Белки – продукт ...Химический состав растений
Растения, богатые белками. Растения, богатые углеводами. . Растения, богатые жирами. Растения, содержащие жиры. Горчица Рапс. Растения, содержащие ...Сера как элемент и как простое вещество
Работу выполнили: Учителя химии ГБОУ СОШ № 1465 им. Н.Г.Кузнецова Попова Светлана Анатольевна и Образовательного комплекса ГБОУ СОШ № 880 Гершановская ...Светоносный элемент
План урока. Паспортные данные фосфора Станция историческая Станция «Аллотропные модификации» Станция геологическая Станция химическая Станция прикладная ...Конспекты
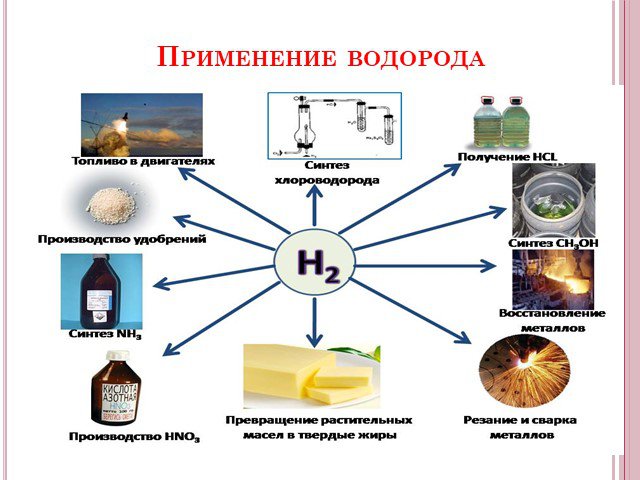
Водород. Химический элемент и простое вещество. Физические и химические свойства
Тема урока:. Водород. Химический элемент и простое вещество. Физические и химические свойства. Место урока. : «Неорганическая химия» 8 класс. ...Водород – химический элемент и простое вещество
Тема урока «Водород – химический элемент и простое вещество». Тип урока: урок обобщения и систематизации знаний по теме «Водород». Форма урока: ...Кремний – химический элемент или природный дар. ...Силикаты
9 класс химия ( Габриелян). Учебное занятие № 44. Дата:. Тема: Кремний – химический элемент или природный дар. ...Силикаты. Эпиграф к уроку:. ...Кислород: химический элемент и простое вещество. Свойства, получение и применение кислорода
Тема. :. Кислород: химический элемент и простое вещество. Свойства, получение и применение кислорода. Цель: Развитие исследовательских способностей ...Кислород химический элемент и простое вещество
«Утверждено. » «Рассмотрено». Директор школы: ________________ Зам УВР: ________________. Урок №. 34. дата. ____________. Краткосрочное планирование ...Кислород — химический элемент и простое вещество. Получение кислорода
Муниципальное общеобразовательное автономное учреждение. . «СОШ № 10». Урок по теме "Кислород — химический элемент и простое ...Железо: химический элемент и простое вещество
Муниципальное бюджетное образовательное учреждение. «Средняя общеобразовательная школа №3». Конспект урока по химии:. “Железо: ...Фосфор – химический элемент и простое вещество
ПЛАН-КОНСПЕКТ УРОКА. 1. «Фосфор – химический элемент и простое вещество». (Тема урока). ФИО: Артемьева Елена Юрьевна. . Место работы: МОУ ...Химический элемент и строение ПСХЭ Д.И. Менделеева
План-конспект урока. Тема. : «Химический элемент и строение ПСХЭ Д.И. Менделеева». Цель. : закрепить знания понятий: химические элементы, знаки ...Фосфор как химический элемент и вещество
Муниципальное бюджетное общеобразовательное учреждение. «Новотимошкинская основная общеобразовательная школа». Аксубаевского муниципального района ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:27 сентября 2015
Категория:Химия
Содержит:11 слайд(ов)
Поделись с друзьями:
Скачать презентацию



















![В лаборатории: Zn + 2HCl → ZnCl2 + H2↑ Ca + 2H2O → Ca(OH)2 + H2↑ NaH + H2O → NaOH + H2↑ 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑ Тетрагидротсоцинкат дикалия В лаборатории: Zn + 2HCl → ZnCl2 + H2↑ Ca + 2H2O → Ca(OH)2 + H2↑ NaH + H2O → NaOH + H2↑ 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑ Тетрагидротсоцинкат дикалия](https://prezentacii.org/upload/cloud/15/09/43685/images/thumbs/screen9.jpg)