Презентация "Светоносный элемент" по химии – проект, доклад
Презентацию на тему "Светоносный элемент" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 18 слайд(ов).
Слайды презентации
Список похожих презентаций
Химический элемент - водород
Краткая характеристика элемента. H 1 1,00794 1s1 Водород. Водоро́д — первый элемент периодической системы элементов. Широко распространён в природе. ...Химический элемент алюминий
Тема урока: «Алюминий». Нахождение в природе. Физические свойства. Химические свойства. Применение. Какими физическими свойствами обладает алюминий? ...Углерод – химический элемент и простое вещество
Цели урока:. Познакомить учащихся с распространением химического элемента углерода в природе Вспомнить электронное строение атома углерода Закрепить ...Химический эксперимент в школе – элемент формирования исследовательской компетенции
Тема. Химический эксперимент в школе – элемент формирования исследовательской компетенции. Девиз. Просто знать- мало Знания нужно уметь использовать ...Сера как химический элемент и простое вещество
Основные вопросы. 1.Истрия открытия и изучения серы. 2. Распространение серы в природе. 3. Аллотропия и физические свойства серы. 4.Химические свойства ...Сера как элемент и как простое вещество
Работу выполнили: Учителя химии ГБОУ СОШ № 1465 им. Н.Г.Кузнецова Попова Светлана Анатольевна и Образовательного комплекса ГБОУ СОШ № 880 Гершановская ...Кислород - химический элемент
познакомиться с историей открытия кислорода; рассмотреть распространение кислорода в природе; дать общую характеристику элементу кислород; изучить ...Кислород как химический элемент и простое вещество
Тема урока. «Кислород как химический элемент и простое вещество». «Dum spiro spero»…… Пока дышу, надеюсь…. Кислород – это вещество, вокруг которого ...Железо элемент побочной подгруппы
Цель:. 1. Вводная тема для формирования и развития познавательного интереса к материалу. 2. Осознания учащимися исторического значения освоения железа ...Железо – элемент побочной подгруппы
Общая характеристика железа. Нахождение в природе. Fe ХАЛЬКОПИРИТ ПИРИТ ЧЁРНЫЙ ПИРИТ ГЕМАТИТ. 1s2 2s2 2p6 3s2 3p6. Краткая электронная формула. Валентные ...Викторина "Узнай химический элемент"
1.Какой элемент входит в состав костей? 2.Какой элемент входит в состав хлорофилла? 3.Какой элемент входит в состав белка крови - гемоглобина? 4.Какой ...Химический элемент водород
Цели и задачи урока. повторить и закрепить знания, умения и навыки по теме «Свойства водорода и кислот. Формулы солей»; продолжить формирование познавательных ...Химический элемент фосфор
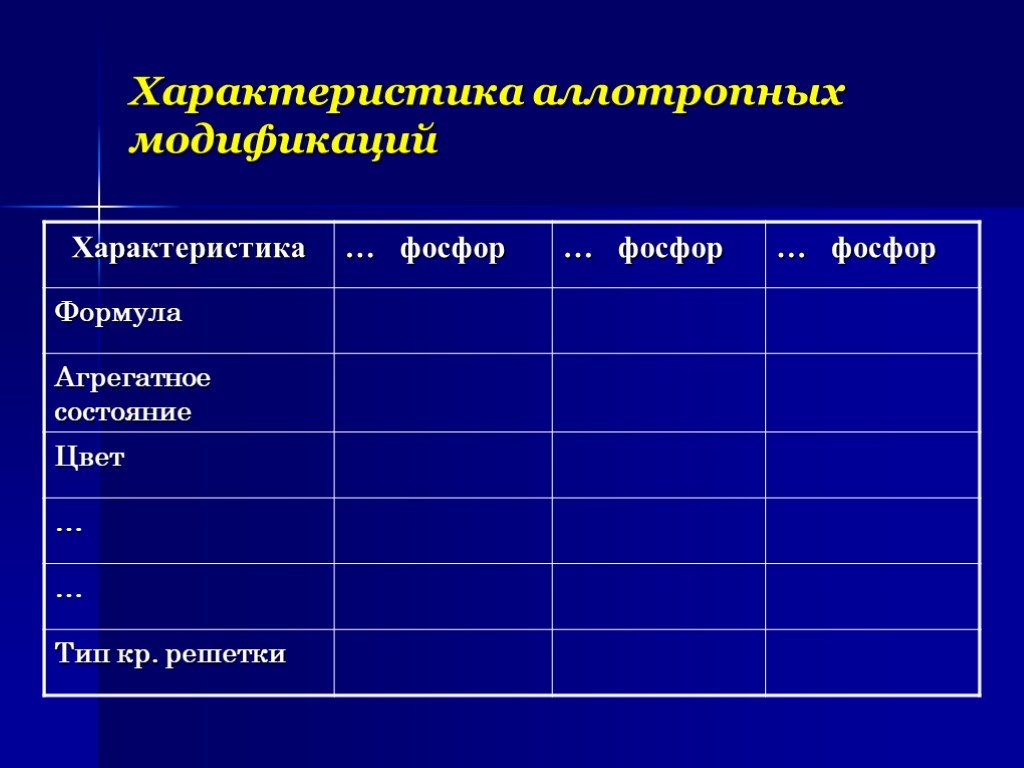
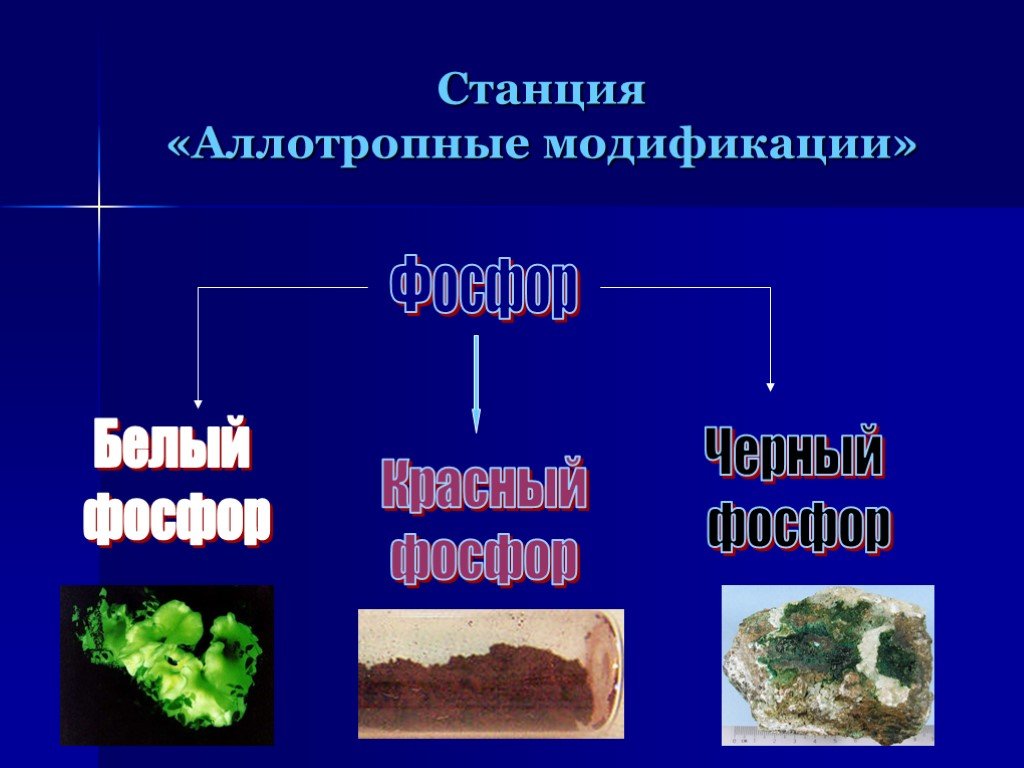
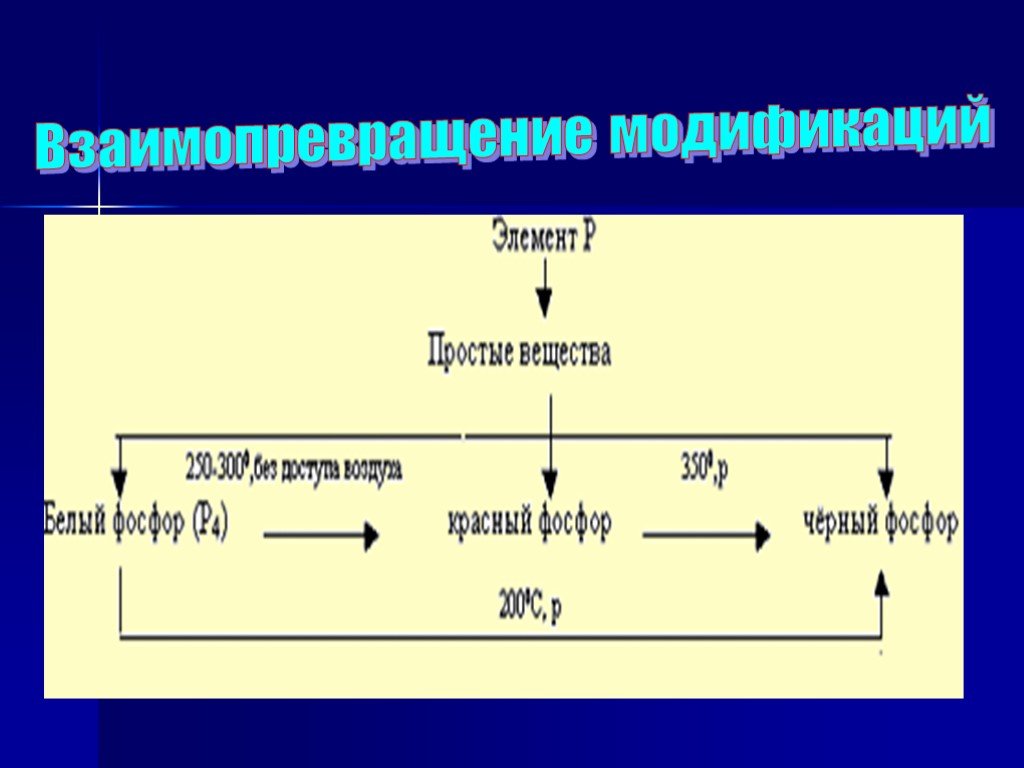
Цель: рассмотреть особенности фосфора как химического элемента и простого вещества. Задачи:. 1)Изучить теоретический материал о фосфоре ( строение ...Алюминий как химический элемент и как простое вещество
AL. Элемент III(A) группы таблицы Д.И.Менделеева. Элемент с порядковым № 13. Элемент 3 -его периода. Третий по распространенности в земной коре. Впервые ...Викторина "Узнай химический элемент"
1.Какой элемент входит в состав костей? 2.Какой элемент входит в состав хлорофилла? 3.Какой элемент входит в состав белка крови - гемоглобина? 4.Какой ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Конспекты
Фосфор как химический элемент и вещество
Муниципальное бюджетное общеобразовательное учреждение. «Новотимошкинская основная общеобразовательная школа». Аксубаевского муниципального района ...Химический элемент и строение ПСХЭ Д.И. Менделеева
План-конспект урока. Тема. : «Химический элемент и строение ПСХЭ Д.И. Менделеева». Цель. : закрепить знания понятий: химические элементы, знаки ...Фосфор - элемент жизни и мысли
Развернутый конспект урока. Учитель химии: Калеева Светлана Вениаминовна. № урока. Класс: 9 А. Тип урока:. урок изучения нового материала и совершенствование ...Фосфор – химический элемент и простое вещество
ПЛАН-КОНСПЕКТ УРОКА. 1. «Фосфор – химический элемент и простое вещество». (Тема урока). ФИО: Артемьева Елена Юрьевна. . Место работы: МОУ ...Кремний – химический элемент или природный дар. ...Силикаты
9 класс химия ( Габриелян). Учебное занятие № 44. Дата:. Тема: Кремний – химический элемент или природный дар. ...Силикаты. Эпиграф к уроку:. ...Мистический элемент - сера
Губарева Вера Александровна. _____________________________________________________________________________________________. . Урок - конференция ...Кислород химический элемент и простое вещество
«Утверждено. » «Рассмотрено». Директор школы: ________________ Зам УВР: ________________. Урок №. 34. дата. ____________. Краткосрочное планирование ...Кислород: химический элемент и простое вещество. Свойства, получение и применение кислорода
Тема. :. Кислород: химический элемент и простое вещество. Свойства, получение и применение кислорода. Цель: Развитие исследовательских способностей ...Кислород — химический элемент и простое вещество. Получение кислорода
Муниципальное общеобразовательное автономное учреждение. . «СОШ № 10». Урок по теме "Кислород — химический элемент и простое ...Железо: химический элемент и простое вещество
Муниципальное бюджетное образовательное учреждение. «Средняя общеобразовательная школа №3». Конспект урока по химии:. “Железо: ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 февраля 2019
Категория:Химия
Содержит:18 слайд(ов)
Поделись с друзьями:
Скачать презентацию