Презентация "Теоретические основы аналитической химии" – проект, доклад
Презентацию на тему "Теоретические основы аналитической химии" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Основы органической химии
Cвойства металлоорганических соединений переходных элементов. МОС ПЭ С-Лиганд. Переходный металл. Открытия. N2 + 8H+ + 8e− + 16АТФ → 2NH3 + H2 + 16АДФ ...Основы органической химии
Общая характеристика органических соединений. Органические соединения являются производными углерода; Углерод в органических соединениях образует ...Окислительно-восстановительные равновесия в аналитической химии
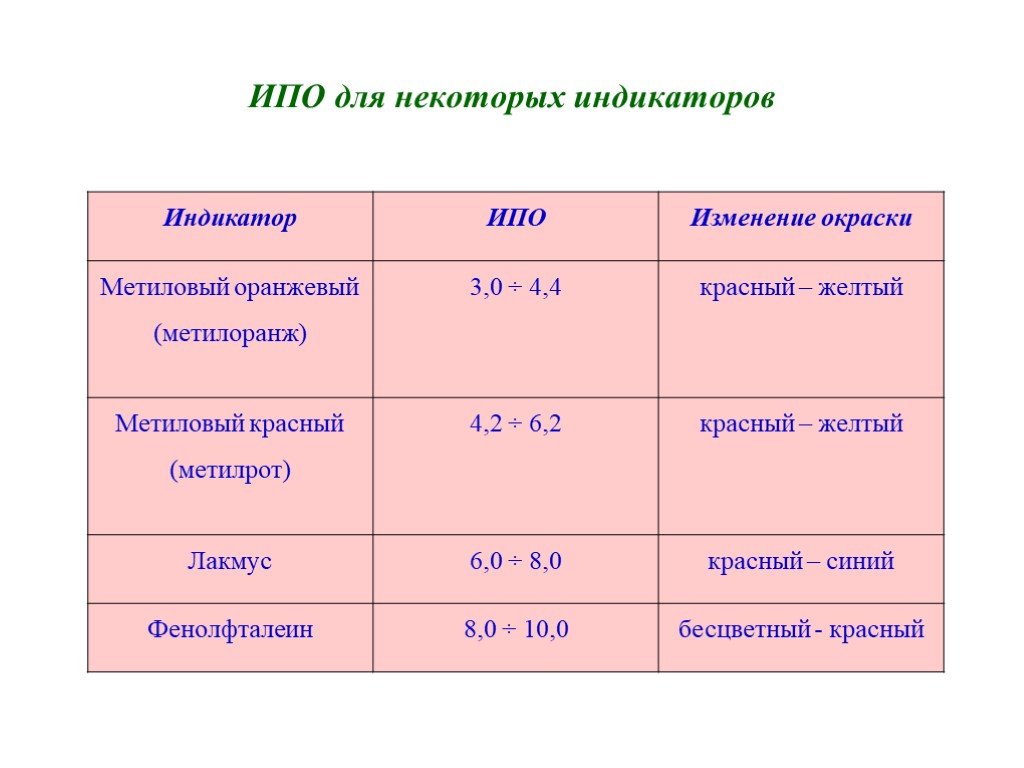
План лекции: Использование ОВР в аналитической химии. Типы ОВР. Количественное описание ОВР. Константа равновесия ОВР. Устойчивость водных растворов ...Преподавание химии
Интернет-школа «Просвещение.ru» - первая аккредитованная дистанционная средняя школа. Учащиеся интернет-школы. «Очное» дистанционное обучение – 10-11 ...Предмет и задачи химии
ЧТО ТАКОЕ ХИМИЯ? ХИМИЯ-это наука о веществах и их свойствах, о превращениях веществ и способах управления этими превращениями. ЧТО ТАКОЕ ВЕЩЕСТВО? ...Подготовка к ГИА по химии
Необходимо выбрать несколько правильных ответов из пяти предложенных и записать ответ в виде последовательности цифр. Учимся выполнять задания блока ...Основные этапы развития химии комплексных соединений
В общем случае: комплексными соединениями называют химические соединения, образованные сочетанием отдельных компонентов, содержащие в своем составе ...Организация и содержание профильного обучения на уроках химии
Исследовательская деятельность школьников в процессе обучения химии в профильных классах. Переход к профильному обучению в старших классах предъявляет ...Урок-игра по химии
Игра "Крестики-нолики". Правила игры: Зачеркнуть правильные ответы, расположенные по вертикали, горизонтали или диагонали. 1 2. H2O, NaCl, CO2. Запишите ...Сайты по химии
Chemnet - наиболее посещаемый сайт по химии в России. Сайт основан в 1994 году. Электронная библиотека по химии на ChemNet.Ru С 1994 г. www.chemnet.ru. ...Безопасность на уроке химии
Пробовать вещества на вкус, есть и пить в химическом кабинете. Осторожно направляйте к себе газ рукой. ЗАПРЕЩАЕТСЯ. . . . . ЗАПРЕЩАЮЩИЕ ЗНАКИ. Запрещается ...Анализ результатов ЕГЭ по химии 2010 (окружной семинар учителей химии)
Результаты ЕГЭ 2010. Граница минимального балла -33 тестовых балла (12 первичных баллов). Уровни оценивания: неудовлетворительный – 0–32 / 0–11; удовлетворительный ...Анализ ЕГЭ по химии 2011
Уровни выполнения экзаменационной работы. неудовлетворительный – 0–31 / 0–12, удовлетворительный –32–56 / 13–35, хороший – 57–77 / 36–56, отличный ...Алгоритм решения задач по химии
Алгоритм решения задач по химии:. Записать краткое условие задачи; *В случае необходимости произвести предварительный расчет; Перевести величины, ...Активизация обучающихся на уроках химии как показатель развития их мыслительной деятельности.
Приёмы активизации мыслительной деятельности обучающихся:. Приём стимулирующих звеньев Приём реконструкции Приём прогнозирования. Приём стимулирующих ...Азотная кислота по химии
Тема: «Азотная кислота» Цель урока: Рассмотреть свойства азотной кислоты и области ее применения. План урока: 1. Проверка Д/З (письменная работа); ...Путешествие в мир химии
“Познание начинается с удивления” (Аристотель). Станция № 1 «Разминка». В конце периода стоит, В нём вода и та горит. Загадки Фтор. Давно известно ...Роль лабораторного практикума в изучении предмета химии
Содержание. Введение Формы школьного эксперимента Оборудование для химических опытов Инструктаж по технике безопасности на химическом практикуме Примеры ...Великие учёные, внёсшие значительный вклад в развитие химии
Дмитрий Иванович Менделеев. Родился в Тобольске в семье директора гимназии. После окончания гимназии он поступил в Главный педагогический институт ...Техника безопасности в химии
В соответствии со статьями 32 и 51 Закона РФ «Об образовании» школа обязана обеспечить здоровые условия учебы и труда и несет ответственность за жизнь ...Конспекты
Белки. На перекрестках химии и биологии
Урок в 10 классе «Белки. На перекрестках химии и биологии». Цель урока:. систематизация и углубление знаний учащихся по теме «Белки». Образовательные ...Основные законы общей химии
Конспект урока по теме:. «Основные законы общей химии»Класс:. 11 классЦель урока. : создать условия для актуализации и систематизации знаний учащихся ...Тренировка памяти на уроках химии
. Муниципальное бюджетное общеобразовательное учреждение. «Основная общеобразовательная школа №6». г.Топки Кемеровской области. Мастер-класс ...Школьный кабинет химии
Урок-экскурсия «Школьный кабинет химии». Цели мероприятия:. Предметная:. познакомить с новой наукой - химией, что она изучает;. Методологическая:. ...Развитие познавательной самостоятельности на уроках химии через составление химических задач
Развитие познавательной самостоятельности на уроках химии через составление химических задач. «Не мыслям надо учить, а мыслить…». . И.Кант. ...Решение экспериментальных задач по органической химии
Конспект открытого урока . Практическая работа №4 «Решение экспериментальных задач по органической химии». Класс:10. УМК: Рудзитис Г.Е., ФельдманФ.Г. ...Использование опорных схем на уроках химии
Муниципальное образовательное автономное учреждение средняя общеобразовательная школа с углубленным изучением отдельных предметов №1 г. Белогорск, ...Предмет органической химии
Муниципальное бюджетное общеобразовательное учреждение. Орловская средняя общеобразовательная школа №3. Открытый урок. по теме «Предмет ...Именные реакции в органической химии
Урок обобщения: "Именные реакции в органической химии" 10 класс. Максимова И.Н. учитель химии и биологии. . МБОУ «Среднекибечская СОШ» Канашского ...Интересные факты о химии
Интересные факты о химии. Химия – царица наук. ХИМИЯ- это. наука о составе, строении, свойствах веществ и их превращениях. . Один литр морской ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 января 2019
Категория:Химия
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию




















![Скорость химической реакции и химическое равновесие. Скоростью химической реакции называется изменение концентрации веществ в ходе реакции в единицу времени: Кинетическое уравнение реакции: V = к∙[A]·[B] – выражение ЗДМ Для обратимой реакции A + B ↔ C + D в соответствии с ЗДМ Тогда в момент равновес Скорость химической реакции и химическое равновесие. Скоростью химической реакции называется изменение концентрации веществ в ходе реакции в единицу времени: Кинетическое уравнение реакции: V = к∙[A]·[B] – выражение ЗДМ Для обратимой реакции A + B ↔ C + D в соответствии с ЗДМ Тогда в момент равновес](https://prezentacii.org/upload/cloud/19/01/113933/images/thumbs/screen2.jpg)