Презентация "IV группа главная подгруппа. Углерод" по химии – проект, доклад
Презентацию на тему "IV группа главная подгруппа. Углерод" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
Углерод и кремний
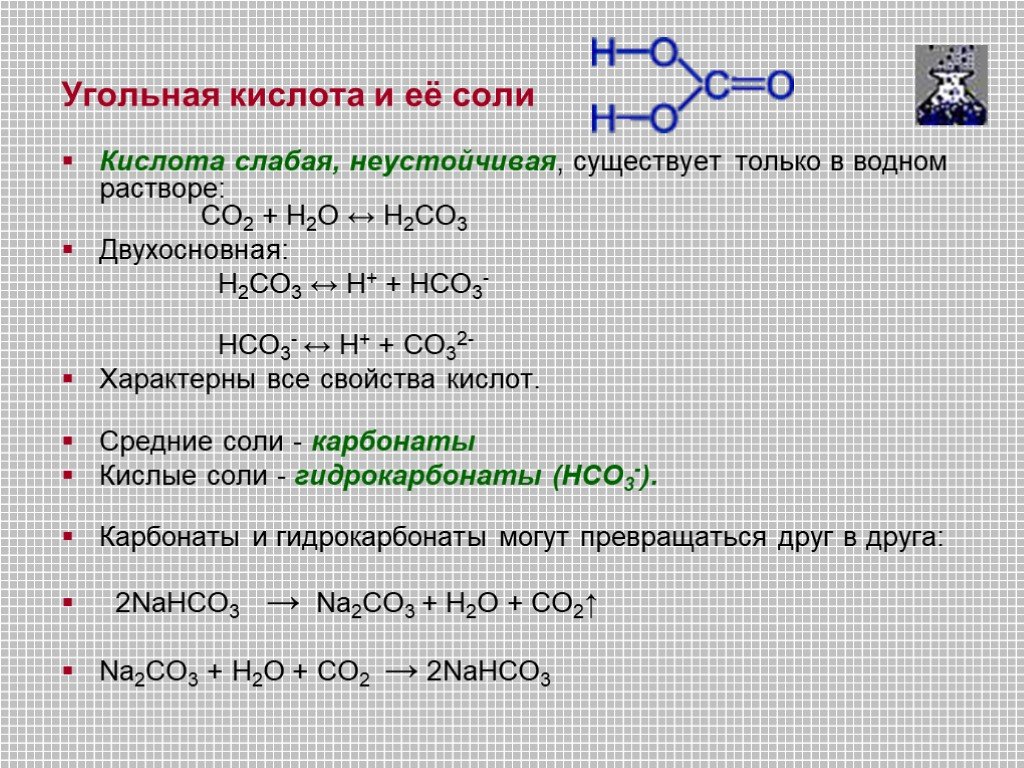
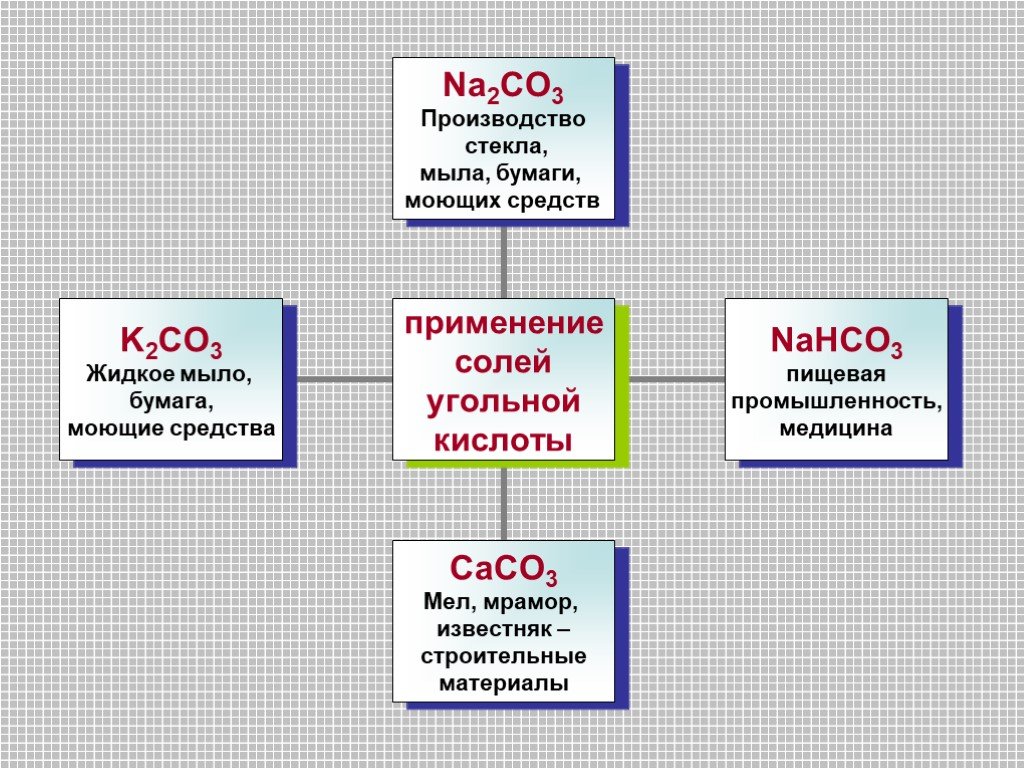
Нахождение в природе. Среди множества химических элементов, без которых невозможно существование жизни на Земле, углерод является главным. Более 99% ...Углерод и его соединения
Урок ведёт Шаркова Г. М. Присутствуют учащиеся 9 «а» класса. Цель Урока. • Повторить, систематизировать и расширить знания учащихся по данной теме ...Углерод и кремний
Углерод и кремний являются химическими элементами IVA-группы периодической системы. К этой же группе периодической системы относят германий Ge, олово ...Углерод и его свойства
Строение атома углерода. Углерод (лат. Carboneum) С – химический элемент IV группы периодической системы Менделеева: атомный номер 6, атомная масса ...Углерод и его соединения
Необходимо вспомнить. Положение химического элемента в таблице Д.И.Менделеева. Электронная формула атома углерода. Какие высшую и низшую степени окисления ...Углерод – химический элемент и простое вещество
Цели урока:. Познакомить учащихся с распространением химического элемента углерода в природе Вспомнить электронное строение атома углерода Закрепить ...Углерод и его свойства
Строение атома. В периодической таблице химических элементов углерод (С) расположен во втором периоде, в IV группе главной подгруппы. Углерод (С) ...Углерод
С, химический элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,011. C – алмаз,графит,карбин CaCO3 – кальций, ...Углерод - строение и свойства
Строение атома. Порядковый номер – 6 Строение атома: протонов – 6, нейтронов – 6, электронов – 6 Энергетических уровней – 2 Число электронов на последнем ...Углерод
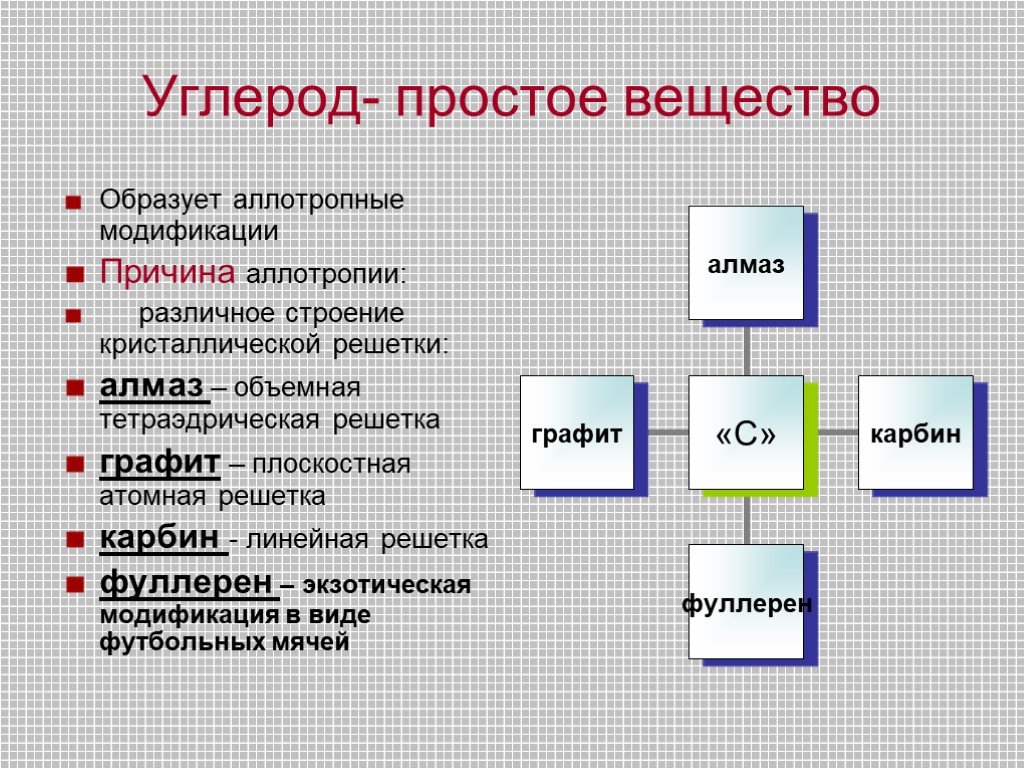
Строение и свойства атомов. Углерод С –первый элемент главной подгруппы IV группы Периодической системы. Степень окисления -4 ,+4. Углерод- простое ...Углерод
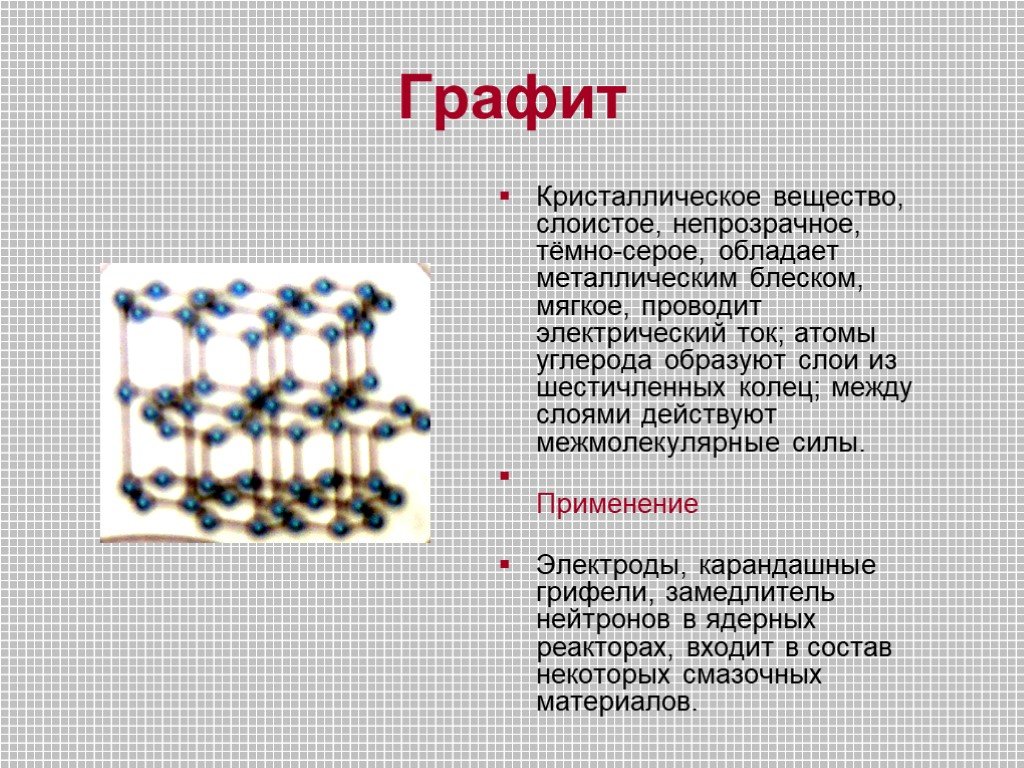
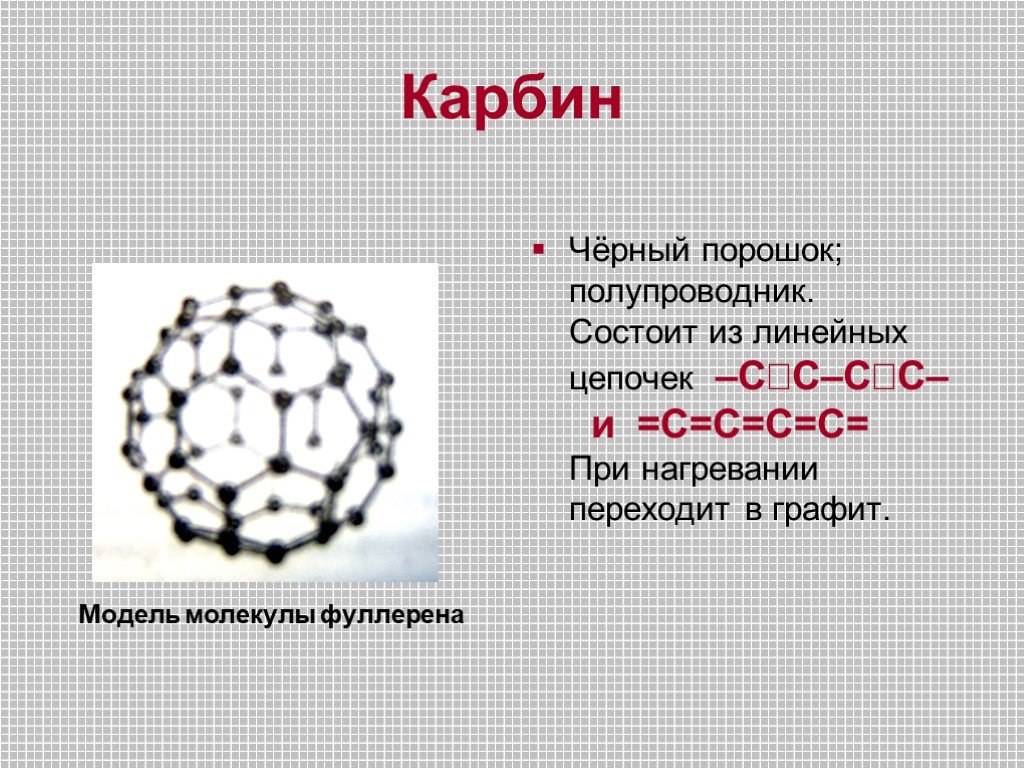
Строение атома -. Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций ...Углерод
Строение атома. Химический элемент IV группы периодической системы Менделеева Атомный номер 6 На внешнем энергетическом уровне содержит 4 электрона ...Углерод, соединения углерода
Цель занятия: обобщение, систематизация и углубление знаний по теме «Углерод и его соединения». Вопросник:. Элементы, содержащиеся в живых организмах. ...Урок Углерод
Девиз урока. «Мы столько можем, сколько знаем. Знания – сила». Ф.Бэкон. Цель урока:. дать общую характеристику элементам подгруппы углерода понятие ...Интегрированный урок (химия + английский язык) "Углерод"
Любое препятствие преодолевается настойчивостью. Леонардо да Винчи. CARBON. Carbon is the basic element of organic chemistry. It is in every living ...Углерод
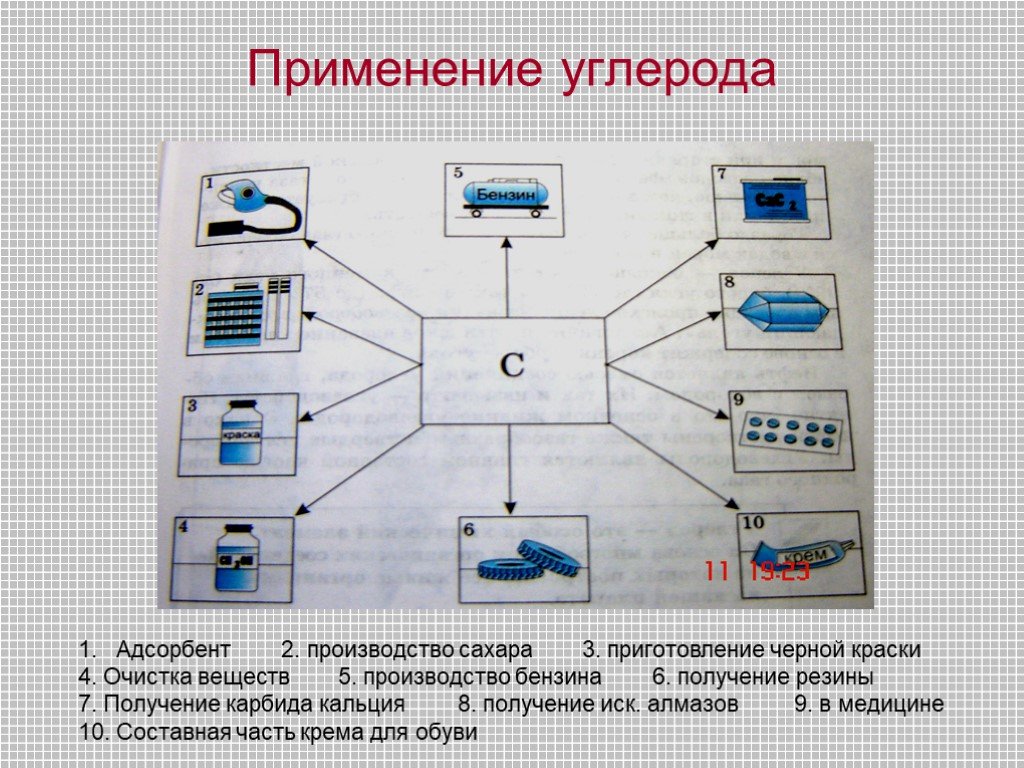
Общая характеристика углерода. В. Углерод (Carboneum-рождающий уголь) 1. Характеристика по ПСХЭ. а) неметалл б) IV группа, главная подгруппа в) II ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Конспекты
Подгруппа углерода. Углерод как простое вещество
Тема: «Подгруппа углерода. Углерод как простое вещество». Цель урока. :. Дать общую характеристику элементам. VI. А группы, показать аллотропные ...Углерод, аллотропия углерода. Химический свойства и применение углерода
Конспект урока по теме:. «Углерод, аллотропия углерода, физические и химический свойства. . . Применение углерода.». Выполнила:. Учитель ...Углерод и его союзники
Муниципальное автономное общеообразовательное учреждение. . средняя общеобразовательная школа №8. Конспект урока по химии на конкурс. ...Углерод и его соединения
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КУЛУНДИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1» , учитель химии высшей квалификационной категории ...Углерод и его соединения
Автор: . Абакумова Любовь Игоревна. Место работы, должность: . МБОУ СОШ №55 г. Воронеж. Учитель химии. Регион: . Город Воронеж. Стаж ...Углерод
Тема урока: Углерод. . . (Первый уровень). Интегрирующая цель:. . - знать строение атома, физические и химические свойствах углерода, понятие ...Углерод
Осминкина Людмила Николаевна, учитель химии МОУ «СОШ № 28» города Астрахани. . 9 класс «Углерод». Цели урока. . . Образовательная. - формирование ...Углерод
Муниципальное бюджетное общеобразовательное учреждение лицей 64. г. Краснодара. Конспект урока по химии. . в 9классе. «Углерод». ...Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Углерод, аллотропные модификации
Дата_____________ Класс_______________. Тема:. . Положение углерода и кремния в периодической системе химических элементов, строение их атомов. ...Общая характеристика неметаллов. Элементы IV А группы. Углерод, кремний и их соединения
План учебного занятия № 13. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 ноября 2018
Категория:Химия
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию