Презентация "Углерод и кремний" по химии – проект, доклад
Презентацию на тему "Углерод и кремний" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
Углерод и кремний
Углерод и кремний являются химическими элементами IVA-группы периодической системы. К этой же группе периодической системы относят германий Ge, олово ...Углерод и его соединения
Необходимо вспомнить. Положение химического элемента в таблице Д.И.Менделеева. Электронная формула атома углерода. Какие высшую и низшую степени окисления ...Углерод и его соединения
Урок ведёт Шаркова Г. М. Присутствуют учащиеся 9 «а» класса. Цель Урока. • Повторить, систематизировать и расширить знания учащихся по данной теме ...Углерод и его свойства
Строение атома. В периодической таблице химических элементов углерод (С) расположен во втором периоде, в IV группе главной подгруппы. Углерод (С) ...Углерод и его свойства
Строение атома углерода. Углерод (лат. Carboneum) С – химический элемент IV группы периодической системы Менделеева: атомный номер 6, атомная масса ...Углерод - строение и свойства
Строение атома. Порядковый номер – 6 Строение атома: протонов – 6, нейтронов – 6, электронов – 6 Энергетических уровней – 2 Число электронов на последнем ...Углерод – химический элемент и простое вещество
Цели урока:. Познакомить учащихся с распространением химического элемента углерода в природе Вспомнить электронное строение атома углерода Закрепить ...Углерод
Строение и свойства атомов. Углерод С –первый элемент главной подгруппы IV группы Периодической системы. Степень окисления -4 ,+4. Углерод- простое ...Углерод
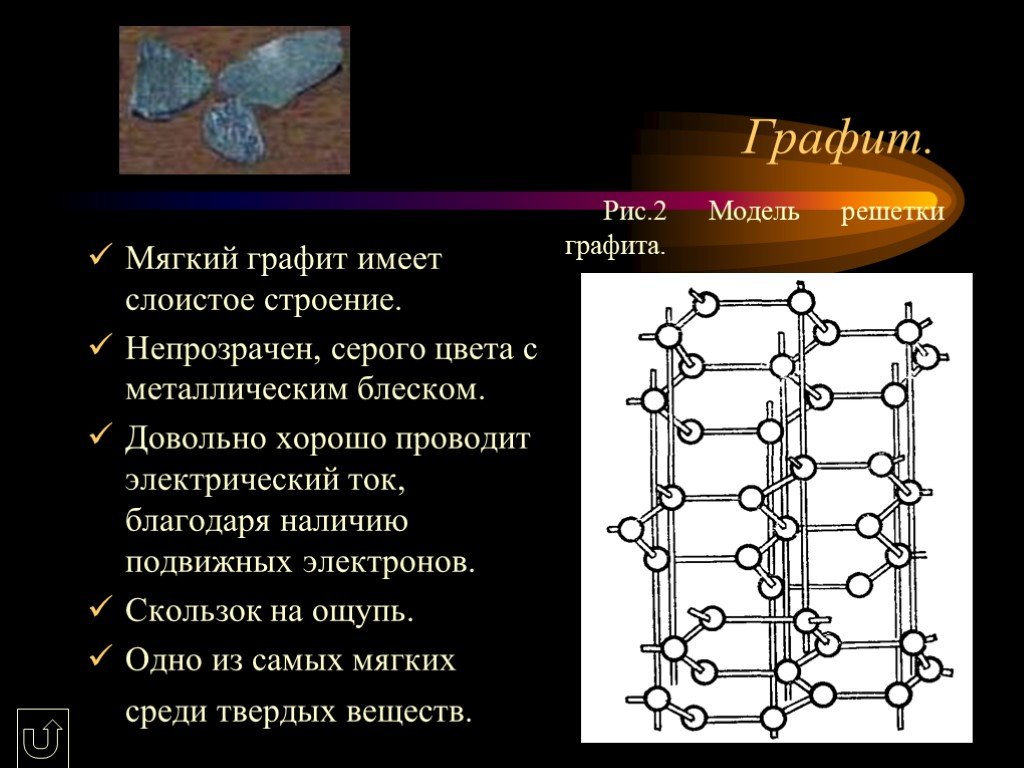
С, химический элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,011. C – алмаз,графит,карбин CaCO3 – кальций, ...Углерод
Строение атома -. Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций ...Углерод
Строение атома. Химический элемент IV группы периодической системы Менделеева Атомный номер 6 На внешнем энергетическом уровне содержит 4 электрона ...Углерод
Общая характеристика углерода. В. Углерод (Carboneum-рождающий уголь) 1. Характеристика по ПСХЭ. а) неметалл б) IV группа, главная подгруппа в) II ...Углерод, соединения углерода
Цель занятия: обобщение, систематизация и углубление знаний по теме «Углерод и его соединения». Вопросник:. Элементы, содержащиеся в живых организмах. ...Урок Углерод
Девиз урока. «Мы столько можем, сколько знаем. Знания – сила». Ф.Бэкон. Цель урока:. дать общую характеристику элементам подгруппы углерода понятие ...IV группа главная подгруппа. Углерод
Строение атома. Заряд ядра атома +6 2 энергетических уровня 4 электрона на внешнем энергетическом уровне …2S22P2 – строение внешнего энергетического ...Интегрированный урок (химия + английский язык) "Углерод"
Любое препятствие преодолевается настойчивостью. Леонардо да Винчи. CARBON. Carbon is the basic element of organic chemistry. It is in every living ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Конспекты
Общая характеристика неметаллов. Элементы IV А группы. Углерод, кремний и их соединения
План учебного занятия № 13. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Углерод, аллотропия углерода. Химический свойства и применение углерода
Конспект урока по теме:. «Углерод, аллотропия углерода, физические и химический свойства. . . Применение углерода.». Выполнила:. Учитель ...Углерод и его союзники
Муниципальное автономное общеообразовательное учреждение. . средняя общеобразовательная школа №8. Конспект урока по химии на конкурс. ...Углерод и его соединения
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КУЛУНДИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1» , учитель химии высшей квалификационной категории ...Углерод и его соединения
Автор: . Абакумова Любовь Игоревна. Место работы, должность: . МБОУ СОШ №55 г. Воронеж. Учитель химии. Регион: . Город Воронеж. Стаж ...Углерод
Тема урока: Углерод. . . (Первый уровень). Интегрирующая цель:. . - знать строение атома, физические и химические свойствах углерода, понятие ...Углерод
Осминкина Людмила Николаевна, учитель химии МОУ «СОШ № 28» города Астрахани. . 9 класс «Углерод». Цели урока. . . Образовательная. - формирование ...Углерод
Муниципальное бюджетное общеобразовательное учреждение лицей 64. г. Краснодара. Конспект урока по химии. . в 9классе. «Углерод». ...Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Углерод, аллотропные модификации
Дата_____________ Класс_______________. Тема:. . Положение углерода и кремния в периодической системе химических элементов, строение их атомов. ...Подгруппа углерода. Углерод как простое вещество
Тема: «Подгруппа углерода. Углерод как простое вещество». Цель урока. :. Дать общую характеристику элементам. VI. А группы, показать аллотропные ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 сентября 2018
Категория:Химия
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию