Конспект урока «Водород-элемент№1 периодической системы Д.И.Менделеева» по химии для 9 класса
Аннотация
к разработке интегрированного урока учителя биологии химии Мотайло Марины Валерьевны и учителя физики Скопиной Людмилы Александровны МОУ « Головчинская средняя школа с углубленным изучением отдельных предметов»
Класс: 9
Четверть:2
УМК: программа, учебник, рабочая тетрадь к учебнику авторской линии О.С.Габриеляна.
Тема урока: Водород-элемент№1 периодической системы Д.И.Менделеева.
Тип учебного занятия: урок изучения нового материала и первичного закрепления полученных знаний.
Форма проведения занятия: урок- презентация с элементами исследования и использованием интерактивной доски.
Методы и приемы: наглядные, исследовательские, проблемного изложения.
Дидактическое сопровождение: компьютер, мультимедиапроектор, интерактивная доска, презентация, видеоролик « Взрыв водорода в жестяной банке», периодическая система химических элементов, химические реактивы ( соляная кислота, цинк, вода, лабораторное оборудование.
Список использованной литературы:
-
Учебник О.С.Габриеляна « Химия- 9», изд.» Дрофа», 2007 год.
-
Виртуальная лаборатория. Открытая химия. 8-11 класс. [Электронный носитель]. – М.:
-
Габриелян О.С. Настольная книга учителя. Химия. 9 класс. – М.: Дрофа, 2002.
-
Уроки химии Кирилла и Мефодия. 8-9 класс. [Электронный носитель]. – М.: «Кирилл и Мефодий», 2002.
Урок в 9-м классе по теме: "Водород-элемент №1 периодической системы"
Цели урока: организовать деятельность учащихся по первичному восприятию сведений об особенностях строения и свойствах водорода, дать представление о специфических свойствах, роли в природе и использовании в деятельности человека.
Задачи:
-
в процессе исследования изучить способы получения и собирания водорода
-
развивать дальнейшие умения составлять уравнения химических реакций;
-
учить сравнивать, обобщать, анализировать и делать выводы;
-
развивать познавательную деятельность через эксперимент и посредством заданий развивающего и творческого характера;
Метод обучения: Объяснительно-иллюстративный, проблемно-поисковый, исследовательский.
Организационные формы: эвристическая беседа, самостоятельная работа, лабораторный практикум , сообщения учащихся
Средства обучения: ПСХЭ, химическое оборудование и реактивы, медиапроектор, интерактивная доска.
Ход урока
1.Орг. момент.
2. Мотивационно - ориентационный этап
Тема нашего урока связана с известным вам элементом и веществом. Используя подсказки, определите, о чем идет речь?
Это вещество достаточно редкий гость на Земле, но элемент№1 в космическом пространстве. В газообразном виде его выделил 240 лет назад английский химик Г.Кавендиш. Свойства полученного им газа были необычны- он прекрасно горел , был легок, почти в 15 раз легче воздуха. Свое название он получил оттого, что при горении давал не сажу и копоть, а воду. Именно эта его особенность больше всего привлекает представителей экологических организаций и партии «зеленых». О каком газе идет речь?
Ученики: О Водороде
Учитель: Итак, тема нашего урока «Водород». Нам предстоит написать о нем книгу. Какие бы главы вы выделили?
Общая характеристика
Применение Водород в природе
Химические свойства Водород Физические свойства
Получение
3. Изучение нового материала
Учитель физики: ? Где встречается водород в природе?
Используя дополнительную информацию « Водород в природе», заполните таблицу
| Хочу узнать | Думал иначе | |
| | | |
*обсуждение работы
Водород – самый распространенный элемент в космосе:
1.Основная масса звезд состоит из водорода: Юпитер, Сатурн – 92% Н, 8 % Н е, 0,1 % все остальные химические элементы; водород преимущественно составляет межзвездное вещество. В природе водород встречается в виде трех изотопов — протия ( Н) (99,98%) и дейтерия (D) (0,019%) и трития (Т) ( 0,01%). На Земле водород встречается только в виде соединений.
2. Залежи на Марсе, Юпитере, Венере.
3. Северное сияние- поток ионов водорода на Землю
4. Водород составляет половину массы Солнца.
Каждую секунду Солнце излучает в космическое пространство энергию, эквивалентную примерно 4 млн. т массы. Эта энергия рождается в ходе слияния четырех ядер водорода, протонов, в ядро гелия; реакция идет в несколько стадий, а ее суммарный результат записывается вот таким уравнением:
411Н+ → 42Не2+ + 2е+ + 26,7 МэВ.
Много это или мало –26,7 МэВ на одно химическое превращение? Очень много: при «сгорании» 1 г протонов выделяется в 20 млн. раз больше энергии, чем при сгорании 1 г каменного угля. На Земле такую реакцию еще никто не наблюдал: она идет при температуре и давлении, существующих лишь в недрах звезд и еще не освоенных человеком. За время существования Солнца уже около половины водорода в его центральной области превратилось в гелий и вероятно ещё через 5 млрд. лет, когда в центре светила водород будет на исходе, Солнце ( жёлтый карлик в настоящее время) увеличится в размерах и станет красным гигантом.
Учитель химии:
Общая характеристика элемента и вещества
Заполнение визитной карточки элемента водород ( см. стр.3 учебника « Химия-9» авт.О.С.Габриеляна)
Водород занимает первое место в периодической системе (Z = 1). Он имеет строение атома: ядро атома окружено электронным облаком. Электронная конфигурация 1s1.
Проблемный вопрос: Почему водород занимает в ПСХЭ 2 места одновременно- в 1 и 7 группах?
В одних условиях водород проявляет металлические свойства (отдает электрон), в других — неметаллические (принимает электрон). Однако по свойствам он более сходен с галогенами, чем со щелочными металлами. Поэтому водород помещают в VII группу периодической системы элементов Д.И. Менделеева, а в I группе символ водорода заключают в скобки.
Общая характеристика вещества ( заполните сведения о водороде как веществе)
Число атомов в молекуле-2
Вид химической связи - ковалентная неполярная
Тип кристаллической решетки – молекулярная
Молекулярная масса-2
Молярная масса-2 г/моль
Газ без вкуса, цвета, запаха.
Учитель химии: Получение водорода
Проблемный вопрос: Если бы перед вами стояла задача: получить большое количество водорода, - какое сырье вы бы выбрали и почему?
Учащиеся: Воду, так как это самое распространенное вещество на Земле.
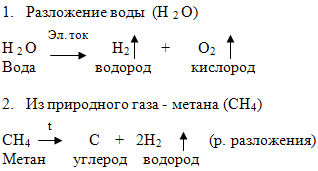
Учитель: Да, верно, вода – самый доступный источник водорода. Действительно в промышленности получают водород из воды электролизом-действием тока, идет реакция разложения воды с образованием двух веществ: водорода и кислорода. Но этот способ сравнительно дорогой. ( Почему? Выгодно ли его использовать на территории нашей области?)
Используя стр.102 учебника найдите более дешевый способ получения водорода.
Получение водорода в промышленности .
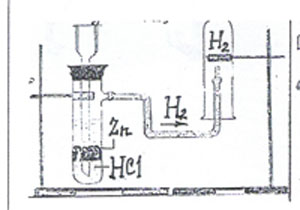
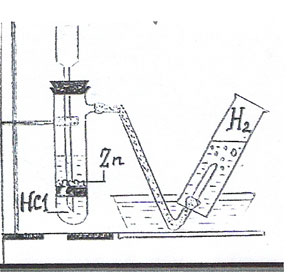
Как можно получить водород в лаборатории? Используя выданное лабораторное оборудование, соберите прибор для получения водорода.
Из каких же веществ можно получать водород? Обоснуйте свой выбор.
| |
Существует два способа собирания водорода:
-Собирание водорода методом вытеснения воздуха
- Собирание водорода методом вытеснения воды
Полученный тем или иным способом водород может быть загрязнен воздухом, с которым может образовывать взрывчатую смесь (смесь водорода и кислорода в объемном отношении 2:1 называется, “гремучим газом”), это опасно! Поэтому полученный водород проверяют на чистоту. ( демонстрация видеоролика « Взрыв водорода в жестяной банке)
Реакция получения водорода в лаборатории проводится и в аппарате Киппа, происхождение его названия связано с голландской фирмой, выпускавшей эти аппараты. В одно из отделений закладывается Zn, а в другое наливается кислота, газ выходит по газоотводной трубке. ( Демонстрация учителя аппарата Киппа )
Доказательства наличия водорода: Наполняем пробирку водородом и подносим ее открытым концом к пламени – если услышим хлопок со свистом, то водород загрязнен, если же хлопок глухой -то водород чистый.
Аппарат Киппа - химический прибор, имеющий свой аналог в природе! ( сообщение учащихся)
Прибор изобрёл в середине XIX века голландский фармацевт Якоб Кипп. Аппарат Киппа существует в природе, в организме жуков-бомбардиров. Небольшое оранжево-синее насекомое, защищаясь от нападения врага, выбрасывает нагретую до высокой температуры газовую струю. Газовая струя обращает в бегство напавшего на жука муравья, вызывает небольшой ожог на коже человека. Газовую струю образуют две крохотные железы, расположенные в конце брюшка. В организме насекомого, как и в аппарате Киппа, нет запаса сжатого газа. Он создаётся по мере необходимости в результате реакции негазообразных веществ. Различие между железами жука и аппаратом Киппа в способе прекращения реакции. В аппарате Киппа надо перекрыть кран газоотводной трубки, тогда накапливающийся газ вытесняет жидкий реагент из реакционной камеры в воронку. В железе жука мышца-«кран» расположена не на выходе, а на входе в реакционную камеру и регулирует поступление новых порций реагентов. Аппарат Киппа работает непрерывно, аппарат жука - периодически. При этом жук использует не только продукты реакции, но и выделяющуюся при этом теплоту .
Учитель физики: Что с физической точки зрения представляет собой водород?
Физические свойства водорода: газ, без цвета, без запаха, без вкуса, практически нерастворим в воде, почти в 14,5 раз легче воздуха (самый легкий из всех газов); имеет низкую температуру плавления (-259,10 С) и низкую температуру кипения (-2530 С); водород обладает хорошей теплопроводностью (в 7 раз больше, чем воздух).
Как вы думаете, почему? (кинетическая энергия молекул газов зависит от температуры. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Следовательно, молекулы водорода движутся быстрее молекул другого газа и тем самым быстрее передают теплоту от одного тела к другому).
Где может использоваться это свойство водорода? ( для отведения избытка тепла в электрических машинах)
Учитель химии:
Все газообразные вещества подчиняются газовым законам: закон Авогадро ( в равных объемах различных газов при одинаковых условиях ( температуре, давлении, объем) содержится одинаковое количество вещества. Следовательно, любые газы в количестве, равном 1 моль, занимают одинаковый объем.
Молярный объем- 22,4 л/ моль.
В 10 классе на уроках физики используется уравнение Менделеева- Клайперона, описывающее состояние идеального газа:
PV=nRT
Как вы думаете, будет ли водород подчиняться этому газовому закону? Какие величины формулы Вам известны?
Учитель физики: Применение водорода - обусловлено его свойствами.
Как вы думаете, где возможно применение водорода? Сравните свои предположения с истинным применением водорода , пользуясь рис.46 учебника стр.101.
( сообщения учащихся)
Впервые осуществили идею подняться на воздушном шаре, наполненном горячим воздухом братья – французы Монгольфье. В 1783 году совершил полет на воздушном шаре, наполненном водородом французский физик Ж. Шарль. В 1794 году воздушные шары нашли практическое применение в военном деле. Впоследствии стали применять смесь водорода с гелием. Это было более безопасно, так как водородные шары часто воспламенялись. С 1932 по 1937 год немецкий дирижабль “Граф Цеппелин” совершил 136 полетов из Европы в Южную Америку и 7 полетов – в США и перевез свыше 13 тысяч человек. Потом дирижабли были постепенно вытеснены успехами авиации и вертолетостроения. Сейчас вновь обсуждаются вопросы создания современных дирижаблей. В этом качестве первый элемент Таблицы Менделеева применяли вплоть до 1937 года, когда в воздухе сгорел крупнейший в мире, в два футбольных поля размером, заполненный водородом немецкий дирижабль «Гинденбург». Катастрофа унесла жизни 36 человек, и на таком использовании водорода был поставлен крест. С тех пор аэростаты заправляют исключительно гелием. Гелий — газ, увы, более плотный, но зато негорючий.
Другое универсальное свойство водорода – самая высокая теплопроводность среди всех газов – находит применение в современной энергетике для охлаждения электрических машин. Водород - это топливо будущего, существует много примеров создания и применения топливных элементов. Например: подобный агрегат служит источником воды и энергии в космических кораблях, двигателях автомобилей, подводных лодках.
Одно время высказывалось предположение, что в недалёком будущем основным источником получения энергии станет реакция горения водорода, и водородная энергетика вытеснит традиционные источники получения энергии (уголь, нефть и др ). В 1979 году компания BMW выпустила первый автомобиль, вполне успешно ездивший на водороде, при этом не взрывавшийся и выпускавший из выхлопной трубы водяной пар. В эпоху усиливающейся борьбы с вредными выхлопами машина была воспринята как вызов консервативному автомобильному рынку. Вслед за BMW в экологическую сторону потянулись и другие производители. Баварские автомобилестроители в рамках программы CleanEnergy («чистая энергия») приспособили под езду на Н2 несколько «семерок» и MINI Cooper. Оборудованная 4-литровым двигателем водородная «семерка» развивает мощность в 184 лошадиные силы и проходит на одной заправке (170 литров жидкого водорода «под завязку») 300 км. Но большинство производителей пошли по пути создания электромобилей на топливных элементах.
А больше всех новым топливом заинтересовались японцы. И это понятно. Эта страна, практически лишенная хоть каких-нибудь природных запасов нефти и газа, обладает неограниченными объемами сырья для водорода (в виде океанской воды) и поистине завидной сообразительностью населения. А поэтому здесь водородные аналоги есть практически у любого вида техники — от работающего на топливных элементах локомотива до человекоподобного робота SpeecysFC. К тому же японцы вовсю ведут разработки топливных элементов для ноутбуков и мобильных телефонов.
Водород и будущее
Слова «дейтерий» и «тритий» напоминают нам о том, что сегодня человек располагает мощнейшим источником энергии, высвобождающейся при ядерных реакциях. Эта реакция начинается при 10 млн. градусов и протекает за ничтожные доли секунды при взрыве термоядерной бомбы, причем выделяется гигантское по масштабам Земли количество энергии. Отцом водородной бомбы в Советском Союзе по праву считается А.Д. Сахаров. Первая советская водородная бомба была взорвана 12 августа 1953 года. Однако следует заметить, что американская «бомба» представляла собой лабораторный образец, фактически «дом, наполненный жидким дейтерием», выполненный в виде специальной конструкции, а советская бомба была законченным устройством, пригодным к практическому применению. Впрочем, мощность взорванного американцами устройства составляла 10 мегатонн, в то время как мощность бомбы конструкции академика Сахарова — 400 килотонн. Самая крупная когда-либо взорванная водородная бомба — советская 50-мегатонная «царь-бомба», взорванная 30 октября 1961 года на полигоне архипелага Новая Земля. Никита Хрущёв впоследствии публично пошутил, что первоначально предполагалось взорвать 100-мегатонную бомбу, но заряд уменьшили, «чтобы не побить все стёкла в Москве». Конструктивно бомба действительно была рассчитана на 100 мегатонн.. Бомба была взорвана на высоте 4000 метров над полигоном «Новая Земля». Ударная волна после взрыва три раза обогнула земной шар. Несмотря на успешное испытание, бомба на вооружение не поступила[]; тем не менее, создание и испытание сверхбомбы имели большое политическое значение, продемонстрировав, что СССР решил задачу достижения практически любого уровня мегатоннажа ядерного арсенала. Любопытно отметить, что после этого прекратился рост мегатоннажа ядерного арсенала США.
Водородные бомбы иногда сравнивают с Солнцем. Однако мы уже видели, что на Солнце идут медленные и стабильные термоядерные процессы. Солнце дарует нам жизнь, а водородная бомба – сулит смерть...
Закрепление материала (Разноуровневые задания:)
1 уровень
-
Вставьте пропущенные слова
1. Водород – самый легкий химический элемент, так как его атомная масса равна …
2. В природе встречаются тяжелые формы атомов водорода … и …. . Такие разновидности атомов одного элемента с разной атомной массой называются ….
3. Самым важным источником водорода на Земле является …. .
4. Вещество водород при обычных условиях - …., не имеющий …. , …, …..
5. Водород легче воздуха в … раз, поэтому его можно использовать в …..
6. Водород – мощный источник ….
7. Ученый, создатель водородной бомбы – ….
2 уровень
Сравните водород с металлами 1 группы и неметаллами 7 группы. Что общего у этих элементов. Почему основное место водорода в ПСХЭ все-таки 7 группа, а не первая?
3 уровень
Задача: Какой объем водорода выделится при электролизе воды массой 360 г, если выход продукта реакции составляет 85% от теоретически возможного.
5. Домашнее задание:п.17 упр.1, 3* ( по выбору)+ творческое задание
Подготовить презентацию, сообщение по темам:
«Водород в энергетике будущего», «Водород во Вселенной», « Д.И.Менделеев и воздухоплавание»
6. Итоги урока. Рефлексия.
Здесь представлен конспект к уроку на тему «Водород-элемент№1 периодической системы Д.И.Менделеева», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.