Конспект урока «Кислород. Водород. Вода» по химии



















































































 Урок: «Кислород. Водород. Вода».
Урок: «Кислород. Водород. Вода».
Урок повторения и закрепления материала.
Цели и задачи: расширить знания учащихся, закрепить умение учеников давать названия веществам; приобрести и закрепить новые умения по изучению веществ, составлению химических реакций; систематизация, коррекция знаний учащихся, проверка уровня сформированности основных понятий темы, умений составлять формулы веществ, уравнения реакций; развитие интереса к знаниям, навыков самоанализа и самоконтроля, воспитание чувств ответственности перед коллективом.
Ожидаемый результат:
1. Знать: 1) состав и строение оксидов, гидридов, гидроксидов;
2) химические свойства оксидов;
3) способы получения оксидов;
4) условия химических превращений.
2. Уметь : 1)составлять уравнения химических реакций
2)составлять формулы веществ
Требования к усвоению теоретического материала : знать основные положения атомно-молекулярного учения , в свете которого уметь применять следующие понятия :атомная и молекулярная масса, количество вещества, молярная масса , молярный объём, простые и сложные вещества, химическая валентность, оксиды, основания, химическая реакция, типы реакций. Знать формулировку закона сохранения массы веществ. Применять закон при проведении расчётов.
Требованию к усвоению фактов: знать состав молекул кислорода, водорода, воды, изученных оксидов , оснований.
Требования к усвоению химического языка: знать символы химических элементов , уметь разъяснять смысл химических формул и уравнений. Уметь на основании знаний валентности атомов химических элементов, формулы оснований, давать названия изученным оксидам ,основаниям, составлять уравнения изученных реакций.
Требования к выполнению химического эксперимента: знать правила работы с веществами и простейшим оборудованием. Уметь обращаться с пробирками, мерными сосудами, лабораторным штативом, спиртовкой, растворять твёрдые вещества, проводить нагревание, фильтрование, проверить водород на чистоту, готовить растворы с определённой долей растворённого вещества, соблюдать правила техники безопасности, уметь оказывать первую помощь при ожогах кислотами и щелочами.
Методы обучения: беседа, групповая работа, работа у доски.
Оборудование:
Урок состоит из двух частей.
Первая часть урока :теоретическая.
Ученики сигнализируют о своём эмоциональном состоянии с помощью карточек с рисунками:
Например, вот такими:
Хорошее: Среднее: Плохое:
![]()
![]()
![]()
Первый этап : вызываю ребят для работы у доски и на своих местах.
Учитель : «Ребята , сейчас мы посетим холм знаний».
C S H2 H2O O2 Ca Na P
Составьте уравнения этих реакций.
Задание для второго ученика. «Химическое лото». Заполните пустые клетки формулами веществ, чтобы получить уравнения реакций, расставьте необходимые коэффициенты:
| + | | + | NaOH | |||||
| + | ||||||||
| NaOH | + | | Na2O | |||||
|
| ||||||||
Задание для третьего ученика: « Крестики-нолики». Определите выигрышные пути-линии, которые составляют только оксиды.
| H2S | Na2O | |
| SO2 | Al2O3 | NaCl |
| SO3 | CaO | CO2 |
Задание для четвёртого ученика: « Крестики-нолики». Определите выигрышные пути-линии, которые составляют только гидриды.
-
SO2
CaO
CuS
Fe3O4
AqCl
Na2O
NaH
CaH2
KH
Задание для пятого ученика: озвучить применение оксидов и гидроксидов в быту и промышленности, используя учебные пособия , выполненные учащимися. В это время учитель работает с классом.
Учитель: « Ребята! Давайте проведём небольшую литературную экскурсию, после которой проверим работы ребят».
Первый отрывок из сказки «Мороз Иванович»:
«Между тем Рукодельница воротится, в кувшин нальёт, да ещё какая затейница: коли вода не чиста, так свернёт листок бумаги, наложит в неё угольков да ещё песка крупного насыпет, вставит ту бумагу в кувшин да нальёт в неё воды, а вода та знай проходит сквозь песок да сквозь уголья и каплет в кувшин чистая, словно хрустальная…»
Вопрос: Объясните действия Рукодельницы.
Ответ: Она использовала один из методов разделения смесей-фильтрование, с помощью которого очистила воду от взвешенных частиц, а с помощью угольков была произведена дальнейшая очистка воды путём адсорбции.
Второй отрывок из сказки «Мороз Иванович»:
«-А зачем ты , Мороз Иванович , - спросила Рукодельница, -зимою по улицам ходишь да в окошко стучишься?
А я затем в окошко стучусь, - отвечал Мороз Иванович, - чтоб не забывали печей топить и трубы вовремя закрывать;
А не – то ведь я знаю, есть такие неряхи , что печку истопят, а трубу закрыть не закроют, да не вовремя, когда ещё не все угольки прогорели , а оттого в горнице угарно бывает, голова у людей болит, в глазах зелено ; даже и совсем от угара умереть можно».
Вопрос: Почему нельзя закрывать трубу , когда не все угольки прогорели? Что такое угар? Почему от угара можно умереть?
Ответ: При горении угля в печи происходит химическая реакция горения угля.
С+О2=СО2+402 кДж.
Углекислый газ СО2 уходит в трубу. После того, как уголь прогорел, трубу закрывают, чтобы сохранить тепло в печи. Но если трубу закрыть до того , как угли прогорели, то в печи скапливается избыток углекислого газа , который взаимодействует с ещё раскалёнными углями. Происходит восстановление СО2 до СО-угарного газа:
СО2+С->2CO-160 кДж.
Угарный газ при закрытой трубе проникает в комнату , где спят люди. При его вдыхании в организме человека образуется стойкое соединение с гемоглобином крови. Поскольку переносчик кислорода оказывается блокирован и не может транспортировать кислород, начинается кислородное голодание тканей организма. В результате этого у человека возникает головокружение, рвота, удушье, что может привести к смерти.
Строки из стихотворения Л.Шипахиной « Наш праздник»:
« Есть праздник особый и древний,
Где пир на широких столах,
Где ели-лесные деревья
Растут на паркетных полах.
Светло от хрустального звона
Прозрачен снежинок накрап.
И падают капли озона
С широких игольчатых лап…»
Вопрос: Как переложить на язык химии поэтическую метафору этих строчек?
Ответ: Озон-аллотропная модификация кислорода, он образуется из кислорода воздуха в грозу:
3О22О3
Именно запах озона , как ощущение свежести мы чувствуем после грозового дождя.
Озон образуется также при окислении смолы хвойных деревьев. Поэтому в хвойных лесах легко дышится , мы чувствуем то же ощущение свежести , как и после дождя.
О возможности использования воды , как источника тепловой энергии писал Ж.Берн:
-Какое топливо заменит уголь?
-Вода, - ответил инженер.
-Вода?- переспросил Пенкроф…
Да , но вода , разложенная на составные части, - пояснил Сайерс Смит. –Без сомнения, это будет делаться при помощи электричества, которое в руках человека станет могучей силой.. Да ,я уверен, что наступит такой день и вода заменит топливо; водород и кислород, из которых она состоит, будут применяться и раздельно; они окажутся неисчерпаемым и таким мощным источником тепла и света, что углю до них далеко! Наступит день . друзья мои, и в трюмы пароходов будут грузить не уголь , а баллоны с двумя этими сжатыми газами, и они будут сгорать с огромнейшей тепловой отдачей. .. Вода- это уголь грядущих веков.
Вопросы: Как называется процесс разложения воды на кислород и водород под действием электричества? Какой газ , получаемый при этом, можно использовать как топливо? Каким преимуществом обладает он перед другими видами топлива?
Ответ: Процесс разложения воды под действием электрического тока называется электролизом:
2Н2О2Н2 +О2.
В виде топлива можно использовать газ водород, так как при его горении выделяется большое количество теплоты. Особенно большое значение в перспективе будет иметь водород, как экологически чистое топливо, ибо при его сгорании образуются водяные пары, не отравляющие атмосферу. Для осуществления этой идеи потребуется разработать экономически выгодные условия проведения электролиза воды.
Обсуждаем результаты работы учащихся у доски.
После обсуждения ответа пятого ученика , дополняем ответ, демонстрируя видеофрагмент, иллюстрирующий применение оксидов в быту и промышленности.
Второй этап. Практика под руководством учителя.
Учитель: «Посетим холм «Творчества»». Учитель вызывает ученика для выполнения игры «Художник + химик» Необходимо соответствующими уравнениями реакций проиллюстрировать различные рисунки. Например , такие:

NaOH
В это время ребята вместе с учителем выполняют задание «Река превращений»:
Учитель: На реке превращений:
(PP2O5H3PO4Na3PO4Aq3PO4H3PO4)
На речке превращений
Смотрели мы явления!
Пусть эти превращения
Дадут вам уравнения
Красный фосфор я сжигала,
В дымку-воды я приливала,
Окрашивала лакмусом,
Стал красивым красным он!
Добавила натрия гидроксид-
Цвет фиолетовый в колбе возник.
Потом получила фосфат серебра,
Цветом-лимонная кожура.
Растворила осадок жёлтый
Добавила кислоты азотной…
В тетрадях своих превращения эти
Вы отразите милые дети!
И в чём тут дело, в чем секрет
Раскроет полный ваш ответ!
Кто составил цепочку химических превращений, увиденных на Реке превращений?
Один из учеников читает всю цепочку превращений. На доске открывается фрагмент:
(PP2O5H3PO4Na3PO4Aq3PO4H3PO4)
Идёт самостоятельная работа по составлению уравнений.
Лучшие ученики приглашаются к доске. Учитель проверяет их записи, раскрывает последний фрагмент доски и предлагает ученикам, составившим уравнения, поочерёдно их прочитать.
-
4P+5O2=2P2O5
-
P2O5+3H2O=2H3PO4
-
H3PO4+3NaOH=Na3PO4+3H2O
-
Na3PO4+3AqNO3=Aq3PO4+3NaNO3
-
Aq3PO4+3HNO3=3AqNO3+H3PO4
Данную цепочку превращений учитель вместе с одним из учеников иллюстрируют, выполняя эксперимент.
Вторая часть урока: практическая.
Третий этап-независимая самостоятельная практика обучаемых.
Во второй части ученики работают группами, коллективно обсуждая правильный вариант решения «химического лабиринта». Звучит спокойная музыка, ребята работают.
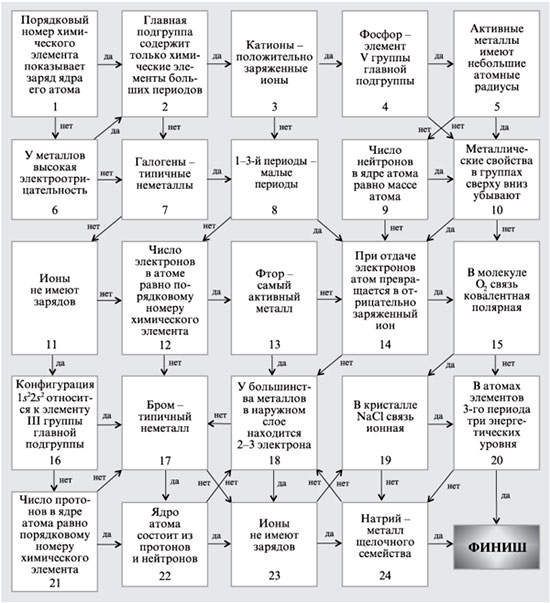
да да нетнет
СО2 не способен гореть в атмосфере кислорода При окислении сероводорода(SO2)образуются два оксида H2O и SO2 В результате реакции горения образуются оксиды КСlO3-оксид Воздух-это индивидуальное вещество
да не да нет
нет
Молекула кислорода состоит из двух атомов Кислород тяжелее воздуха
Оксиды –сложные вещества Кислород имеет молекулярное строение СО2-формула составлена неправильно
да да
нет
да нет да
Кислород в молекулах воды-простое вещество Реакция распада HqO на Hq и O2 относится к реакциям разложения Кислород выделяется при нагревании KMnO4 Mr(O2)=16
Аr(O)=32
да да
Кислород-металл
Кислород поддерживает горение Кислород имеет запах и цвет Кислород воздуха-простое вещество Валентность кислорода в соединении OF2 равна I
Кислород хорошо растворим в воде Горение серы-реакция соединения ФИНИШ: «Повторение-мать учения!»
Кислород собирают методом вытеснения воздуха Al2O3-формула оксида составлена верно
да да
Здесь представлен конспект к уроку на тему «Кислород. Водород. Вода», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.