Презентация "Металлы " (10 класс) по химии – проект, доклад
Презентацию на тему "Металлы " (10 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 18 слайд(ов).
Слайды презентации
Список похожих презентаций
Металлы в организме человека
Человек – это мыслящий орган природы, другого значения он не имеет. Посредством человека материя стремится познать саму себя. В этом – всё. М. Горький. ...Металлы в периодической системе
Задачи урока 28.12.2017. Повторить известное: металлическая связь, образование и характеристика. Узнать новое: положение металлов в периодической ...Металлы в нашей жизни
Творческое название проекта. Cu AI Fe Ni Co Mg Cr Na Zn И ЭТО ВСЕ О НИХ …. Основополагающий вопрос:. Действительно ли металлы и металлургия оказывают ...Металлы и сплавы -материал для древних и современных олимпийских наград
Олимпийская медаль— знак отличия за спортивные достижения в соревнованиях на Олимпийских играх. Олимпийские медали всегда были больше, чем простые ...Металлы тоже воевали
Цели урока:. Углубить представление о многообразии металлов и их значении. Показать, что победа ковалась и в тылу трудом многих советских людей, видных ...Металлы и человек
Тема проекта: «Влияние металлов IV A группы на жизнедеятельность организма человека». Эпиграф:. «Не будем, однако, слишком обольщаться нашими победами ...Металлы и Неметаллы в химии
Металлы. Большинство встречающихся в природе простых веществ - металлы. Некоторые из них мы часто встречаем в повседневной жизни, так что знаем, как ...Металлы и коррозия металлов
Рецензия на научную исследовательскую работу «Металлы и коррозия металлов». Интерес данной работы заключается в том, что тема работы носит познавательное, ...Металлы и неметаллы
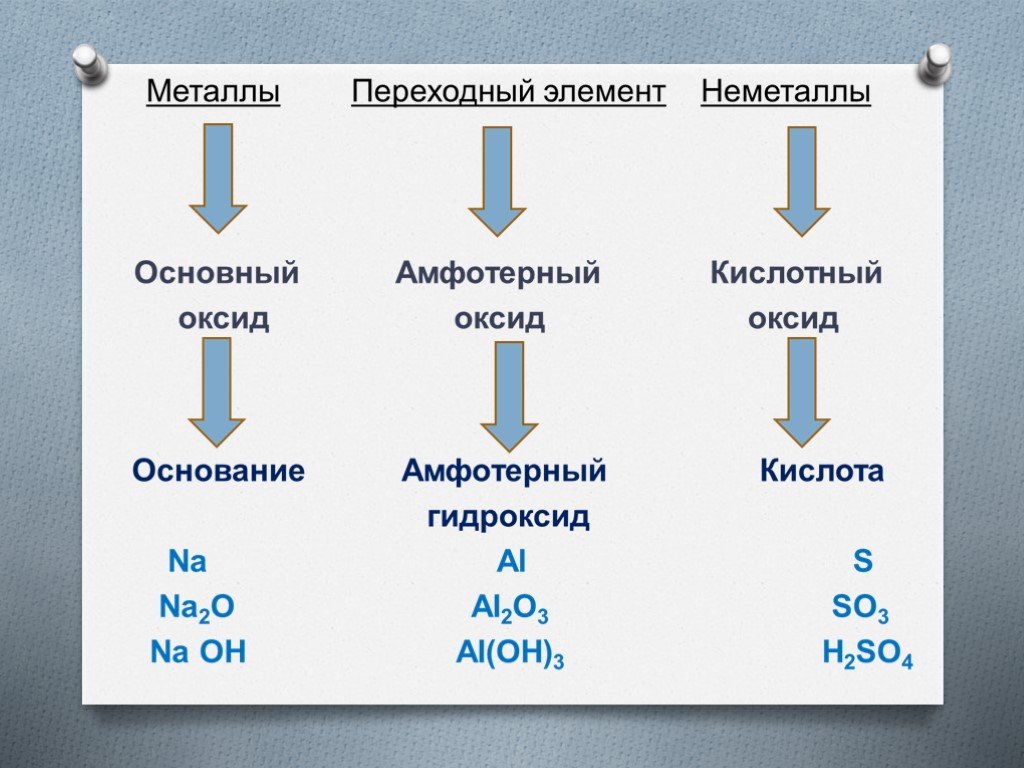
Классификация веществ по составу:. Простые вещества состоят из атомов одного химического элемента. Сложные вещества состоят из атомов разных химических ...Металлы в природе. Общие способы их получения
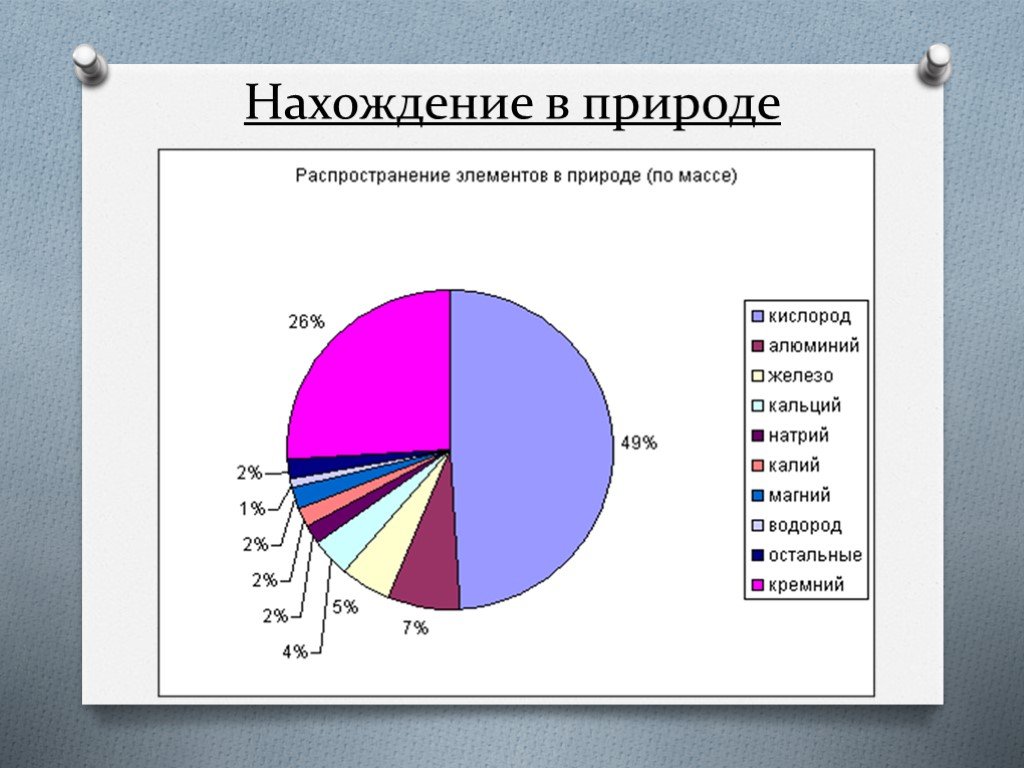
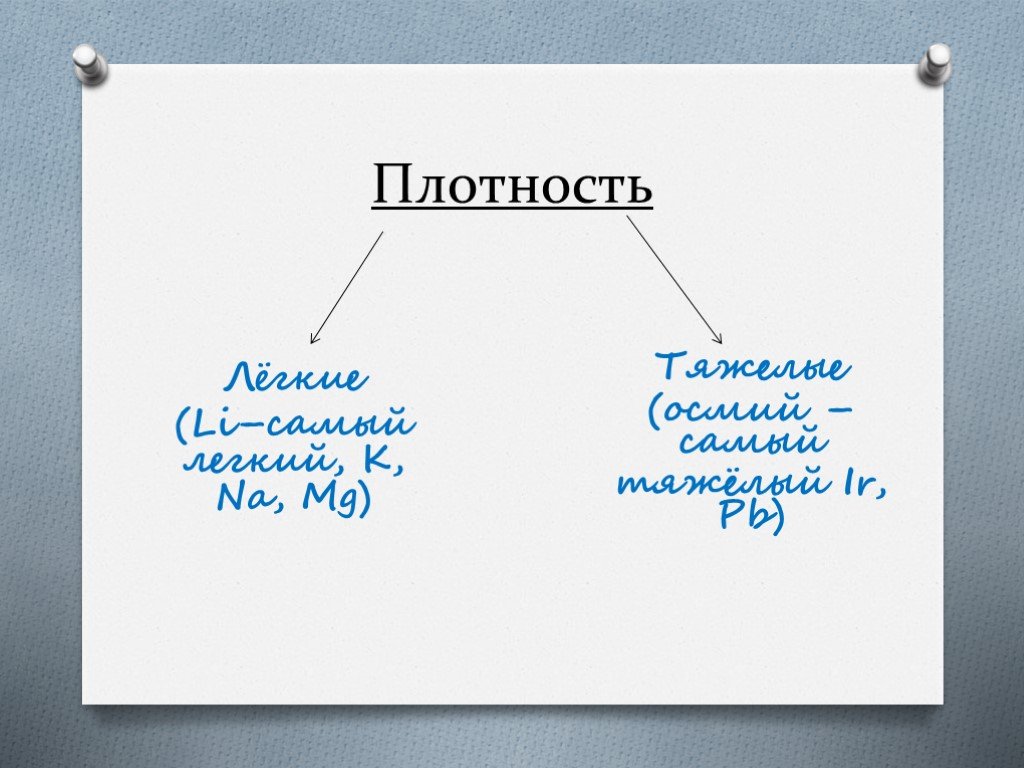
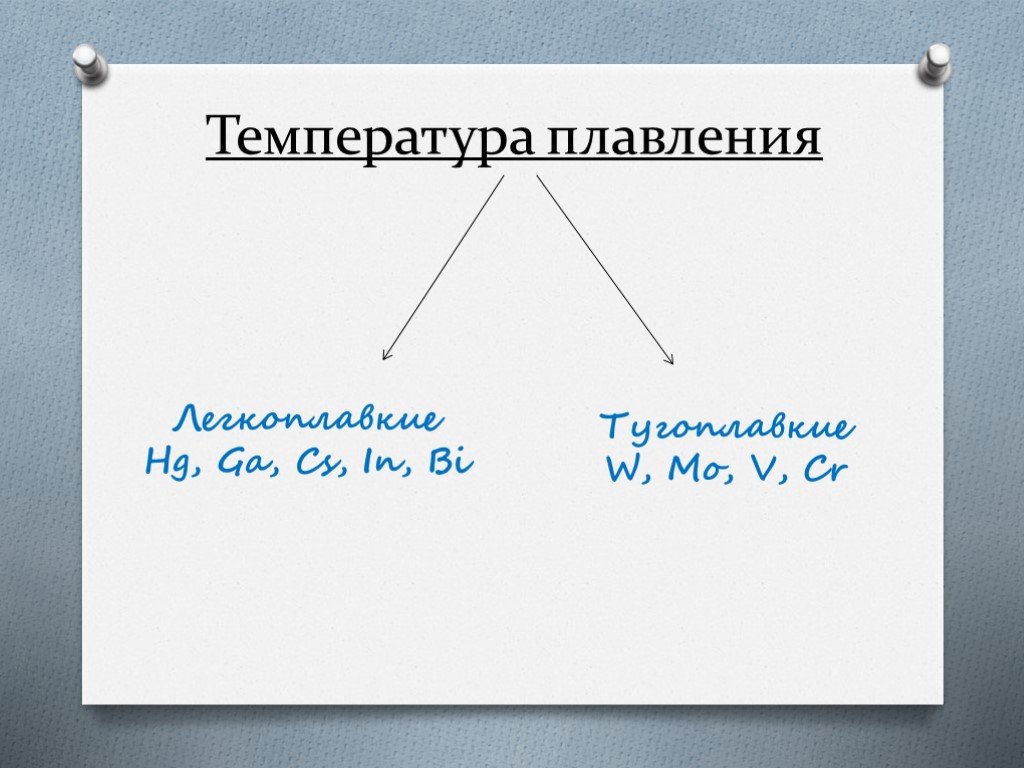
Распространенность металлов в природе. Содержание некоторых металлов в земной коре: Алюминий 8,2% Железо 5,0% Кальций 4,1% Натрий 2,3% Магний 2,3% ...Металлы и их соединения
Определите металл. 1. Этот металл легче свинца в 5 раз, а золота – в 20 раз. Стержень этого металла пишет по бумаге. 2. «Зелёное золото» содержит ...Металлы и сплавы в искусстве
План:. История развития искусства художественной обработки металлов. Металлы используемые для художественной обработки. Декоративная обработка металлов. ...Металлы в периодической системе
Количество металлов среди всех химических элементов. История открытия металлов человеком. с древних времён и до нашей эры. средние века XVIII век. ...Металлы в искусстве
Художественная обработка металлов известна со времен глубокой древности. Человек, встретив а своем пути золото, был очарован его красотой, поражен ...Металлы в жизни человека
Содержание. Цель Проблемные вопросы Гипотеза Первые металлы Металлические находки Что же такое сплавы Получение сплавов Сплавы и их свойства Использование ...Металлы IА-группы щелочные металлы
14.11.2018 Что узнаем…. Положение щелочных металлов в Периодической системе Изменение свойств в группе История названия Нахождение в природе Физические ...Металлы – простые вещества
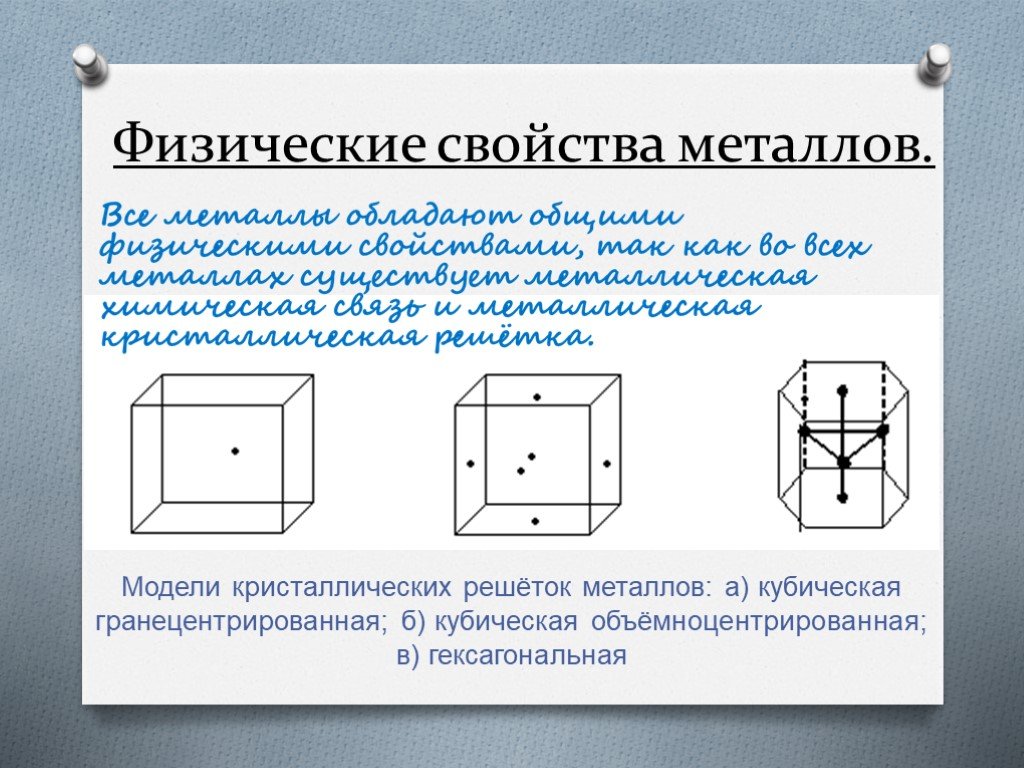
Напишите химические знаки металлов. Свойства металлов. электропроводность. теплопроводность пластичность. Металлический блеск. ковкость. Классификация ...Металлы
Методическая разработка раздела "Металлы" программы О.С.Габриеляна по химии 9 класса. Программа по химии для 9 класса разработана на основе авторской ...Металлы
положение металлов в периодической системе Д. И. менделеева. Условная граница между элементами-металлами и элементами-неметаллами проходит по диагонали: ...Металлы
«Новогоднее Приключение Маши и Вити». Эпиграф:. «Человек не может обойтись без металлов… Если бы не было металлов, люди влачили бы самую омерзительную ...Конспекты
Металлы в нашей жизни
Муниципальное бюджетное образовательное учреждение. « Владивостокская средняя общеобразовательная школа №82». Приморского края. . Открытый ...Общая характеристика металлов. Металлы главных и побочных подгрупп. Щелочные металлы и их важнейшие соединения
План учебного занятия № 10. Дата Предмет. химия. группа. Ф.И.О. преподавателя. : Кайырбекова И.А. . І. Тема занятия:. Общая характеристика металлов. ...Металлы на пути к Победе
Урок на тему «Металлы на пути к Победе». Открытый урок посвященный 70 летию Победы в ВОВ. Подготовила и провела учитель химии сш.№9 Жансеитова ...Металлы побочных подгрупп. Железо-металл 19 века
Урок составлен: учитель химии МКОУ Дракинская СОШ Лискинского района Воронежской области. Баранова Виктория Владимировна. Тема: Металлы побочных ...Металлы главных подгрупп периодической системы элементов Д.И.Менделеева
Модуль 1. Тема: «Металлы главных подгрупп периодической системы элементов Д.И.Менделеева». номер. учебного. элемента. (УЭ). Учебный материал ...Металлы и экология
МОУ Васильевская ООШ. Серпуховский район Московской области. Учитель химии. Кононова Людмила Константиновна. «Металлы и экология» (Обобщение ...Металлы в окружающей среде и здоровье человека
Тема урока:. «Металлы в окружающей среде и здоровье человека». (урок-конференция). 9 класс. Цели урока:. 1. Сформировать у учащихся представления ...Металлы в организме человека
. Муниципальное общеобразовательное учреждение. средняя общеобразовательная школа № 1 г. Советский. Металлы в организме человека. Интегрированное ...Металлы – простые вещества с использованием ИКТ на уроке
Конспект урока химии (по программе О.С. Габриеляна) в 8 классе на тему «Металлы – простые вещества с использованием ИКТ на уроке». Автор: Карачева ...Металлы – простые вещества
Урок химии в 8 классе по теме. «Металлы – простые вещества». Задачи:. . Образовательные:. Сформировать у учащихся знания о том, что металлам ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 октября 2018
Категория:Химия
Классы:
Содержит:18 слайд(ов)
Поделись с друзьями:
Скачать презентацию