Презентация "Химия элементов" – проект, доклад
Презентацию на тему "Химия элементов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
Химия и окружающая среда
Ионизирующее излучение и окружающая среда. Материнские ядра: 40К, 232Th, 238U; продукты их радиоактивного распада образуют радиоактивные ряды. Переход ...Химия Бензол
План. 1. Бензол – представитель аренов. 2. Строение аренов. Ароматическая связь. 3. Свойства бензола: а) сходство с алканами б) сходство с алкенами. ...Химия Гидролиз
Самоанализ урока химии. Тема урока: «ГИДРОЛИЗ СОЛЕЙ» Место урока в теме: Первый урок Тип урока: Изучение нового материала Вид урока: Комбинированный. ...Химия и здоровье человека
Улучшить здоровье детей - задача для школы непосильная. Целью работы школьного коллектива может быть только охрана и сохранение здоровья, мотивация ...Химия в повседневной жизни человека
Химия и повседневная жизнь человека. Химия, обладая огромными возможностями, создает не виданные материалы, умножает плодородие почвы, облегчает труд ...Химия Вода
Авторы проекта. Коллектив учителей Тулиновской средней школы Антюфеева Т. А.- учитель химии Автухова Л. В.- учитель географии Барышникова Н. С.- учитель ...Знаки химических элементов
Водород Н Гидрогениум Аш. Ртуть Hg. Гидраргерум Гидраргерум. Углерод С Карбониум Цэ. Хлор Cl Хлорум Хлор. Медь Сu Купрум Купрум. Хром Cr Хромиум Хром. ...Химия в искусстве
«Широко простирает химия руки свои в дела человеческие» М.В.Ломоносов. . . . Палитра. сажа мел охра. малахит лазурит киноварь. Пигмент - окрашенные ...Взаимодействие атомов элементов – неметаллов между собой
Что общего в составе частиц:. 1) 11H0, 21H0, 31H0 2) 168O0 , 168O2- , 178O0 3) 11H-, 21H-, 42He0. Разделите элементы на две группы: Cl, Mg, O, P, ...Знаки химических элементов
Другого ничего в природе нет Ни здесь, ни там, в космических глубинах: Все - от песчинок малых до планет - Из элементов состоит единых. Степан Щипачев ...Валентность химических элементов
Валентность некоторых химических элементов в химических соединениях. С постоянной валентностью. C переменной валентностью. Определение валентности ...В поисках элементов
Химия-это очень древняя наука. Она возникла за долго до того, как появился человек. Большой вклад в развитие науки внесли алхимики. Они первыми научились ...Биогенная классификация химических элементов
бром железо натрий. Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами. Введение в ...Химия в быту
Оглавление. Историческая справка Состав моющих средств Хлор Фосфаты Факты Источники. Историческая справка. Самое простое моющее средство было получено ...Знаки химических элементов
Другого ничего в природе нет ни здесь, ни там, в космических глубинах: все — от песчинок малых до планет — из элементов состоит единых. Как формула, ...Химия в жизни общества
Основополагающий вопрос:. Велики границы познания науки - химии в делах человеческих? Учебные предметы: химия, экология, биология. Направления работы: ...Знаки химических элементов
Другого ничего в природе нет ни здесь, ни там, в космических глубинах: все — от песчинок малых до планет — из элементов состоит единых. Как формула, ...Химия в криминалистике
Области применения химических методов при раскрытии преступлений. – поиск и сохранение скрытых отпечатков пальцев; – идентификация личности по анализу ...Интерактивная игра "Химия в ребусах: Химические элементы"
НИКЕЛЬ. ИОД. АЗОТ. БОР. МАГНИЙ Й. МАРГАНЕЦ. КРЕМНИЙ Л=й. МЫШЬЯК. УГЛЕРОД О. ЦИРКОНИЙ. АРГОН. МЕДЬ ДВЕ. КРИПТОН. ЗОЛОТО. СЕРА П=А. ВОДОРОД А=О Т=Д. ...Химия в рисунках или эта удивительная химия
Цели: Воспитывать и развивать у учащихся стремление к самоопределению и самореализации. Задачи: Выявить творческих, инициативных учащихся; Активизировать ...Конспекты
Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия
Тема:Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия. Цели ...Экологическая паутина химии элементов
Тема : «Экологическая паутина химии элементов». Учитель химии и биологии МОУ СОШ №4. г.о.Кинель Самарской области. Петиной Оксаны Викторовны. ...Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон-аллотропная модификация кислорода
Технологическая карта урока. . . Учитель Дьячук Е.Ю. учитель химии МБОУ СОШ №1 г.Оха Сахалинская область. Предмет. химия. . Класс. . ...Химия и кулинария
Методическая разработка внеклассного мероприятия. на тему: «Химия и кулинария». (Аукцион). Автор: учитель химии. . Бижоева Лариса Аскеровна. ...Химия и повседневная жизнь человека
Брусова Татьяна Викторовна. МБОУ « СудогодскаяСОШ №2» г. Судогда. Учитель химии. Урок по химии в 11 классе. . . Тема «Химия и повседневная ...Соединения химических элементов
Предмет: Химия. Класс: 8. Учитель: Григорьева Ольга Анатольевна учитель первой категории. Урок № 13 в разделе « Соединения химических элементов». ...Характеристика элемента по его положению в периодической системе химических элементов Д.И. Менделеева
1001 идея интересного занятия с детьми. . ПРИМЕНЕНИЕ ТЕХНОЛОГИЙ КРИТИЧЕСКОГО МЫШЛЕНИЯ НА УРОКАХ ХИМИИИ. Бурдакова Кристина Олеговна, МБОУ СОШ ...Введение. Атомы химических элементов
МОУ ИРМО «Никольская СОШ». 8 класс. Учитель:. . Г.М. Донская. 2014 – 2015 учебный год. . Урок – обобщение по темам. ...Знатоки химических элементов
Урок химии, 8 класс. . . Урок-игра. « Знатоки химических элементов». Николаенко Виктория Викторовна, учитель химии и биологии Мартыновской общеобразовательной ...Валентность химических элементов
Тема:. Валентность химических элементов. Цель:. Ознакомление с понятием «валентность». Определение валентности элементов по формулам их соединений. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:16 марта 2019
Категория:Химия
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию

















![Типы комплексных соединений. 1. Аквакомплексы. В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ … Кристаллогидраты: [Be(H2O)4]SO4 [Al(H2O)6]Cl3 [K(H2O)6][Cr(H2O)6](SO4)2 [Cu(H2O)4]SO4·H2O [Ni(H2O)6]SO4·H2O. : OH2 Типы комплексных соединений. 1. Аквакомплексы. В водных растворах: [Be(H2O)4]2+ [Al(H2O)6]3+ [Cr(H2O)6]3+ … Кристаллогидраты: [Be(H2O)4]SO4 [Al(H2O)6]Cl3 [K(H2O)6][Cr(H2O)6](SO4)2 [Cu(H2O)4]SO4·H2O [Ni(H2O)6]SO4·H2O. : OH2](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen2.jpg)
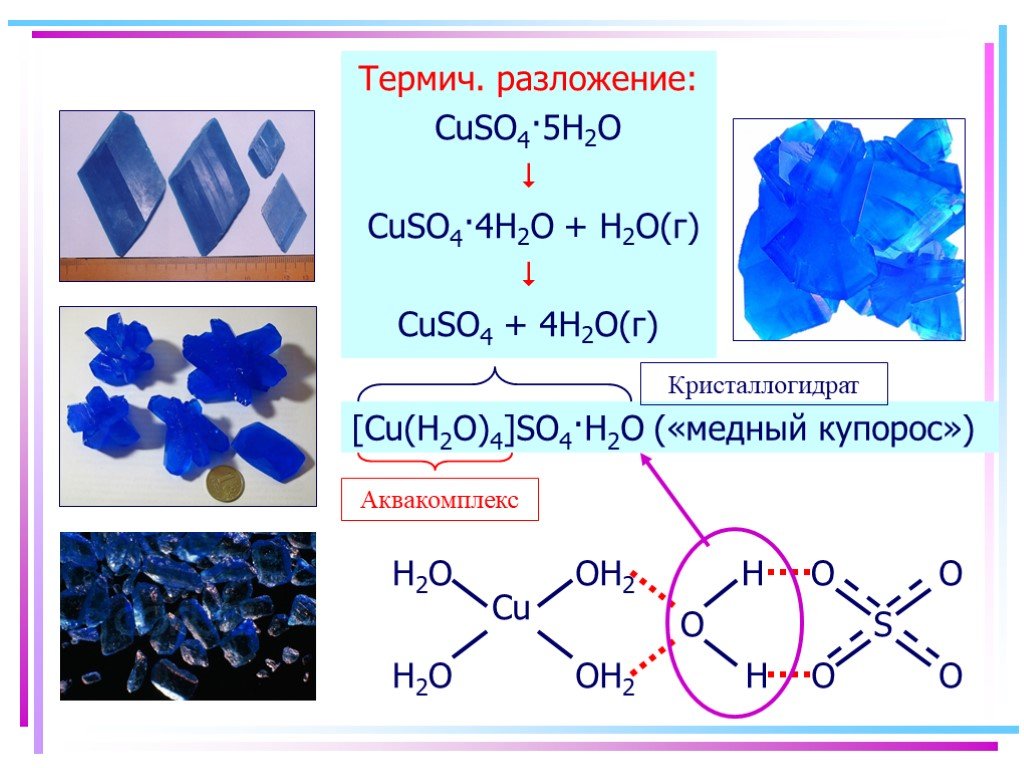
![Аквакомплексы. Термич. разложение: CuSO4·5H2O CuSO4·4H2O + H2O(г) CuSO4 + 4H2O(г). [Cu(H2O)4]SO4·H2O («медный купорос») Аквакомплексы. Термич. разложение: CuSO4·5H2O CuSO4·4H2O + H2O(г) CuSO4 + 4H2O(г). [Cu(H2O)4]SO4·H2O («медный купорос»)](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen3.jpg)
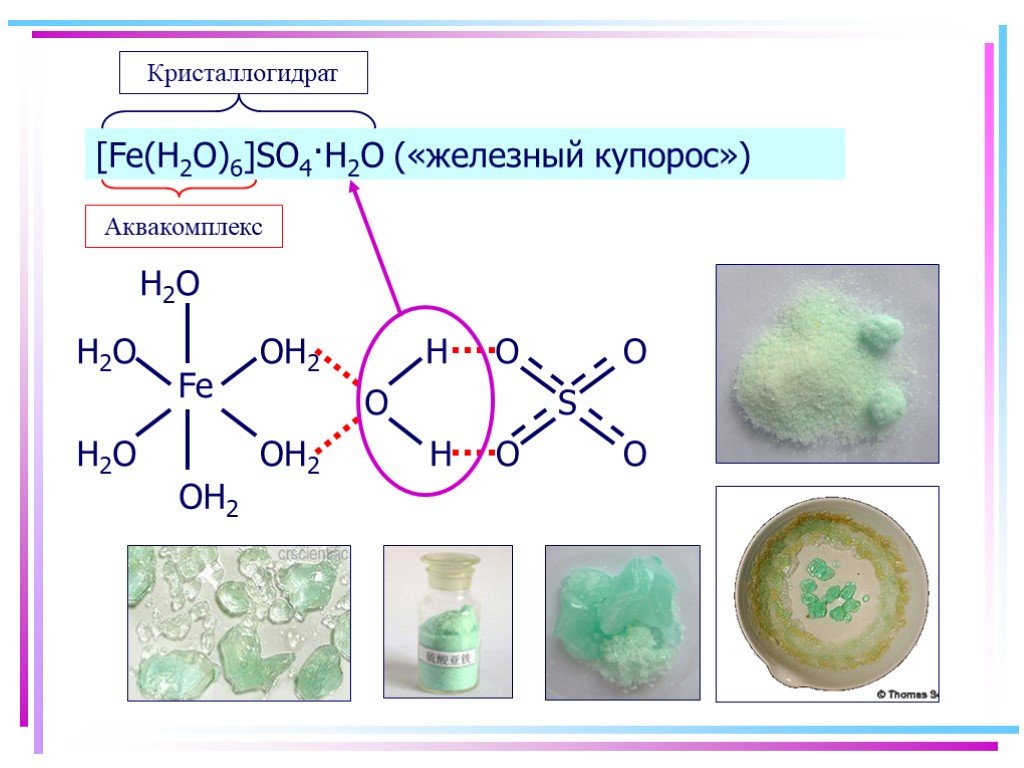
![[Fe(H2O)6]SO4·H2O («железный купорос») [Fe(H2O)6]SO4·H2O («железный купорос»)](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen4.jpg)
![2. Гидроксокомплексы. Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7 Разрушение: [Zn(OH)4]2– (+H3O+) + CH3COOH; CO2; NH4+ (сл.к-ты, pH 7) Zn(OH)2(т) + H3O+ (сильн.к-ты, pH : OH– 2. Гидроксокомплексы. Получение: Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7 Разрушение: [Zn(OH)4]2– (+H3O+) + CH3COOH; CO2; NH4+ (сл.к-ты, pH 7) Zn(OH)2(т) + H3O+ (сильн.к-ты, pH : OH–](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen5.jpg)
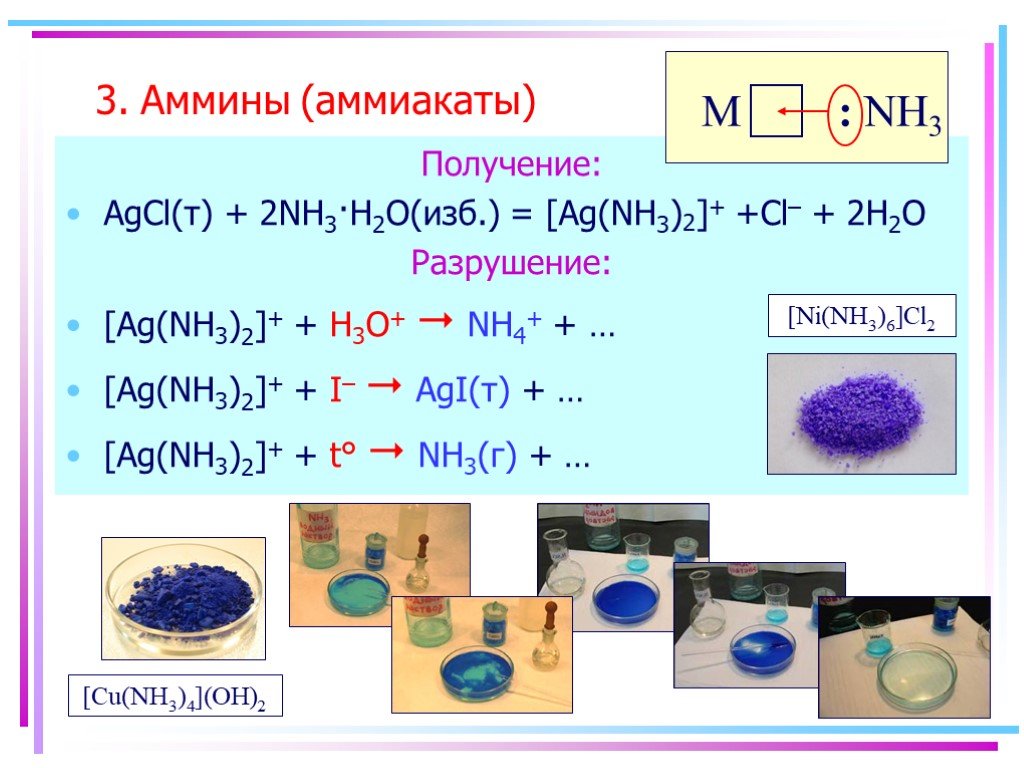
![3. Аммины (аммиакаты). Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2O Разрушение: [Ag(NH3)2]+ + H3O+ NH4+ + … [Ag(NH3)2]+ + I– AgI(т) + … [Ag(NH3)2]+ + t° NH3(г) + …. : NH3 [Cu(NH3)4](OH)2 [Ni(NH3)6]Cl2 3. Аммины (аммиакаты). Получение: AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2O Разрушение: [Ag(NH3)2]+ + H3O+ NH4+ + … [Ag(NH3)2]+ + I– AgI(т) + … [Ag(NH3)2]+ + t° NH3(г) + …. : NH3 [Cu(NH3)4](OH)2 [Ni(NH3)6]Cl2](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen6.jpg)
![Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2O Разрушение: [HgI4]2– + S2– = HgS(т) + 4I– [Fe(NCS)6]3− + 4F− = [FeF4]− + 6NCS−. 4. Ацидокомплексы : Х–. Получение и разрушение тиоцианатного к-са Fe(III). K4[Fe(CN)6] K3[Fe(CN)6] Получение: HgI2(т) + 2I–(изб.) = [HgI4]2– [Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2O Разрушение: [HgI4]2– + S2– = HgS(т) + 4I– [Fe(NCS)6]3− + 4F− = [FeF4]− + 6NCS−. 4. Ацидокомплексы : Х–. Получение и разрушение тиоцианатного к-са Fe(III). K4[Fe(CN)6] K3[Fe(CN)6]](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen7.jpg)
![Получение: 4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 °C) 4 LiH + AlCl3 = Li[AlH4] + 3LiCl 3 Li[BH4] + AlCl3 = Al[BH4]3 + 3LiCl Разрушение: Na[AlH4] + 4 H2O = NaOH + Al(OH)3 + 4 H2 (ОВР) 2 Na[BH4] + H2SO4 = Na2SO4 + B2H6 + 2 H2 (ОВР). 5. Гидридокомплексы. : H– Li[AlH4] Na[BH4] Получение: 4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 °C) 4 LiH + AlCl3 = Li[AlH4] + 3LiCl 3 Li[BH4] + AlCl3 = Al[BH4]3 + 3LiCl Разрушение: Na[AlH4] + 4 H2O = NaOH + Al(OH)3 + 4 H2 (ОВР) 2 Na[BH4] + H2SO4 = Na2SO4 + B2H6 + 2 H2 (ОВР). 5. Гидридокомплексы. : H– Li[AlH4] Na[BH4]](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen8.jpg)
![6. Анионгалогенаты M[ЭГ¢mГ²n] (Э, Г¢ и Г² – галогены). Получение: KI + I2 = K[I(I)2]; CsCl + IBr = Cs[I(Br)(Cl)] Разрушение: K[I(I)2] + t° = KI + I2(г) Cs[I(Br)(Cl)] + t° = CsCl + IBr(г). 7. Катионгалогены [ЭГ¢mГ²n]Z (Э, Г¢ и Г² – галогены). Получение: ICl3 + SbCl5 = [ICl2][SbCl6]; BrF3 + AsF5 = [Br 6. Анионгалогенаты M[ЭГ¢mГ²n] (Э, Г¢ и Г² – галогены). Получение: KI + I2 = K[I(I)2]; CsCl + IBr = Cs[I(Br)(Cl)] Разрушение: K[I(I)2] + t° = KI + I2(г) Cs[I(Br)(Cl)] + t° = CsCl + IBr(г). 7. Катионгалогены [ЭГ¢mГ²n]Z (Э, Г¢ и Г² – галогены). Получение: ICl3 + SbCl5 = [ICl2][SbCl6]; BrF3 + AsF5 = [Br](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen9.jpg)
 (ниже 50 °С) тетракарбонилникель(0) Разрушение: [Ni(CO)4](ж) + t° = Ni(т) + 4 CO(г) (выше 200 °С) [Ni(CO)4] + H2SO4(разб.) = NiSO4 + 4 CO + H2. 8. Карбонилы : CO. Состав карбонильных комплексов: [Cr(CO)6], [Mn2(CO)10], [Fe(CO)5], [Co2(CO)8] и др. Высокочист Получение: Ni(т) + 4CO(г) = [Ni(CO)4](ж) (ниже 50 °С) тетракарбонилникель(0) Разрушение: [Ni(CO)4](ж) + t° = Ni(т) + 4 CO(г) (выше 200 °С) [Ni(CO)4] + H2SO4(разб.) = NiSO4 + 4 CO + H2. 8. Карбонилы : CO. Состав карбонильных комплексов: [Cr(CO)6], [Mn2(CO)10], [Fe(CO)5], [Co2(CO)8] и др. Высокочист](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen10.jpg)
![Правило Сиджвика для определения состава комплексов. Н.-В. Сиджвик (1873 –1952). Устойчивым является комплекс, в котором реализована 18-эл-ная оболочка из s-, p- и d-электронов М и x эл. пар лигандов (L) 26Fe0 [Ar]3d64s2 || 36Kr 18 – 8 = 10e – или 36 – 26 = 10e – x = 10/2 = 5 эл.пар (5 молекул CO) [ Правило Сиджвика для определения состава комплексов. Н.-В. Сиджвик (1873 –1952). Устойчивым является комплекс, в котором реализована 18-эл-ная оболочка из s-, p- и d-электронов М и x эл. пар лигандов (L) 26Fe0 [Ar]3d64s2 || 36Kr 18 – 8 = 10e – или 36 – 26 = 10e – x = 10/2 = 5 эл.пар (5 молекул CO) [](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen11.jpg)
![Правило Сиджвика (примеры). * 27Co0 [Ar]3d74s2 || 36Kr * 18 – 9 = 9e –; * х = 9/2 = 4,5 (?) * радикал [·Co(CO)4] * тетракарбонилкобальт (неуст.) * димер [Co2(CO)8] (уст.) октакарбонилдикобальт. 23V0 [Ar]3d34s2 || 36Kr 18–5 = 13e –; х = 13/2 = 6,5 (?) радикал [·V(CO)6] (неуст.) или компл.соединение с Правило Сиджвика (примеры). * 27Co0 [Ar]3d74s2 || 36Kr * 18 – 9 = 9e –; * х = 9/2 = 4,5 (?) * радикал [·Co(CO)4] * тетракарбонилкобальт (неуст.) * димер [Co2(CO)8] (уст.) октакарбонилдикобальт. 23V0 [Ar]3d34s2 || 36Kr 18–5 = 13e –; х = 13/2 = 6,5 (?) радикал [·V(CO)6] (неуст.) или компл.соединение с](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen12.jpg)
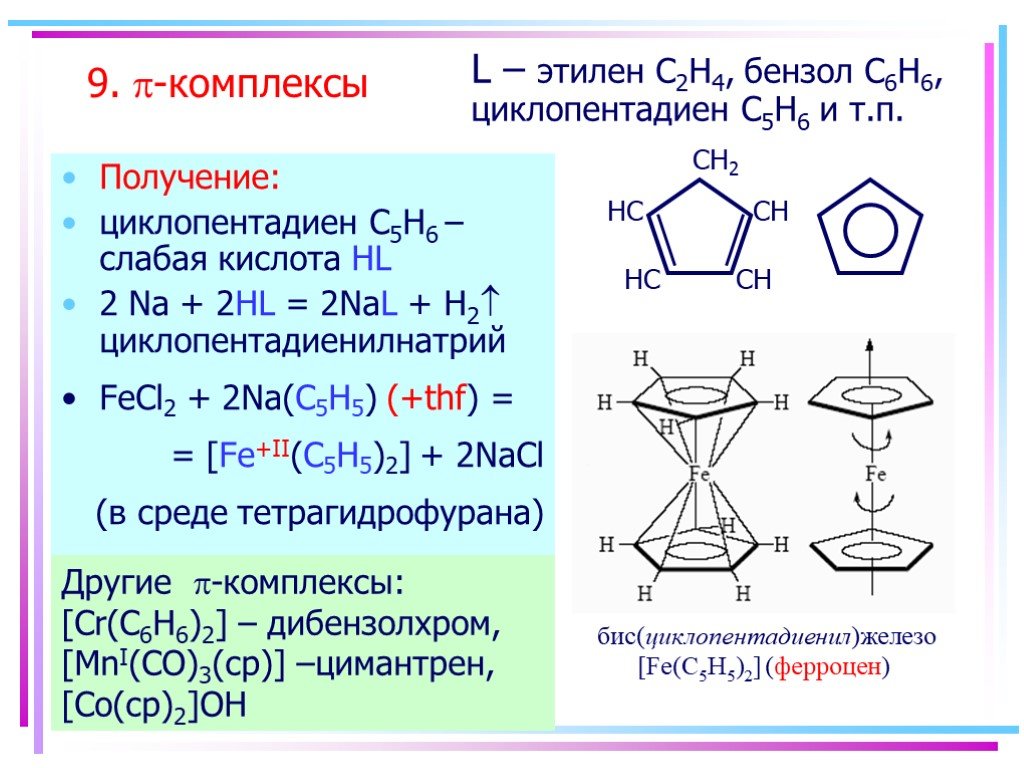
![9. p-комплексы. Получение: циклопентадиен С5H6 – слабая кислота HL 2 Na + 2HL = 2NaL + H2 циклопентадиенилнатрий FeCl2 + 2Na(C5H5) (+thf) = = [Fe+II(C5H5)2] + 2NaCl (в среде тетрагидрофурана). бис(циклопентадиенил)железо [Fe(C5H5)2] (ферроцен). Другие -комплексы: [Cr(C6H6)2] – дибензолхром, [MnI(C 9. p-комплексы. Получение: циклопентадиен С5H6 – слабая кислота HL 2 Na + 2HL = 2NaL + H2 циклопентадиенилнатрий FeCl2 + 2Na(C5H5) (+thf) = = [Fe+II(C5H5)2] + 2NaCl (в среде тетрагидрофурана). бис(циклопентадиенил)железо [Fe(C5H5)2] (ферроцен). Другие -комплексы: [Cr(C6H6)2] – дибензолхром, [MnI(C](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen13.jpg)
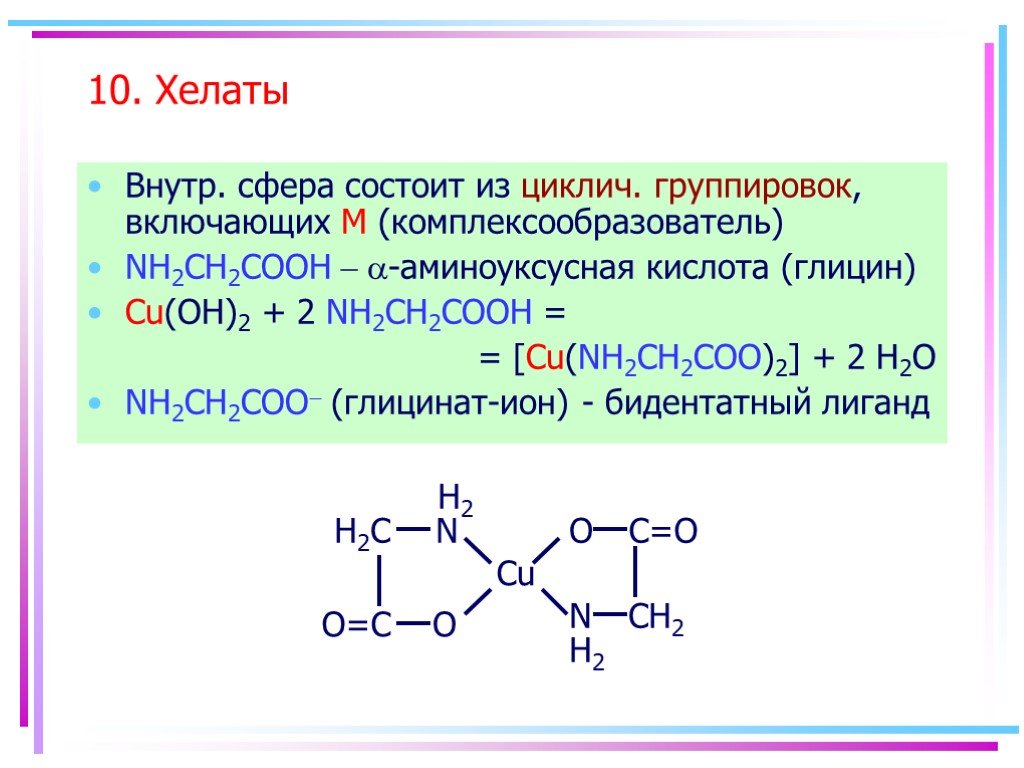
![10. Хелаты. Внутр. сфера состоит из циклич. группировок, включающих M (комплексообразователь) NH2CH2COOH - a-аминоуксусная кислота (глицин) Cu(OH)2 + 2 NH2CH2COOH = = [Cu(NH2CH2COO)2] + 2 H2O NH2CH2COO- (глицинат-ион) - бидентатный лиганд 10. Хелаты. Внутр. сфера состоит из циклич. группировок, включающих M (комплексообразователь) NH2CH2COOH - a-аминоуксусная кислота (глицин) Cu(OH)2 + 2 NH2CH2COOH = = [Cu(NH2CH2COO)2] + 2 H2O NH2CH2COO- (глицинат-ион) - бидентатный лиганд](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen14.jpg)
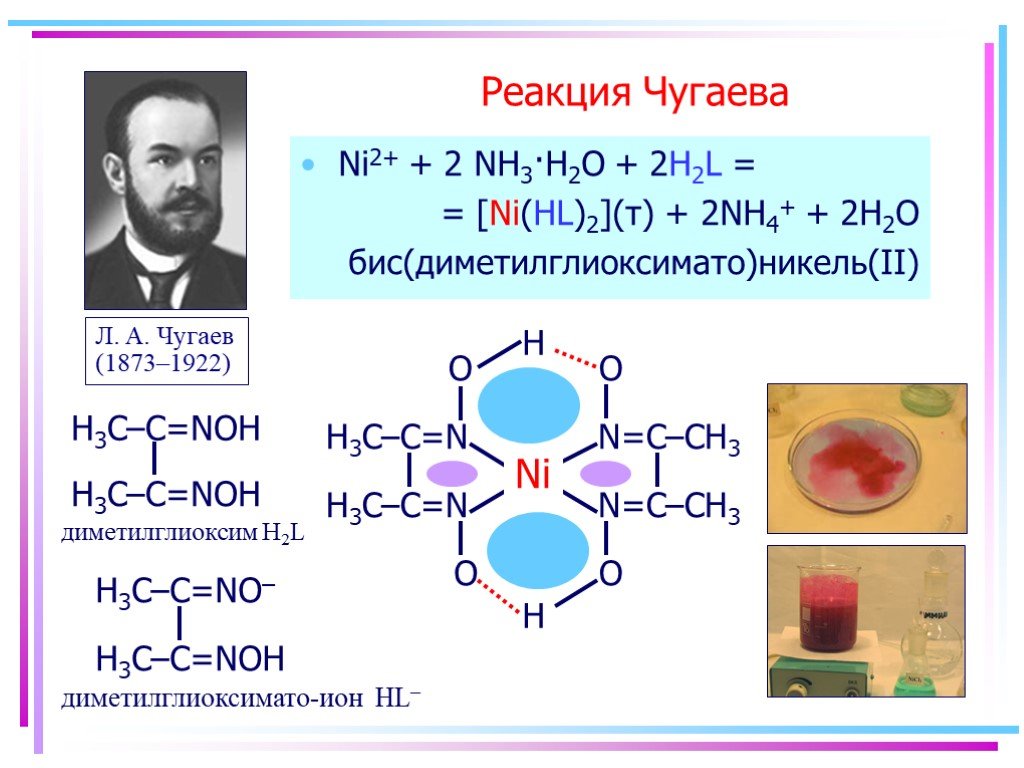
 + 2NH4+ + 2H2O бис(диметилглиоксимато)никель(II). Л. А. Чугаев (1873–1922) Реакция Чугаева. Ni2+ + 2 NH3·H2O + 2H2L = = [Ni(HL)2](т) + 2NH4+ + 2H2O бис(диметилглиоксимато)никель(II). Л. А. Чугаев (1873–1922)](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen15.jpg)
![Методы синтеза комплексных соединений. Реакция обмена лигандов А) в водном растворе (обр, принцип Ле Шателье): [Сu(H2O)4]2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 8H2O (обр. прод.) > (обр. исх.реаг.) Б) в неводном растворителе: [Al(H2O)6]3+ + NH3·H2O [Al(H2O)6]3+(s) + 6NH3(ж) = [Al(NH3)6]3+(s) + 6H2O(s Методы синтеза комплексных соединений. Реакция обмена лигандов А) в водном растворе (обр, принцип Ле Шателье): [Сu(H2O)4]2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 8H2O (обр. прод.) > (обр. исх.реаг.) Б) в неводном растворителе: [Al(H2O)6]3+ + NH3·H2O [Al(H2O)6]3+(s) + 6NH3(ж) = [Al(NH3)6]3+(s) + 6H2O(s](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen16.jpg)
![Д) ОВР + реакции обмена лигандов +Ок.+ L [СoII(H2O)6]2+ [СoIIIL6]3+ Ок.: H2O2, KNO2 … L – NH3, NO2– … Примеры: 2CoIICl2 + 12NH3 + H2O2 = 2[CoIII(NH3)6](OH)Cl2 CoIICl2 + 7KNO2 + 2CH3COOH = = K3[CoIII(NO2)6] + NO + 2KCl + 2CH3COOK + H2O + Вс [NiII(CN)4]2– [Ni0(CN)4]4– Д) ОВР + реакции обмена лигандов +Ок.+ L [СoII(H2O)6]2+ [СoIIIL6]3+ Ок.: H2O2, KNO2 … L – NH3, NO2– … Примеры: 2CoIICl2 + 12NH3 + H2O2 = 2[CoIII(NH3)6](OH)Cl2 CoIICl2 + 7KNO2 + 2CH3COOH = = K3[CoIII(NO2)6] + NO + 2KCl + 2CH3COOK + H2O + Вс [NiII(CN)4]2– [Ni0(CN)4]4–](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen17.jpg)
![Решение задач. 1. Растворение осадка при комплексообразовании. AgBr(т) Ag+ + Br – ; ПРAgBr = 7,7·10–13 Ag+ + 2 SO3S2– [Ag(SO3S)2]3– ; обр = 4·1013 AgBr(т) + 2 SO3S2– [Ag(SO3S)2]3– + Br –; Kc = ? Kc = ПРAgBr обр = 7,7·10–13 4·1013 = 30,8 >> 1 Наблюдается растворение осадка (смещение Решение задач. 1. Растворение осадка при комплексообразовании. AgBr(т) Ag+ + Br – ; ПРAgBr = 7,7·10–13 Ag+ + 2 SO3S2– [Ag(SO3S)2]3– ; обр = 4·1013 AgBr(т) + 2 SO3S2– [Ag(SO3S)2]3– + Br –; Kc = ? Kc = ПРAgBr обр = 7,7·10–13 4·1013 = 30,8 >> 1 Наблюдается растворение осадка (смещение](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen18.jpg)
![Решение задач. 2. Реакция обмена лигандов. [Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 NH3 ; Kc = ? Co3+ + 6 NH3 [Co(NH3)6]3+ ; обр(1) = 1,6·1035 Co3+ + 6 CN– [Co(CN)6]3– ; обр(2) = 1,0·1064. Kc = обр(2) / обр(1) = (1,0·1064)/(1,6·1035) = 6,2·1029 >> 1 Наблюдается смещение равновесия вправо Решение задач. 2. Реакция обмена лигандов. [Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 NH3 ; Kc = ? Co3+ + 6 NH3 [Co(NH3)6]3+ ; обр(1) = 1,6·1035 Co3+ + 6 CN– [Co(CN)6]3– ; обр(2) = 1,0·1064. Kc = обр(2) / обр(1) = (1,0·1064)/(1,6·1035) = 6,2·1029 >> 1 Наблюдается смещение равновесия вправо](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen19.jpg)
![Решение задач. 3. Разрушение комплекса. [Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4 NH4+ ; Kc = ? Cu2+ + 4 NH3 [Cu(NH3)4]2+ ; обр = 7,9·1012 NH4+ + 2H2O NH3·H2O + H3O+ ; Kк = 5,75·10–10. Kc = 1 / (7,9·1012·5,754·10–40 ) = 1,16·1020 >> 1 Наблюдается разрушение аммиачного комплекса в кислотной Решение задач. 3. Разрушение комплекса. [Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4 NH4+ ; Kc = ? Cu2+ + 4 NH3 [Cu(NH3)4]2+ ; обр = 7,9·1012 NH4+ + 2H2O NH3·H2O + H3O+ ; Kк = 5,75·10–10. Kc = 1 / (7,9·1012·5,754·10–40 ) = 1,16·1020 >> 1 Наблюдается разрушение аммиачного комплекса в кислотной](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen20.jpg)
![Решение задач. 4. Направление реакции. CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ Kc = ? Cu+ + 2CN– [Cu(CN)2]– ; обр = 1,0·1024 HCN + H2O CN– + H3O+ ; Kк = = 4,93·10–10 CuCN(т) Cu+ + CN– ; ПРCuCN = 3,2·10–20. Kc = 1,0·1024 · 4,93·10–10 · 3,2·10–20 = 1,6·10–6 = обр·Kк·ПРCuCN Решение задач. 4. Направление реакции. CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+ Kc = ? Cu+ + 2CN– [Cu(CN)2]– ; обр = 1,0·1024 HCN + H2O CN– + H3O+ ; Kк = = 4,93·10–10 CuCN(т) Cu+ + CN– ; ПРCuCN = 3,2·10–20. Kc = 1,0·1024 · 4,93·10–10 · 3,2·10–20 = 1,6·10–6 = обр·Kк·ПРCuCN](https://prezentacii.org/upload/cloud/19/03/134750/images/thumbs/screen21.jpg)






























