Презентация "Растворение. Растворимость. Типы растворов" по химии – проект, доклад
Презентацию на тему "Растворение. Растворимость. Типы растворов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 17 слайд(ов).
Слайды презентации
Список похожих презентаций
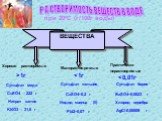
Растворение. Растворимость веществ
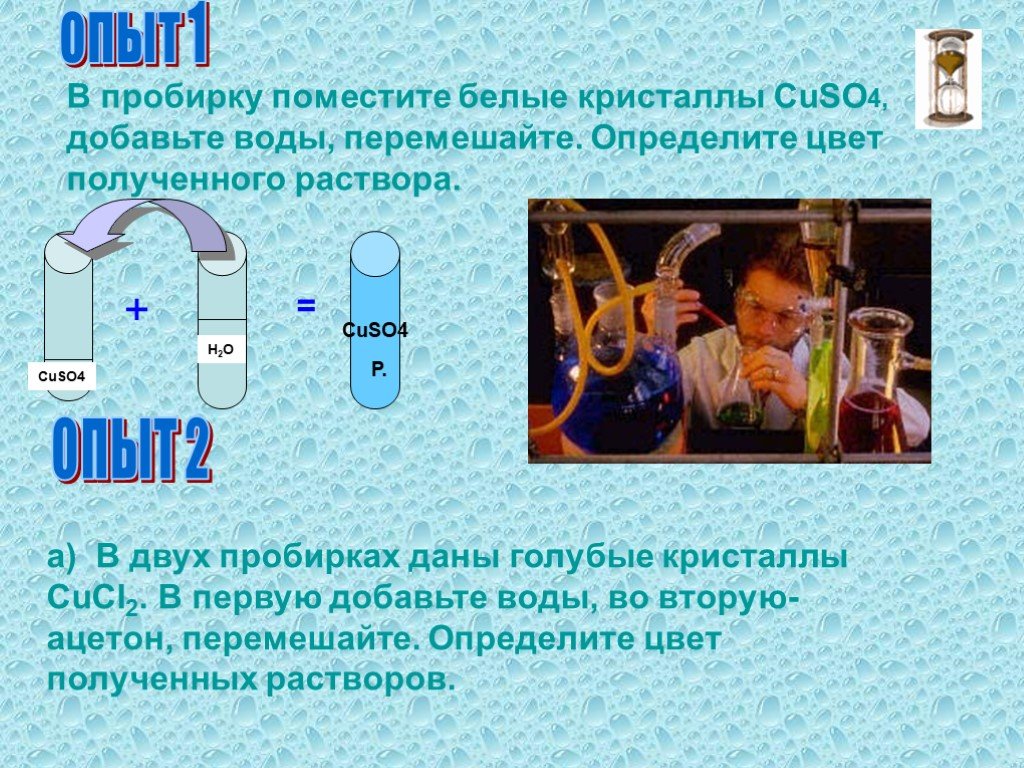
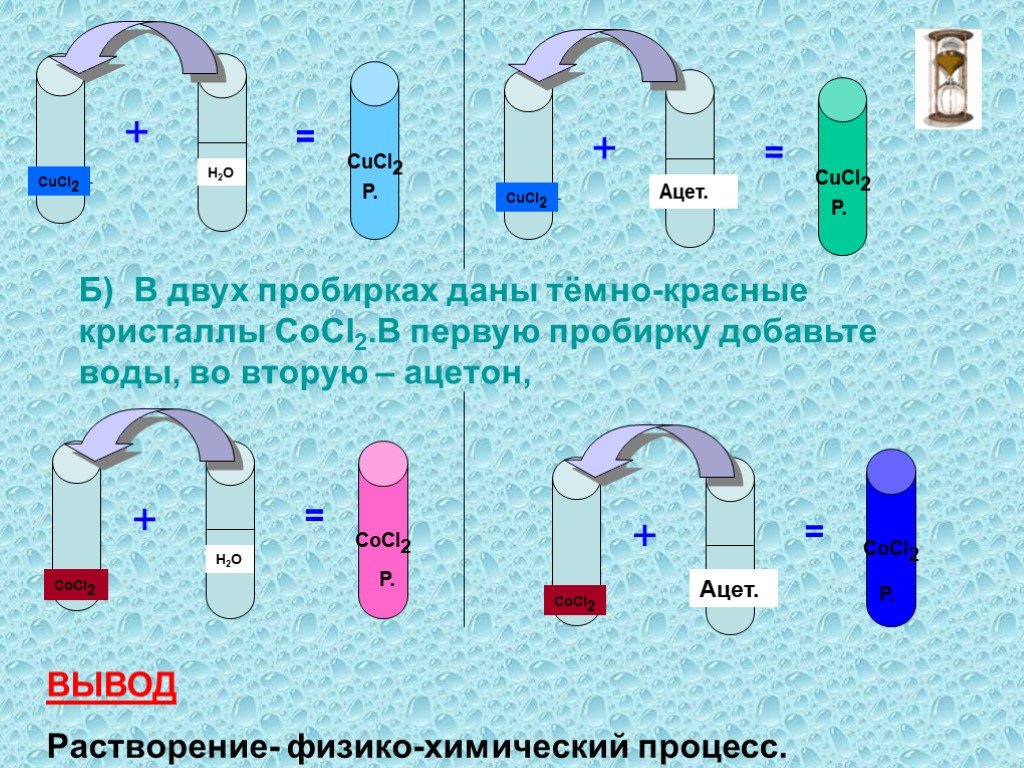
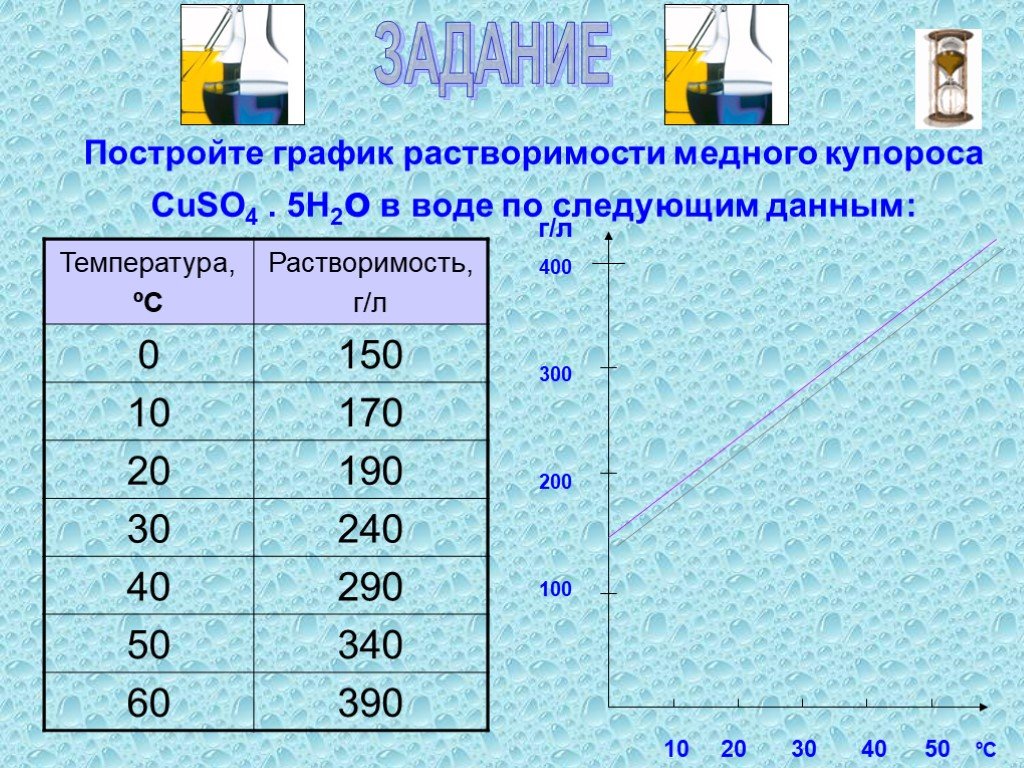
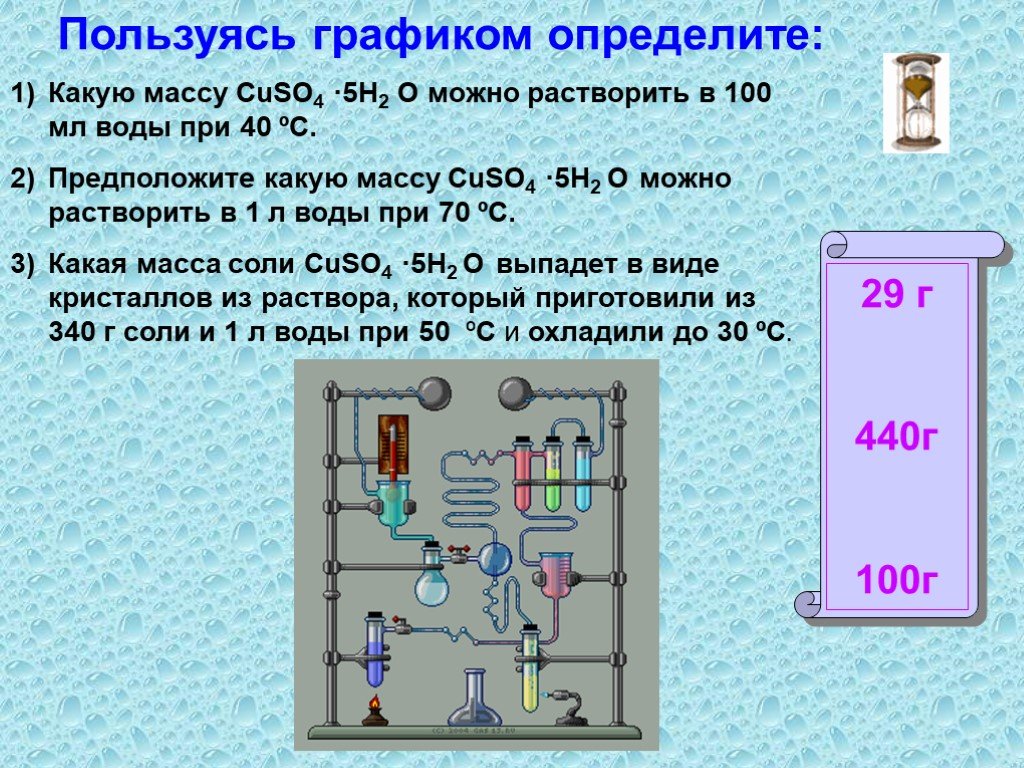
Растворение. Физический процесс – результат диффузии веществ. Химический процесс –взаимодействие вещества с водой и образование гидратов. Состав раствора. ..."Растворение. Растворимость веществ в воде."
. Цель урока: познакомить учащихся с растворением веществ, как физико – химическим процессом и с растворами как физико – химическими системами. Задачи: ...Типы химических реакций
Цели урока. Обобщить представление о химической реакции как о процессе превращения одного или нескольких исходных веществ-реактивов в отличающиеся ...Типы химических реакций
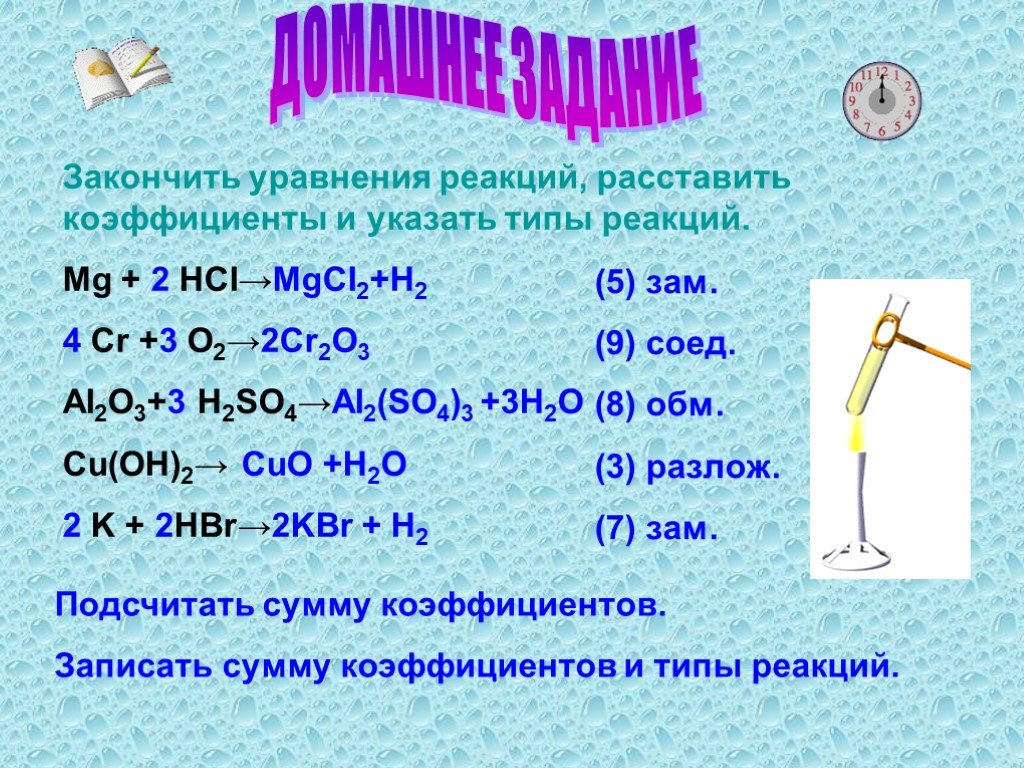
Типы химических реакций. Присое-динения Замеще-ния Разложе-ния Обмена (гидролиз). Классификация химических реакций. По направлению. Обратимые Необратимые. ...Типы химических реакций
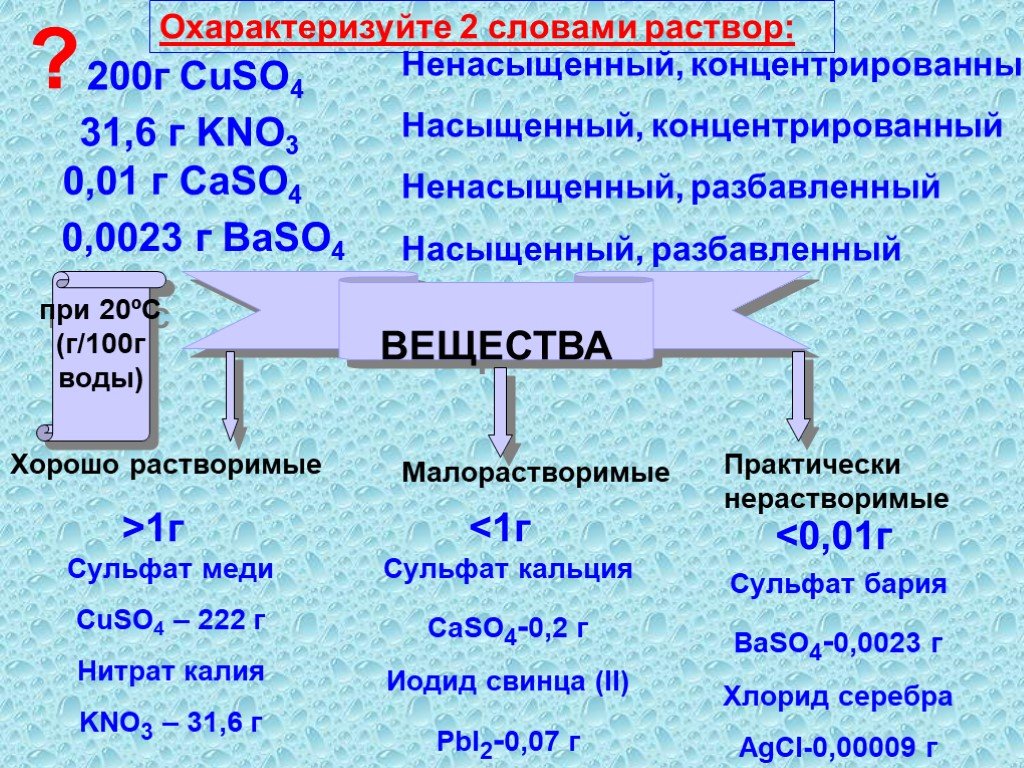
Цель урока: повторить классификацию веществ, типы химических реакций и признак их классификации, научить учащихся применять полученные знания о типах ..."Растворимость веществ в воде. Растворы
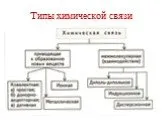
Как образуется раствор? Что такое раствор? Растворы – это однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между ...Типы химической связи
Ковалентная связь. 1916 г. – теория Льюиса Химическая связь – результат образования общей электронной пары между двумя атомами. Правило октета. Валентный ...Типы химических реакций в органической и неорганической химии
Классификация химических реакций. По числу и составу реагирующих и образующихся веществ (в неорганической химии). По числу и составу реагирующих и ...Типы химических реакций
Химическая реакция — превращение одного или нескольких исходных веществ в отличающиеся от них по химическому составу или строению вещества (продукты ...Типы изомерии
Типы изомерии. 1.Историческая справка 2.Изомерия. Изомеры. 3.Типы изомерии. Классификация изомеров. Историческая справка. Термин изомерия предложен ...Сходства и различия в теориях разбавленных растворов Аррениуса и Менделеева
В наше время теория растворов получила широкое развитие, но всего лишь 100 лет назад о ней было мало что известно. Существует много примеров из истории ...Свойства растворов электролитов
Начинаем наш урок, Пригласили к нам в домок, Мы не только всех друзей, И директоров, гостей. Всем хотим мы показать, Как нужно химию нам знать Без ...Аморфные и кристаллические вещества. Типы кристаллических решеток
Цель:. организовать деятельность учащихся для изучения аморфных и кристаллических веществ; создать условия для формирования общеучебных умений и навыков: ..."Типы химических реакций
ЦЕЛЬ УРОКА:. ПОВТОРИТЬ И ОБОБЩИТЬ ЗНАНИЯ УЧАЩИХСЯ О ХИМИЧЕСКИХ ПРЕВРАЩЕНИЯХ, ПРИЗНАКАХ И ТИПАХ ХИМИЧЕСКИХ РЕАКЦИЙ. ЗАКРЕПИТЬ НАВЫКИ СОСТАВЛЕНИЯ ХИМИЧЕСКИХ ...Типы химических реакций
Смирнова Светлана Витальевна. Учитель химии, педагог-психолог МОУ СОШ №2 г.Андреаполя Тверской области Высшая квалификационная категория Педагогический ...Типы химических реакций
Эти явления знаете вы В природе и в нашем быту встречаются они, А отличают эти явления – взаимные превращения, Образуются всегда – новые вещества. ...Типы кристаллических решеток
Цели урока. Сформировать понятия о кристаллическом и аморфном состоянии твердых тел Дать представления о типах кристаллических решеток Установить ...Типы химических реакций
Содержание. Актуализация опорных знаний Изучение нового материала Первичное закрепление знаний и умений Подведение итогов урока. Рефлексия Домашнее ...Типы кристаллических структур
Вещество с молекулярной кристаллической структурой. 1. Mg 2. Cl2 3. NaNO3 4. CaO. Вещество с металлической кристаллической структурой. Вещество с ...Типы химических реакций на примере свойств воды
Вода Сложное вещество, состоящее из двух химических элементов. Является оксидом. Молекулярная формула воды Формула воды - Н2О В молекуле воды: 2 атома ...Конспекты
Растворение. Растворимость веществ в воде
«Методическая разработка ». Изучение темы. . «. . Растворение. Растворимость веществ в воде». ( 8 класс). Автор: Ковалева Евгения Юрьевна,. ...Типы химических реакций. Реакции обмена
Разработка урока по теме: "Типы химических реакций. Реакции обмена.". Цели урока:. Образовательная. -. актуализация знаний обучающихся о ...Типы химических реакций. Реакции обмена
Типы химических реакций. Реакции обмена. . . Цели урока:. Образовательная. -. актуализация знаний обучающихся о типах химических реакций, классификации ...Типы химических реакций: соединения, разложения
. Муниципальное бюджетное общеобразовательное учреждение. «Харьковская средняя общеобразовательная школа. . Ровеньского района Белгородской ...Типы химических реакций: соединения, разложения
. Технологическая карта урока. по теме «Типы химических реакций: соединения, разложения». Разработала:. Желовникова ...Типы химических реакций на примере свойств воды
Методическая информация. . . Дата. . 5.02.2013г. . . Учитель. . Мешева Айгуль Аскаровна. . . . Школа. . Белоглинская основна ...Классы неорганических веществ. Типы химических реакций
-1-. Методическая разработка урока. . Обобщение и систематизация знаний по теме: «Классы неорганических веществ. Типы химических реакций». . ...Типы химической связи
Составила учитель химии и биологии Хамзина Гульжан Минуллаевна. Р.Казахстан. Маржанбулакская средняя школа. Актюбинской области. . . Самостоятельная ...Типы химических реакций
Тема Урока : «Типы химических реакций» урок повторения в 8 классе. . А. . . П. . Т. ен,. ГУ. « Средняя школы имени М Габдуллина с дошкольным ...Типы химических реакций
ГОУ НПО РПЛ. Урок по теме:. «Типы химических реакций». Преподаватель химии. Лебедева ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:7 января 2019
Категория:Химия
Содержит:17 слайд(ов)
Поделись с друзьями:
Скачать презентацию