Конспект урока «Классы неорганических веществ. Типы химических реакций» по химии для 8 класса
-1-
Методическая разработка урока
Обобщение и систематизация знаний по теме: «Классы неорганических веществ. Типы химических реакций». Учитель: ИвановаС.Ю.
Тип урока: урок-практикум, обобщающий.
Формы проведения урока: фронтальная беседа, химический эксперимент, работа парами, работа по карточкам и тестам.
Цели :
Формирование понятия о важнейших классах неорганических веществ как групп веществ, объединенных общими признаками состава.
Развитие умения записывать суть происходящих химических превращений с помощью формул исходных и образующихся веществ, отработка навыка расстановки коэффициентов на основании понимания закона сохранения массы веществ М.В.Ломоносова.
Развитие умения классифицировать химические реакции на основании признаков состава реагирующих и образующихся веществ.
Отработка умения правильно называть вещества.
Развитие умения сравнивать и обобщать, работать внимательно, соблюдая правила техники безопасности при постановке химического эксперимента. Формирование культуры общения, умение работать сотрудничая, стимуляция мышления, познавательного интереса, повышение самооценки учащихся.
Сделать шаг к созданию целостных представлений о мире на основе закона сокращения массы веществ и энергии как всеобщего закона природы.
Учебно-наглядные пособия:
-
таблица Менделеева
-
таблица растворимости
-
электрохимический ряд напряжений металлов
-
учебники по химии для 8 класса О.С.Габриеляна
-
карточки с формулами и названиями оксидов,оснований,солей
Оборудование:
На столах учащихся:
- ученический штатив
- поддон
- держатель для пробирок
- пробирки
- спиртовка
- спички
- порошок железа
- порошок серы
- стальные скрепки или гвозди
- раствор сульфата меди ( ││)
- раствор гидроксида натрия
- 2 -
На столе учителя:
- демонстрационный столик
- штатив для демонстрационных пробирок
- асбестовая сетка
- спиртовка
- спички
- стеклянная колба с пробкой, наполненная кислородом
- раствор гидроксида натрия
- раствор хлорида железа (│││)
- стружка магния
- соляная кислота
- индикатор фенолфталеин
- цинк
Оформление доски на начало урока:
Тема урока: Классы неорганических веществ. Типы химических реакций.
Цель:
Закрепить знания о классификации веществ и типах химических реакций.
Ход урока: I. I.Организационный момент (приветствие, ознакомление с темой, целью и планом урока).
II.Проверка домашнего задания и актуализация опорных знаний
Написать формулы оксида кальция, гидроксида кальция, хлорида кальция, сульфата кальция, фосфата кальция; указать принадлежность к классу.
Ответ:
Оксид кальция- CaO оксид
Гидроксид кальция- Ca(OH)2 основание
Хлорид кальция- CaCl2 соль
Сульфат кальция- CaSO4 соль
Фосфат кальция- Ca3(PO4)2 соль
$27 стр. 99 прочитать. Перечислить типы химических реакций, дать им определения.
Правильный ответ:
Реакции разложения: из сложного вещества образуются два и более сложных веществ.
В реакции соединения : из двух и более веществ образуется одно сложное вещество.
Реакции замещения: атомы простого вещества замещают атомы одного из элементов в сложном веществе.
- 3 -
Реакции обмена : два сложных вещества обмениваются своими составными частями.
III. А. Обобщение и систематизация знаний по теме «Классы неорганических веществ»
Вопросы классу: --все вещества по количеству элементов делятся на простые и …...(сложные)
-простые вещества состоят из атомов …? (одного вида)
-сложные из атомов….? (разных видов)
-есть простые вещества металлы и …..? (неметаллы)
-в свою очередь среди сложных веществ различают классы: о…(оксидов),о…(оснований), …..(кислот), ….(солей)
Чертим таблицу:
Неорганические вещества
Простые вещества Сложные вещества
Металлы Неметаллы оксиды основания кислоты соли
Предлагаются вопросы:
- Как отличить металлы от неметаллов? (Металлы тверды ,кроме Hg,ковкие, имеют металлический блеск, цвет серый или рыжий, хорошо проводят тепло и электрический ток).
- Что характерно для строения атомов элементов образующих простые вещества-металлы? (1,2,3 внешних электрона)
- Что характерно для строения атомов элементов, образующих простые вещества-неметаллы?......(4,5,6,7,8 внешних электрона, за исключением бора, имеющего 3 внешних электрона).
- Как мы узнаем оксиды? ( стр.64)……(В них два элемента, один из них- кислород со степенью окисления -2).
-Основания? (Стр.68) …..(частицы металла соединены с гидроксогруппами).
-Кислоты? (стр. 71)…….(частицы водорода соединены с кислотным остатком).
Вносим в таблицу признаки металлов и неметаллов и общие формулы оксидов (ЭхОу) , оснований ( Ме(ОН)х ) , кислот ( НхК ) и солей ( МехКу ).
Работа по карточкам. Учитель показывает формулу вещества, учащиеся называют его. В это время учитель показывает правильный ответ. Затем наоборот: перед учениками название вещества, они называют формулу. (см. приложение).
Для проверки понимания
Поочередно вызываются к доске учащиеся для внесения формул веществ в таблицу ( см. приложение).
- 4 -
III. Б. Обобщение и систематизация знаний по теме «Типы химических реакций».
Беседа с учащимися:
- Что вы понимаете под химической реакцией?......( Это превращение одних веществ в другие; это явления, сопровождающиеся изменением цвета, появлением осадка, газа, запаха и др. )
- Как называется запись химической реакции? …….( Химическое уравнение).
- О каком равенстве идет речь? ( о равенстве числа атомов каждого вида до и после реакции.
- На основании какого закона мы расставляем коэффициенты?....( На основании закона сохранения массы веществ ).
- Имя какого ученого носит этот закон? Памятник ему установлен рядом с Академией Наук. Учащимся предлагается прочитать четверостишье:
Он физик, химик, он поэт, философ,
Историк он, геолог и оратор,
Науки русской он организатор…
У Академии- Михайло …..( Ломоносов ).
Учитель: Сегодня мы совершаем небольшое путешествие в мир химических превращений, посмотрим химический эксперимент и сами будем делать опыты. Но сначала проверим, как вы знаете правила техниеи безопасности. Закончите фразы:
- все опыты делаем над….( поддоном)
- наклоняться над пробиркой…..( нельзя)
- перед зажиганием спиртовки ее надо сначала ее….( подготовить)
- в спиртовке проверяем положение….( диска и фитиля).
- при нагревании держим пробирку…( наклонно, отверстие направляем в сторону от людей).
- гасим спиртовку…( накрывая пламя колпачком).
-при попадании веществ на кожу……( смываем большим количеством воды).
Демонстрируются опыты.
Учащиеся отмечают признаки реакции, ее тип и записывают уравнения в соответствующую графу таблицы, выданной учащимся ( см. приложение).
-
Горение магния.
Mg + O2 => MgO Яркий свет , появление вещества белого цвета.
Реакция соединения
2. Разложение бихромата аммония ( опыт «вулкан» )
(NH4)2 Cr2O7 = N2![]() + Cr2O3 + H2O Оранжевые кристаллы превратились в вещество зеленого цвета, образуются бесцветные газы, свет .Это разложение.. 3.Взаимодействие цинка с соляной кислотой.
+ Cr2O3 + H2O Оранжевые кристаллы превратились в вещество зеленого цвета, образуются бесцветные газы, свет .Это разложение.. 3.Взаимодействие цинка с соляной кислотой.
Zn + HCl => ZnCl2 + H2 ![]() Реакция замещения. Выделение тепла и газ
Реакция замещения. Выделение тепла и газ
4.Взаимодействие гидроксида натрия с соляной кислотой.
NaOH + HCl => NaCl + H2O
- 5 -
Реакция обмена. (нейтрализация). Наблюдаем обесцвечивание индикатора. 5.Горение серы.
S + O2 => SO2 Видно голубое свечение. Это реакция соединения.
6.Взаимодействие гидроксида натрия и хлорида железа (III ).
NaOH + FeCl3 => Fe(OH)3![]() + NaCl Появляется бурый осадок.
+ NaCl Появляется бурый осадок.
Реакция обмена.
Ученический эксперимент
-
Взаимодействие железа с раствором сульфата меди (II )
Fe + CuSO4 => FeSO4 + Cu Рыжий налет на скрепке или гвозде.
Реакция замещения.
2. Взаимодействие железа с серой.
Fe + S => FeS Появление черного вещества. Реакция соединения.
-
Взаимодействие сульфата меди (II) с гидроксидом натрия.
CuSO4 + NaOH => Cu(OH)2![]() + Na2SO4 Появление синего осадка
+ Na2SO4 Появление синего осадка
Реакция обмена.
-
Разложение гидроксида меди (II)
Cu(OH)2 => CuO = H2O Синий осадок превратился в черный. Разложение.
Постановка и обсуждение результатов эксперимента — в парах.
IV. Работа по тестам. Установить соответствие.
Тест №1
1) Соединение 1) Fe + CuCl2 = FeCl2 + Cu
2)Разложение 2) Al + 3 O2 = 2 Al2O3
3)Замещение 3) 2 KClO3 = 2 KCl + 3O2
4)Обмен 4) Al2O3 + 3 H2SO4 = Al2(SO4)2 + 3 H2O
Тест №2
-
Соединение 1) Mg + H2O = MgO + H2
-
Разложение 2) 3 KOH + H3PO4 = K3PO4 + 3 H2O
-
Замещение 3) Ni(OH)2 = NiO + H2O
4) Обмен 4) Zn + S = ZnS
Тест №3
-
Соединение 1) Fe2O3 + 6HCl
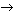 2FeCl3 + 3H2O
2FeCl3 + 3H2O -
Разложение 2) H2 + Cl2
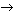 2HCl
2HCl -
Замещение 3) 2NH3
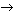 N2 + 3H2
N2 + 3H2 -
Обмен 4) Fe2O3 + 2Al
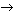 Al2O3 + 2Fe
Al2O3 + 2Fe
- 6 -
V. Подведение итогов.
Итак, окружающий нас мир (и мы с вами) состоит из веществ. Среди неорганических веществ различают металлы и неметаллы (простые вещества) и их соединения: оксиды, гидроксиды ( кислоты и основания), соли. Превращения веществ в другие вещества называются химическими реакциями и подчиняются всеобщему закону природы- закону сохранения массы и энергии. Если учитывать количество веществ и их состав, то химические реакции можно разделить на реакции соединения, разложения, замещения, обмена.
По результатам работы ( активность во время фронтальной беседы, грамотное выполнение эксперимента, результаты тестирования) учащиеся получают оценки за урок.
VI. Домашнее задание
В таблицах: схемы реакций превратить в химические уравнения, т. е. расставить коэффициенты; проверить правильность заполнения.
- 7 -
Приложение.
Карточки с формулой и названием вещества
На лицевой стороне На обратной стороне
CaO Оксид кальция
MgO Оксид магния
Al2O3 Оксид алюминия
ZnO Оксид цинка
FeO Оксид железа (II )
Fe2O3 Оксид железа (III ).
CO2 Оксид углерода( IV)
SO2 Оксид серы (IV)
SO3 Оксид серы(VI)
P2O5 Оксид фосфора (V )
SiO2 Оксид кремния
NO2 Оксид азота (IV)
NaOH Гидроксид натрия
KOH Гидроксид калия
Ca(OH)2 Гидроксид кальция
Mg(OH)2 Гидроксид магния
Cu(OH)2 Гидроксид меди ( II )
Fe(OH)2 Гидроксид железа ( II )
Fe(OH)3 Гидроксид железа ( III )
HCl Соляная кислота
HNO3 Азотная кислота
H2SO3 Сернистая кислота
H2CO3 Угольная кислота
H2SO4 Серная кислота
H2SiO3 Кремниевая кислота
H3PO4 Ортофосфорная кислота
FeCl2 Хлорид железа (II )
Mg(NO3)2 Нитрат магния
FeCl3 Хлорид железа (III )
K2SO3 Сульфит калия
Na2CO3 Карбонат натрия
CaSO4 Сульфат кальция
MgSiO3 Силикат магния
AlPO4 Фосфат алюминия
- 8 -
Приложение : Раздаточный материал. Демонстрационные опыты.
-
Mg + O2 => MgO
-
( NH4)2Cr2O7 =>N2 + H2O + Cr2O3
-
Zn + HCl => ZnCl2 + H2
-
NaOH + HCl => NaCl + H2O
-
S + O2 => SO2
-
NaOH + FeCl3 => Fe(OH)3
 + NaCl
+ NaCl
Ученический эксперимент:
-
Fe + CuSO4 => FeSO4 + Cu
-
Fe + S => FeS
-
CuSO4 + NaOH =>Cu(OH)2
 + Na2SO4
+ Na2SO4 -
Cu(OH)2 => CuO + H2O
Литература :
Габриелян О.С. Химия, 8 класс. Учебник для общеобразовательных учреждений. М.,Дрофа,2002
Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия,8 класс. Учебник для общеобразовательных учреждений.
Кузнецова Н.Е., Левкин А.Н. Задачник по химии. 8 класс. М.,Вента-Граф.,2007.
Титова И.М. Уроки химии, 8 класс. Система личностного развития учащихся. Материалы для специалистов образовательных учреждений. Санкт-Петербург, Каро, 2002.
Ефимовский Е.С. Петербург в загадках. Санкт-Петербург. ЗАО «Норинт», 2004.
- 9 -
Приложение. Раздаточный материал
Тип реакции: Уравнение реакции в общем виде:
-----------------------------------------------------------------------------------------------------
Реакция Несколько простых Сложное вещество
соединения А + В = АВ
или сложных веществ Другое сложное
АВ + СВ = АВ2С
------------------------------------------------------------------------------------------------------
Реакция Сложное вещество Несколько других веществ разложения АВ = А + В
или сложных
АВ2С = АВ + ВС
----------------------------------------------------------------------------------------------------
Реакция Сложное вещество Другое сложное замещения и простое и другое простое
АВ + С = СВ + А
------------------------------------------------------------------------------------------------------
Реакция обмена Два сложных вещества Два других сл.вещества
АВ + СД = АД + СД
------------------------------------------------------------------------------------------------------
Здесь представлен конспект к уроку на тему «Классы неорганических веществ. Типы химических реакций», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (8 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

