Презентация "Вещества" по химии – проект, доклад
Презентацию на тему "Вещества" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 23 слайд(ов).
Слайды презентации
Список похожих презентаций
Язык химии. Вещества
систематизировать и обобщить знания по первоначальным понятиям вещества способствовать развитию творчества и повышению активности обучаемых детей ...Предмет химии. Вещества
Цель урока:. Познакомить с: -предметом химия; -простыми и сложными веществами; -свойствами веществ; -формами существования химического элемента. Науки ...Предмет химии. Вещества и их свойства
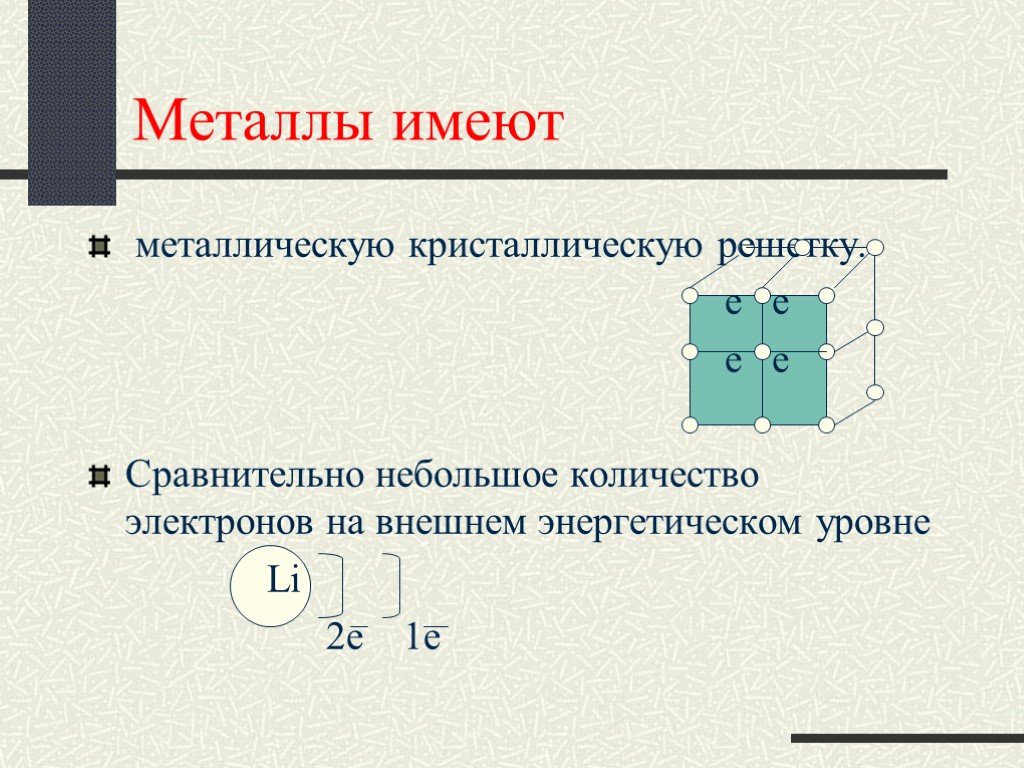
Химия в древности. Химия, как одна из наук, изучающих явления природы, зародилась в Древнем Египте еще до нашей эры, одной из самых технически развитых ...Ионная связь. Вещества ионного немолекулярного строения
Цель урока:. Изучить новый вид химической связи - ионную связь. Дать представление об условиях и механизме ее образования. Сформировать понятия о ...Предмет химии Вещества
Задание: Заполните таблицы. В первой таблице подберите к одному понятию вещество пять понятий физических тел. Во второй таблице наоборот. Задание: ...Вещества молекулярного строения. Закон постоянства состава
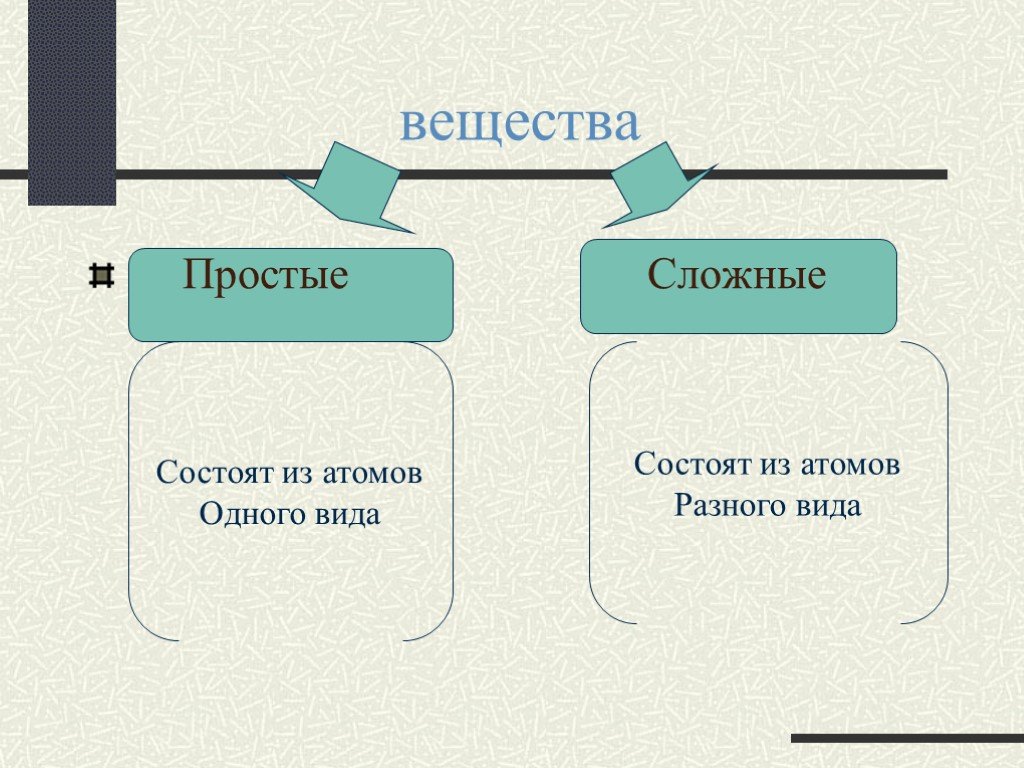
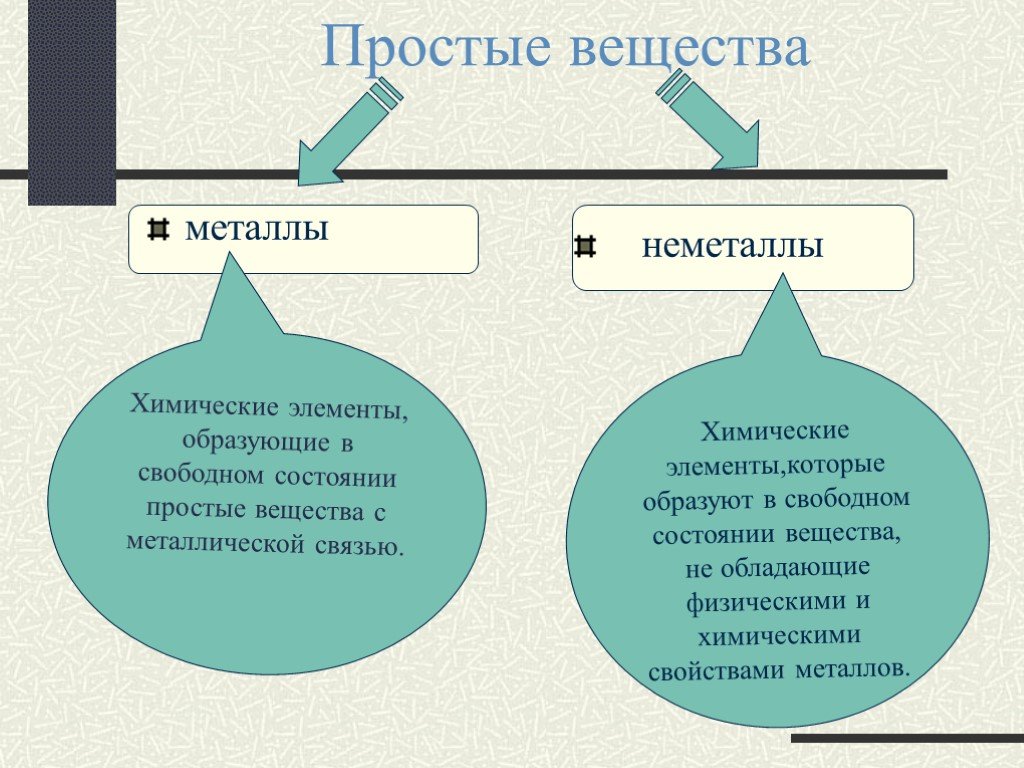
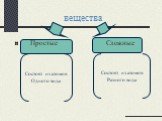
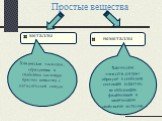
Цель урока:. Познакомить с веществами молекулярного строения,их свойствами. Сформулировать представления о молекулярной кристаллической решетке. План ...Вещества простые и сложные
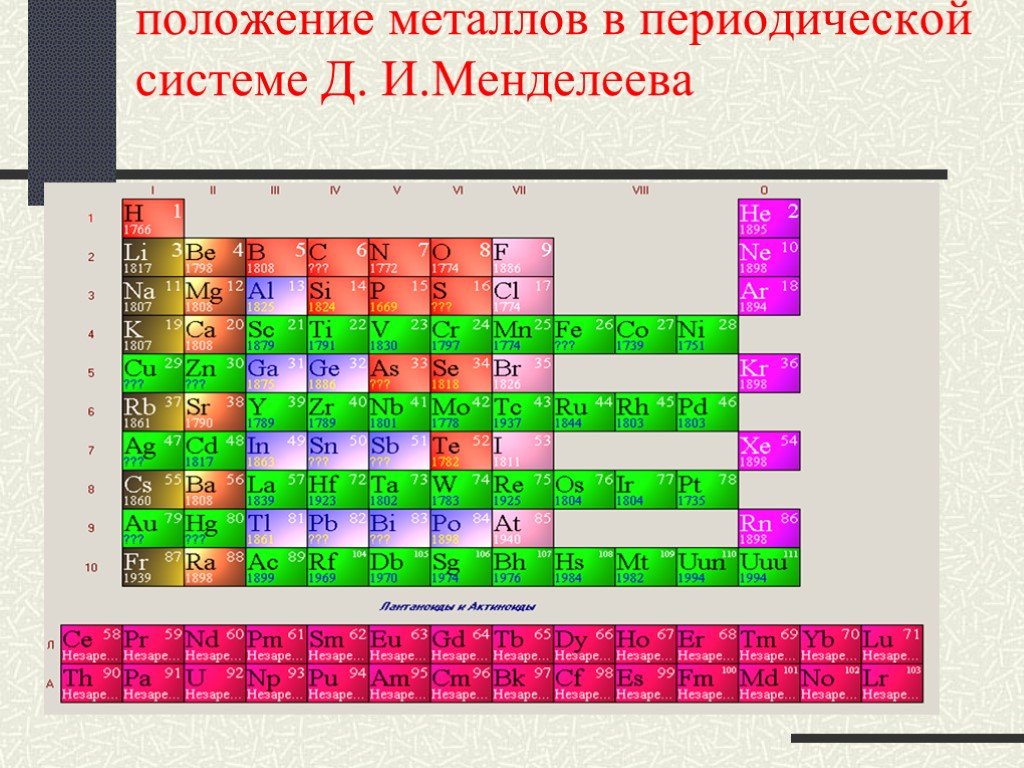
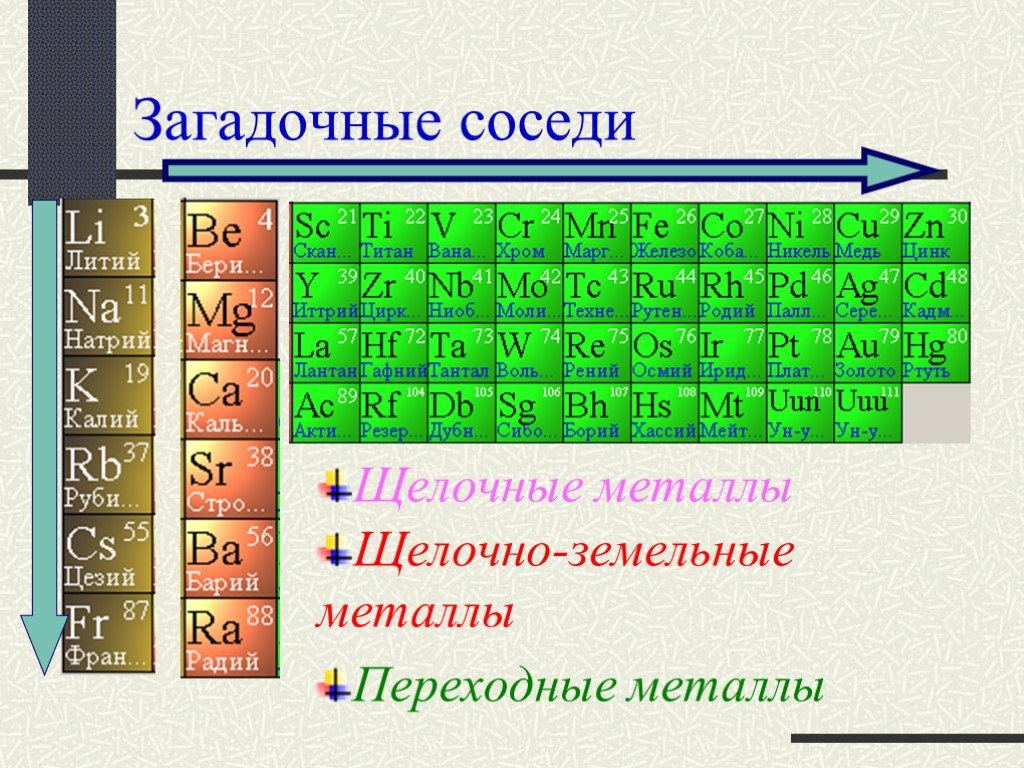
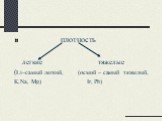
Химический элемент- это определенный вид атома. Что понимается под символами ? Название химического элемента Один атом элемента Относительная атомная ...Вещества и явления в окружающем мире
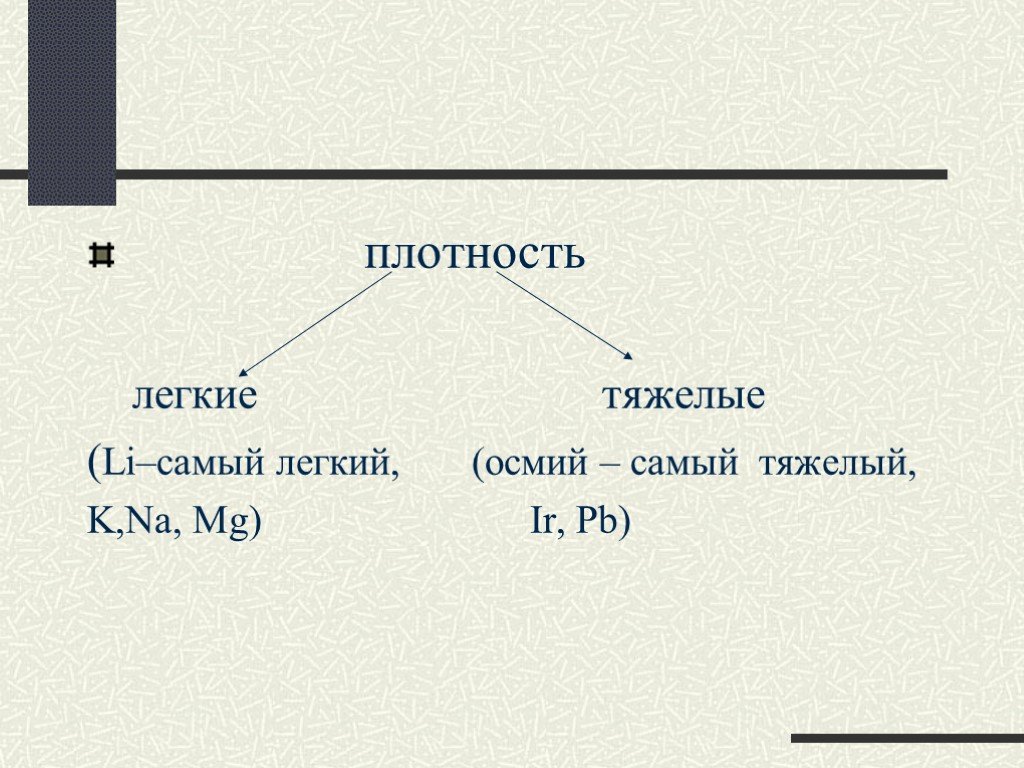
Вещества. Мир, который окружает человека, очень разнообразен. Мы изучили строение Солнечной системы и знаем, что ее составляет Солнце, планеты, их ...Вещества и их свойства
Физические тела – любые предметы, имеющие форму и объем. Например, физическими телами являются самые разнообразные предметы: алюминиевая ложка, гвоздь, ...Вещества в твоей жизни
«Если отец болезни не всегда известен, То всегда мать её – пища» Гиппократ. Цель занятия: научиться использовать полученные знания на уроках химии ...Вещества в природе
1. Какими бывают тела по происхождению? Ответ: живые и неживые. 2. Как называются вещества без примесей? Ответ: чистые. 3. Из чего состоят вещества? ...Вещества – экорегуляторы в природе
Какие-то невидимые нити Связали воедино все вокруг. Они влекут необъяснимой силой Шмелей, жуков и бабочек на луг. Разводят врозь и сталкивают вместе ...Строение вещества химия
СТРОЕНИЕ ВЕЩЕСТВА. Основополагающий вопрос КАК УСТРОЕН МИР? Проблемные вопросы Из чего сделано все на Земле? Почему все устроено так, а не иначе? ...Органические вещества химия
Органическая химия – это дремучий лес, в который и не отважишься войти. Фридрих Велер. С глубокой древности человечество использовало для удовлетворения ...Опасная химия
Выводы по теме «Осторожно, ртуть!»:. Ртуть- очень ядовитый материал, который попадает в организм человека при вдыхании ядовитых паров или употреблении ...Многоликая химия
«Счастливый случай». игра. Гейм I. «Многоликая химия». Общие химические знания. 1. Как называют вещества, которые изменяют скорость химической реакции ...Ломоносов и химия
В 2011 году исполнится 300 лет со дня рождения великого русского ученого, основателя Московского государственного университета Михаила Васильевича ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...Сера химия
Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное практическое применение. ...Периодическая система химия
Предпосылки. И. Дёберейнер, Ж. Дюма, французский химик А. Шанкуртуа, англ. химики У. Одлинг, Дж. Ньюлендс - существование групп элементов, сходных ...Конспекты
Предмет химии. Вещества и их свойства
Урок по химии в 8 классе на тему. «Предмет химии. Вещества и их свойства». Цель урока. : создать условия для формирования у учащихся понятий “химия ...Предмет химии. Вещества и их свойства
Технологическая карта урока № 1. . 1. Ф.И.О. учителя:. Рымарчук Оксана Васильевна. 2. Класс:. __ _8. . Дата: ____________Предмет. Химия. № урока ...Предмет химии. Вещества
МБОУ «Гимназия №1 города Новопавловска». Химия 8 класс. Тема:. Предмет химии. Вещества. Учитель: Татьяна Алексеевна Комарова. ...Предмет химии. Вещества и их свойства
Цели урока:. Обучающая:. сформировать представление о предмете химии. Дать первоначальные понятия о веществе, химическом элементе, о простых ...Предмет химии. Вещества
Тема. I. : «. Введение. Предмет химии». Урок. . №1. . . Тема урока:. . Предмет химии. Вещества. . . Л.Р.№1 «Рассмотрение веществ с различными ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:6 декабря 2018
Категория:Химия
Содержит:23 слайд(ов)
Поделись с друзьями:
Скачать презентацию