Презентация "Химическая кинетика" по химии – проект, доклад
Презентацию на тему "Химическая кинетика" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 24 слайд(ов).
Слайды презентации
Список похожих презентаций
Строение атома Химическая связь
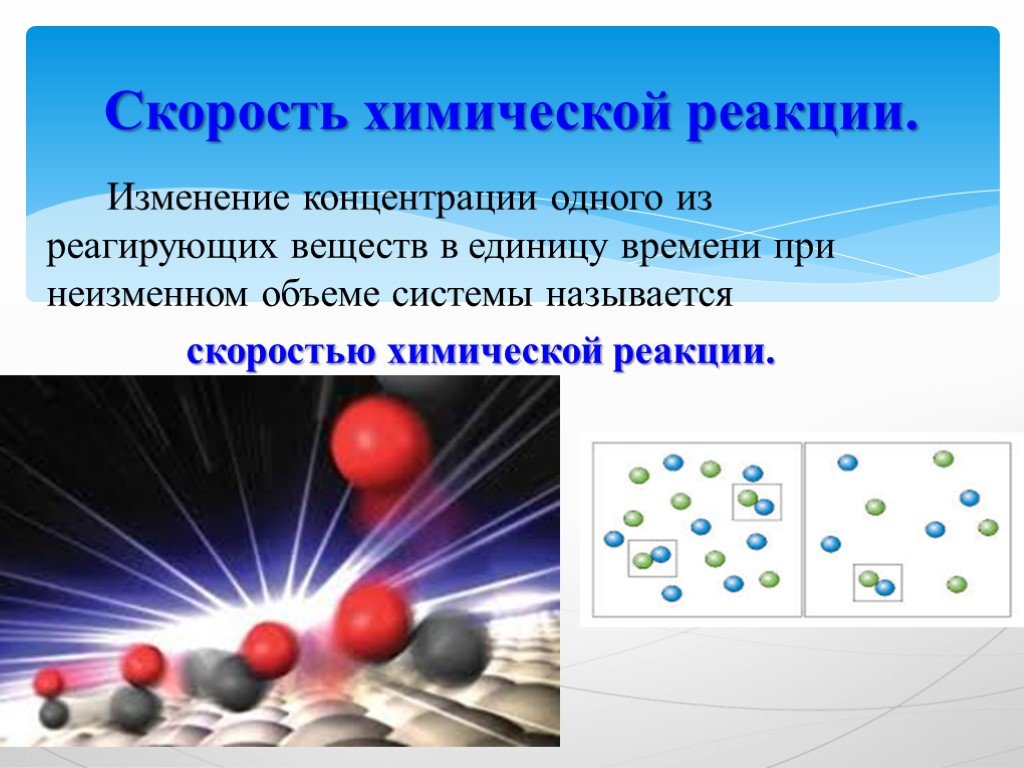
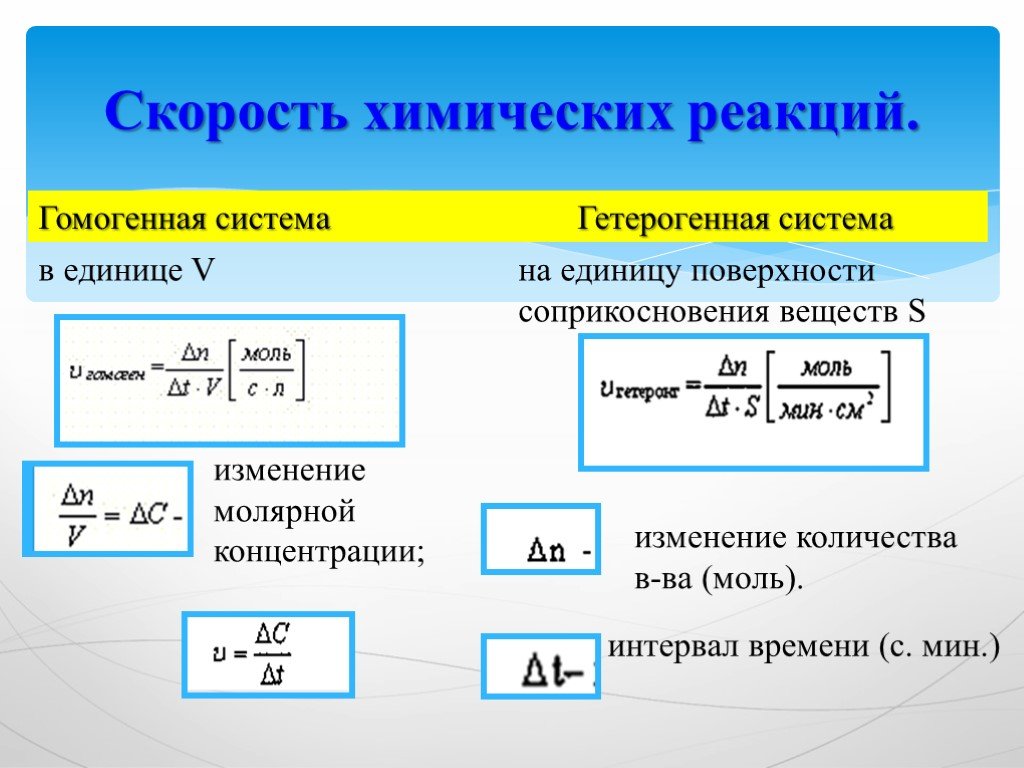
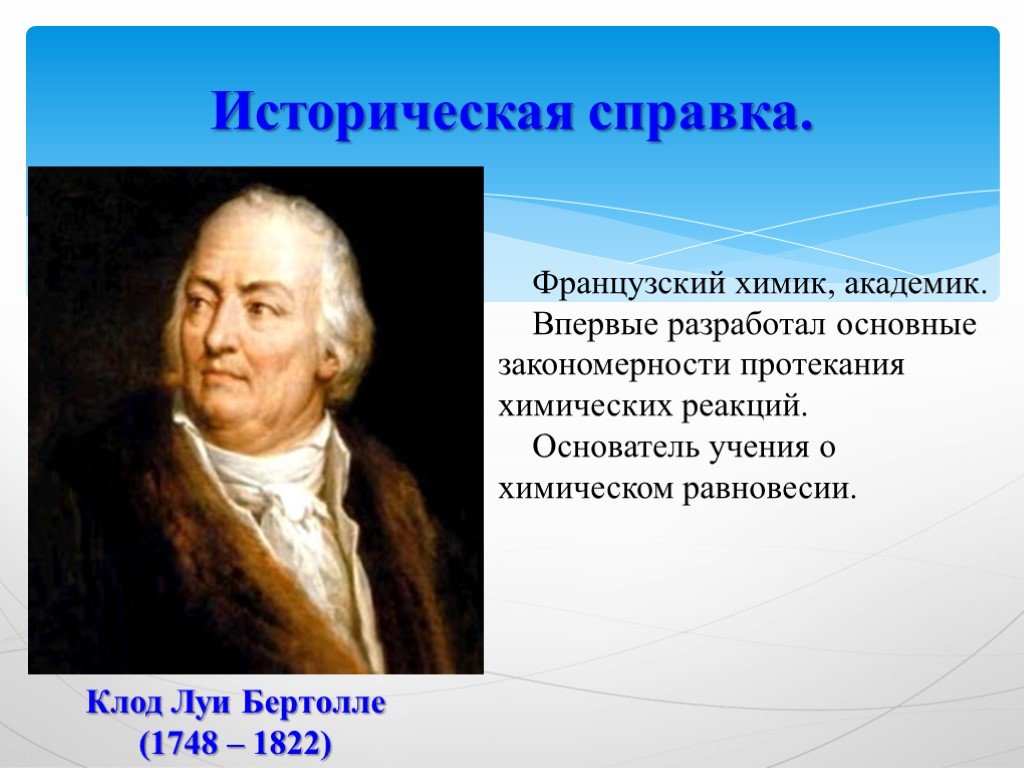
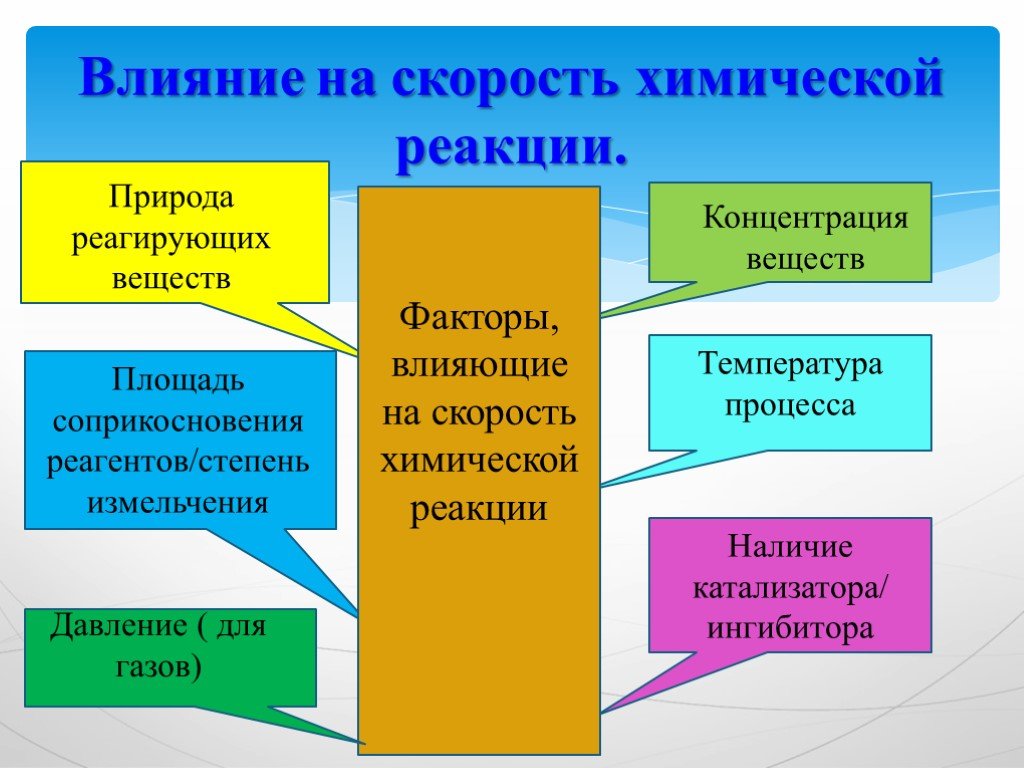
Девиз урока:. Дорога к знанию? Ну, что же, ее легко понять. Ответить можно сразу: Вы ошибаетесь и ошибаетесь, И ошибаетесь опять, но меньше, меньше, ...Химическая формула
Мы видим, что в химии при письме вместо названий используют формулы веществ. Как вы думаете, почему? Действительно, формулы веществ записывать быстрее, ...Химическая, лесная и лёгкая промышленность мира
Химическая промышленность. Химическая промышленность — отрасль промышленности, включающая производство продукции из углеводородного, минерального ...Химическая связь. Ионная химическая связь
Задачи урока: Изучить виды химической связи в теме «строение вещества», на данном уроке разобрать причины и механизмы образования ионной связи. Познакомить: ...Химическая технология
Рекомендуемая литература. Дуплякин В.К. Современные проблемы российской нефтепереработки и отдельные задачи ее развития // Рос. Хим. Ж. – 2007.- т. ...Химическая связь
Химическая связь. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Типы химической ...Химическая связь и её типы
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Ионная химическая связь. это ...Химическая номенклатура и филология
Органическая химия — химия соединений углерода. Международная номенклатура ИЮПАК. IUPAC - International Union of Pure and Apply Chemistry Основные ...Химическая организация клетки. Неорганические вещества
Вещества клетки Неорганические Органические Вода Минеральные соли белки жиры углеводы. Элементы клетки микроэлементы биоэлементы макроэлементы H, ...Химическая завивка
Цель урока. Рассмотреть с учащимися виды и типы химической завивки. Развивать эстетический вкус. Воспитать аккуратность при выполнении химической ...Химическая картина мира
вопросы. 1. Химия как наука. 2. Алхимия как предыстория химии. 3. Эволюция химической науки. 4. Идеи Д. И. Менделеева и А. М. Бутлерова. 5. Антропогенный ...Химическая викторина «Первые шаги»
Чемоданных дел мастер. Любимым занятием на досуге у знаменитого русского химика было изготовление чемоданов и рамок для портретов. Кто из русских ...Химическая викторина "Невероятно, но факт!"
«Мыслящий ум не чувствует себя счастливым, пока не удается связать воедино разрозненные факты, им наблюдаемые» (Д.Хевеши). Хевеши, Дьёрдь де (1.08.1855-05.07.1966) ...Химическая азбука пищи
Тема: « Химическая азбука пищи». ЦЕЛЬ УРОКА:. Полезные и вредные продукты? Много ли я их употребляю? Что для меня здоровое питание? Опасные пищевые ...Химическая связь
Ионная связь металл + неметалл Na + 11 )2)8) 1 Cl + 17 )2)8) 7 8 + –.Электростатическое притяжение.
Na+ Cl- ионы. Свойства ионной связи.
ненаправленная, ...
Химическая посуда
Посуда химическая лабораторная- изделия из стекла, кварца, фарфора, платины и др. материалов, применяемые для препаративных и химико-аналитических ...Химическая связь
Энергетическая диаграмма двух постепенно сближающихся атомов А + А = А2 + энергия выделяется!!! 1 – расстояние большое, энергия взаимодействия близка ...Химическая промышленность
Люди научились из одного вида сырья получать разные продукты. Например:. Нефть. Бензин для автомобилей. Керосин для самолетов. Керосин для пластмассы. ...Химическая связь в комплексных соединениях
Альфред Вернер – первым попытался объяснить химическую связь в комплексных соединениях. 1893 г. – статья Вернера «О строении неорганических соединений». ...Химическая промышленность
Введение. Химическая промышленность – отрасль народного хозяйства, производящая продукцию на основе химической переработки сырья. Это вторая после ...Конспекты
Химическая эстафета
Химическая эстафета (МОУ «ООШ р.п.Озинки). Учитель химии – Лявинскова Наталья Павловна. Пояснительная записка. Внеклассное мероприятие по химии ...Химическая Сказка
Класс: 8. Цель: развить интерес учащихся к предмету. . . Химическая Сказка. Три девушки сидят в рядок, две болтают и смеются одна, увлечена ...Химическая формула. Валентность. Закон постоянства состава вещества
8 класс. Тема урока:. Химическая формула. Валентность. Закон постоянства состава вещества. . Тематическое и поурочное планирование по биологии. ...Химическая связь. Строение вещества. Кристаллические решетки
Дата ____________ Класс _____________. Тема: Химическая связь. Строение вещества. Кристаллические решетки. Цели урока:. закрепить и повторить ...Химическая связь. Строение вещества
Тема: Систематизация и обобщение знаний по теме «Химическая связь. Строение вещества». (стр. флипчарта 1 скрыть / показать). Цель:. . обобщить и ...Химическая организация клетки. Неорганические вещества
Тема: «Химическая организация клетки. Неорганические вещества». Цели урока:. Образовательные. : сформировать знания о роли химических элементов, ...Строение атома. Химическая связь
Учитель: Язрикова Л.М. Предмет Химия. Класс 8 класс. Тема урока Обобщение по теме: «Строение атома. Химическая связь». Место темы в учебном ...ПЗ и ПСХЭ Д.И.Менделеева. Химическая связь
9 класс Дата_________. Урок 1. Тема урока: ПЗ и ПСХЭ Д.И.Менделеева. Химическая связь. . Цель: 1. Обобщить, повторить, закрепить теоретические ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:6 декабря 2018
Категория:Химия
Содержит:24 слайд(ов)
Поделись с друзьями:
Скачать презентацию