Презентация "Учимся решать задачи по химии" – проект, доклад
Презентацию на тему "Учимся решать задачи по химии" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 43 слайд(ов).
Слайды презентации
Список похожих презентаций
Задачи по химии для 10 класса
- на основании массовых долей (%) атомов элементов М где n - число атомов Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; ...Занимательные задачи по химии
Физические и химические явления. Задача №1. Прочитайте отрывок из стихотворения С. Я. Маршака «Вчера и сегодня». Лампа плакала в углу, За дровами ...Задачи по химии
Муниципальное бюджетное образовательное учреждение «Средняя общеобразовательная школа № 7». Составитель: Маклакова Т.С. Вид: Электронный задачник ...«Своя игра» по химии
Необходим в составе костей скелета. Меню. Лечебные элементы 20. Дезинфектор ран. Лечебные элементы 40. Избыток ионов этого элемента может вызвать ...«Деятельностно-компетентностный подход к преподаванию химии в средней школе через современные образовательные технологии»
КЛЮЧЕВЫЕ КОМПЕТЕНТНОСТИ. Общепредметные компетенции:. Предметные компетенции:. понятие о химии, как неотъемлемой составляющей естественно-научной ...Методы познания химии
09.09.2018. Метод (от греческого слова «методос» — путь к чему-либо) означает совокупность приемов и операций практического и теоретического освоения ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
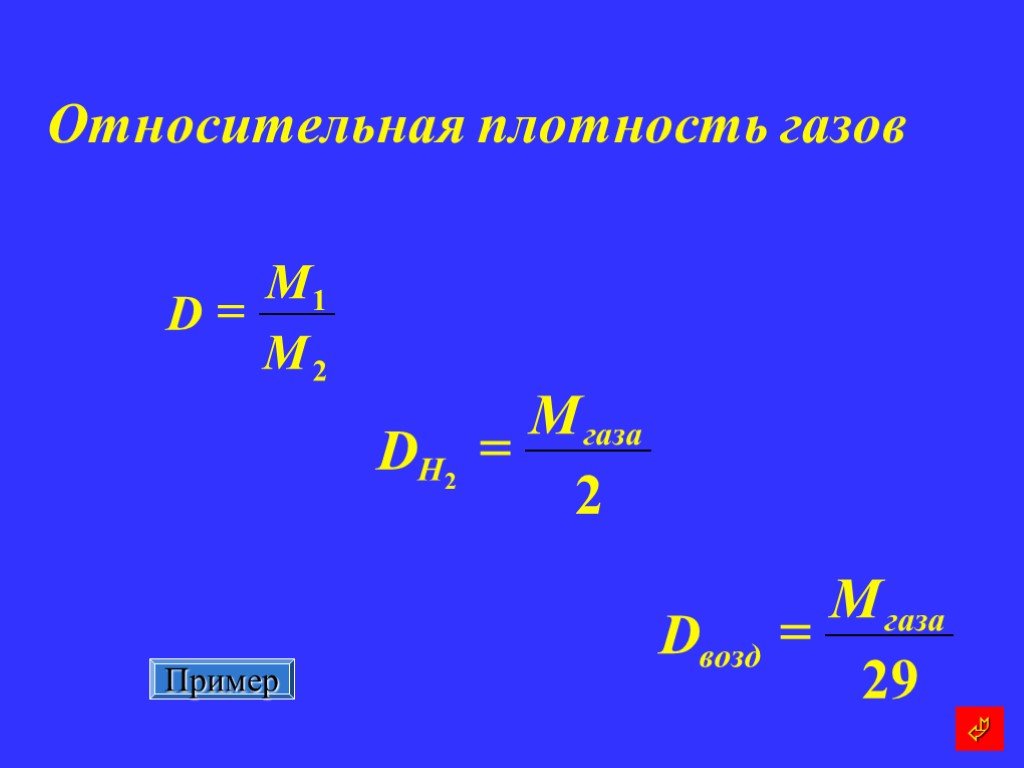
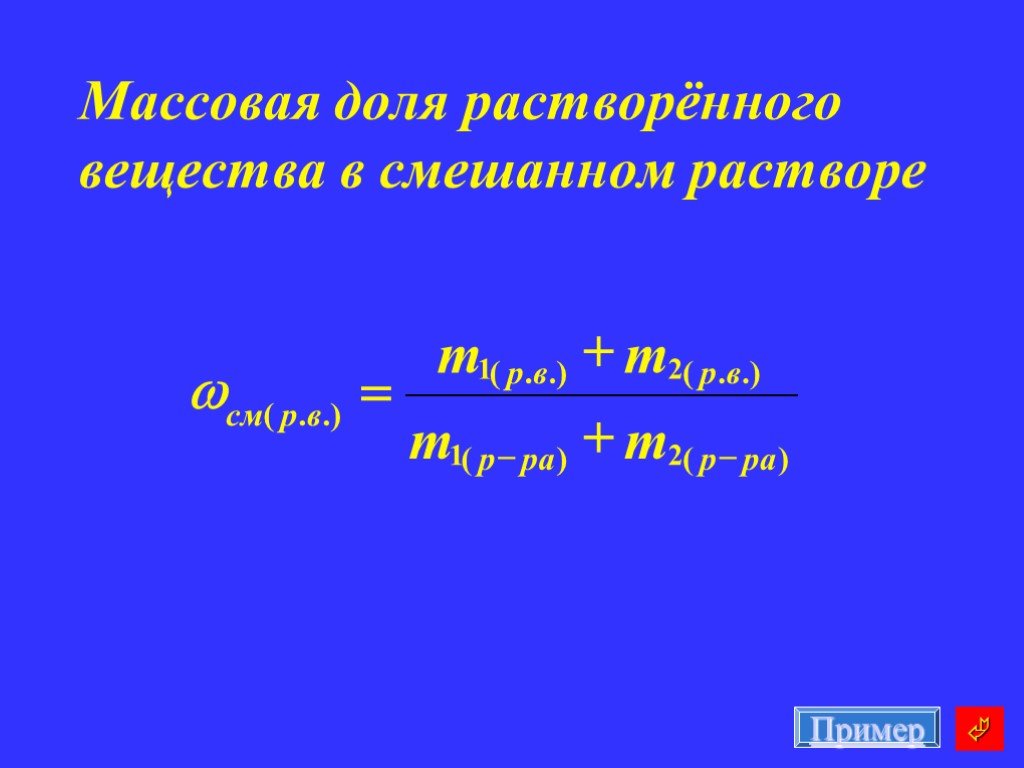
Химическая среда. Сама вода является очень слабым электролитом. При её электролитической диссоциации образуются катионы водорода и гидроксид-ионы ...Алгоритм решения задач по химии
Алгоритм решения задач по химии:. Записать краткое условие задачи; *В случае необходимости произвести предварительный расчет; Перевести величины, ...Активизация обучающихся на уроках химии как показатель развития их мыслительной деятельности.
Приёмы активизации мыслительной деятельности обучающихся:. Приём стимулирующих звеньев Приём реконструкции Приём прогнозирования. Приём стимулирующих ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Содержание химии очень обширно и часто предстает копилкой огромного числа формул, уравнений, фактов и законов, запомнить которые не просто трудно, ...Методика преподавания химии в школе. УМК по химии
Учебник. Дидактические материалы. 8 класс: 9 класс. Методическое пособие. Цифровые ресурсы. Лабораторный журнал. Учебная книга Задачник. Автор: Жилин ...Анализ результатов ЕГЭ по химии 2010 (окружной семинар учителей химии)
Результаты ЕГЭ 2010. Граница минимального балла -33 тестовых балла (12 первичных баллов). Уровни оценивания: неудовлетворительный – 0–32 / 0–11; удовлетворительный ...Азотная кислота по химии
Тема: «Азотная кислота» Цель урока: Рассмотреть свойства азотной кислоты и области ее применения. План урока: 1. Проверка Д/З (письменная работа); ...Игра по химии «Остров Периодическая Система»
«Остров Периодическая Система». Изучение Периодической Зависимости свойств элементов от строения атома. Периодическая Система. Схема учебного занятия. ...Анализ ЕГЭ по химии 2011
Уровни выполнения экзаменационной работы. неудовлетворительный – 0–31 / 0–12, удовлетворительный –32–56 / 13–35, хороший – 57–77 / 36–56, отличный ...Игра-зачет по химии 8 клас
Приветствие команд. Команда №4 Команда №3 Команда №2 Команда №1. Условия игры. Блиц-турнир (по 3 вопроса) Каждая команда по очереди выбирает вопрос, ...Викторина по химии
1.Газ, который применили во время первой мировой войны в качестве химического оружия. 2. Единственный жидкий металл. 3.Русский учёный - энциклопедист. ...Викторина по химии "Что это?"
РЕБЯТА!!! ЗА МНОЙ!!! К ВИКТОРИНЕ «ЧТО ЭТО?». ОПРЕДЕЛЯЕМ, О КАКИХ ВЕЩЕСТВАХ ИДЕТ РЕЧЬ??? 1 2 4 5 6 7 8 9 10 11 12 ВЫБИРАЙ!! Трудно представить, что ...Викторина «Своя игра» по химии
Вопрос. Отечественный ученый, назвавший человека – «мощной геологической силой, способной изменить лик Земли»? Как называется нарушение природной ...Личностно – ориентированный подход в обучении химии
Когда людей станут учить не тому, что они должны думать, а тому как они должны думать, то тогда исчезнут всякие недоразумения. Г. Лихтенберг. Как ...Конспекты
Решение экспериментальных задач по органической химии
Конспект открытого урока . Практическая работа №4 «Решение экспериментальных задач по органической химии». Класс:10. УМК: Рудзитис Г.Е., ФельдманФ.Г. ...Обобщающее повторение по неорганической химии
Обобщающее повторение по неорганической химии за курс 8 класса. Разработан Савич Еленой Николаевной учителем биологии, химии Донецкой СШ с. Донецкое, ...Материалы для индивидуальной работы по химии
Предмет: химия. Учитель: Пестова Татьяна Михайловна. Класс: 8. Материалы для индивидуальной работы по химии. Индивидуальные задания разнообразны ...Развитие интеллекта и творческих способностей учащихся на уроках химии
Перед современной школой стоит задача воспитания грамотного, продуктивно мыслящего человека, адаптированного к условиям жизни в обществе. Проблема ...Задачи по теме «Галогены
Задачи по теме «Галогены». №1. Сколько миллилитров раствора с массовой долей соляной кислоты 36 % (пл. 1,2 г/мл) необходимо для взаимодействия 0,1 ...Развитие познавательной самостоятельности на уроках химии через составление химических задач
Развитие познавательной самостоятельности на уроках химии через составление химических задач. «Не мыслям надо учить, а мыслить…». . И.Кант. ...методическая разработка урока по химии
Муниципальное бюджетное общеобразовательное учреждение. « Средняя общеобразовательная школа села Алексеевка ». Базарно – Карабулакского района Саратовской ...Лабораторные опыты по неорганической химии (свойства кислот, оснований, солей)
III. . . . Технологическая карта урока. ЭТАПЫ УРОКА. ДЕЯТЕЛЬНОСТЬ УЧИТЕЛЯ. . ДЕЯТЕЛЬНОСТЬ УЧЕНИКА. . 1.Организационный. . момент. ...Использование опорных схем на уроках химии
Муниципальное образовательное автономное учреждение средняя общеобразовательная школа с углубленным изучением отдельных предметов №1 г. Белогорск, ...Определение валентности элементов по формулам их соединений
Название образовательного учреждения:. Муниципальное казённое общеобразовательное учреждение. «Тальменская средняя общеобразовательная школа №1». ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:6 декабря 2018
Категория:Химия
Содержит:43 слайд(ов)
Поделись с друзьями:
Скачать презентацию










































































![Задача: Окисление серы протекает по уравнению: S(тв)+O2(г)=SO2(г) Как изменится скорость реакции, если объём системы уменьшить в 4 раза? Дано: V1/V2=4 Найти: Решение: S(тв) +O2(г)=SO2(г) (гетерогенная реакция) Обозначим концентрацию кислорода: [O2] = a 1. Согласно закону действующих масс скорость ре Задача: Окисление серы протекает по уравнению: S(тв)+O2(г)=SO2(г) Как изменится скорость реакции, если объём системы уменьшить в 4 раза? Дано: V1/V2=4 Найти: Решение: S(тв) +O2(г)=SO2(г) (гетерогенная реакция) Обозначим концентрацию кислорода: [O2] = a 1. Согласно закону действующих масс скорость ре](https://prezentacii.org/upload/cloud/18/12/106696/images/thumbs/screen33.jpg)