Презентация "Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение" по химии – проект, доклад
Презентацию на тему "Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 39 слайд(ов).
Слайды презентации
Список похожих презентаций
Оксиды, их классификация и свойства
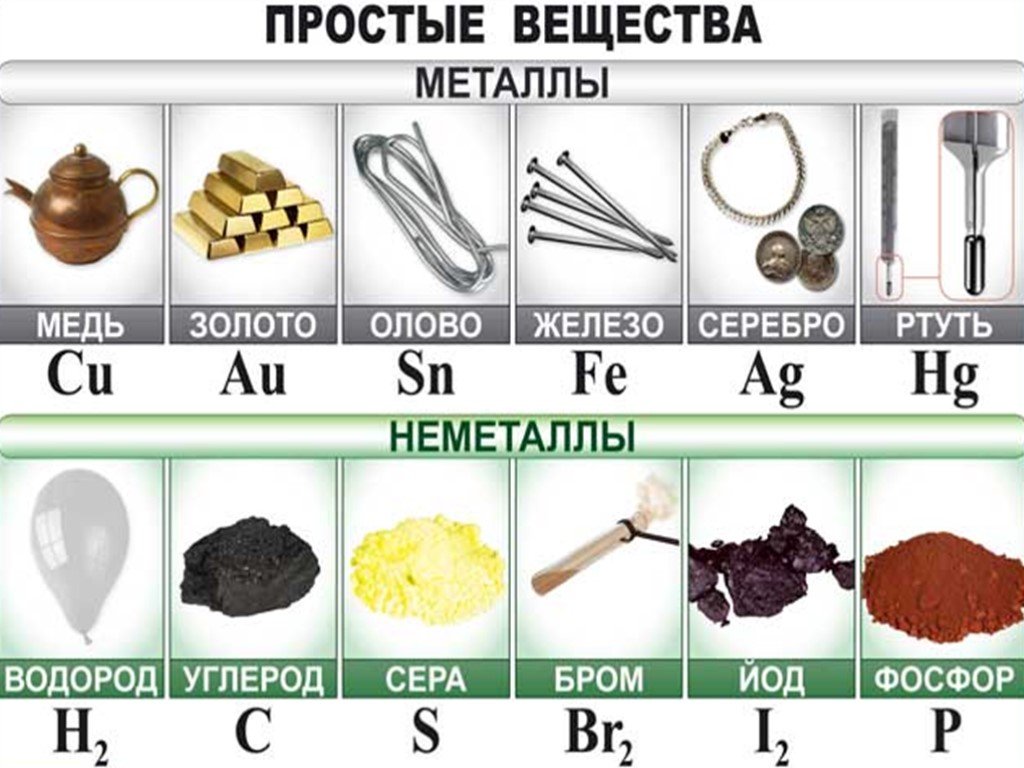
Что такое оксиды? Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2. Классификация ...Кислород. Получение кислорода и его физические свойства
Цель. сформировать понятия кислород как атом и молекула; изучить физические и химические свойства кислорода, нахождение его в природе; рассмотреть ...Кислоты. Классификация. Свойства
Определение. КИСЛОТЫ-это сложные вещества, состоящие из атомов водорода и кислотного остатка. Классификация кислот. Названия распространенных кислот. ...Алюминий, его Свойства и применение
Al 13. Алюминий (лат. Aluminium). 3 8 2 26,9815 3s2 3p1. Был впервые получен датским физиком Х.К. Эрстедом в 1825 г. Название этого элемента происходит ...Получение и свойства водорода
Как вы думаете , где используется водород? Каково практическое значение водорода? Где можно использовать знания по данной теме? Каковы цели урока? ...Нефть. Свойства, состав, переработка
Любая попытка дать характеристику такому многогранному дару природы, как нефть, никогда не может быть исчерпывающей. О нефти писали и будут писать. ...Классификация и свойства кислот
Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка. Классификация кислот. По основности:. Одноосновные ...Классификация и свойства кислот
Неорганические кислоты- это сложные неорганические вещества, молекулы которых содержат один или несколько атомов водорода, способных замещаться на ...Получение и свойства алканов
ПОЛУЧЕНИЕ АЛКАНОВ:. ФРАКЦИОННАЯ ПЕРЕГОНКА НЕФТИ Нефть поступает в ректификационные колонны на атмосферную перегонку (перегонку при атмосферном давлении), ...Получение радиоактивных изотопов и их применение
Определение. Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либо химического элемента, ...Получение и свойства алканов
Оглавление. Определение Гомологического ряд метана Строение молекулы метана Номенклатура Изомерия Получение Физические свойства Химические свойства ...Получение галогенов. Биологическое значение и применение галогенов
Давайте вспомним . . . Положение галогенов в таблице Менделеева Что вы можете сказать о физических свойствах галогенов А) Агрегатное состояние Б) ...Получение и применение индикаторов
Наука играет столь важную роль в современной жизни, что ни один человек без научных знаний не может правильно понять мир, в котором он живет Лайнус ...Классификация и номенклатура неорганических соединений
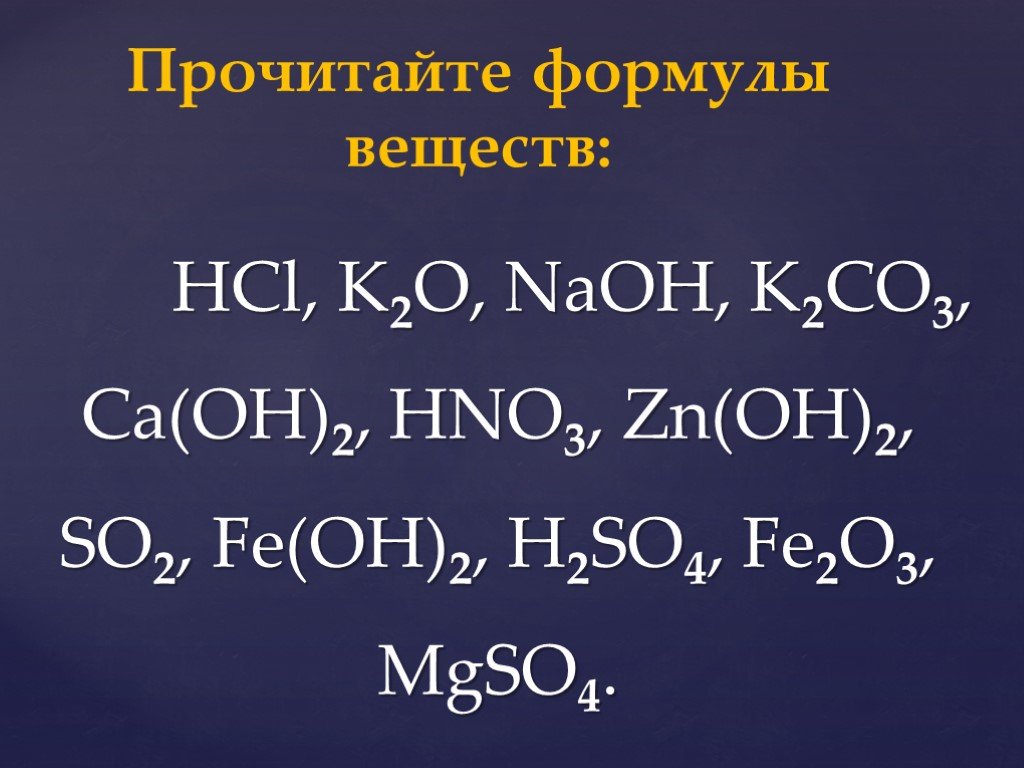
ОТВЕТИТЬ НА ПРЕДЛОЖЕННЫЕ ВОПРОСЫ В ПОРЯДКЕ ИХ ПОСТАНОВКИ. Вариант 1 Основания – это… Кислотные оксиды – это … С водой реагирую только оксиды металлов ...Получение и химические свойства кислорода
Цели и задачи урока:. Выяснить источник кислорода в природе; познакомиться с лабораторными и промышленными способами получения кислорода Познакомиться ...Классификация неорганических веществ. Оксиды
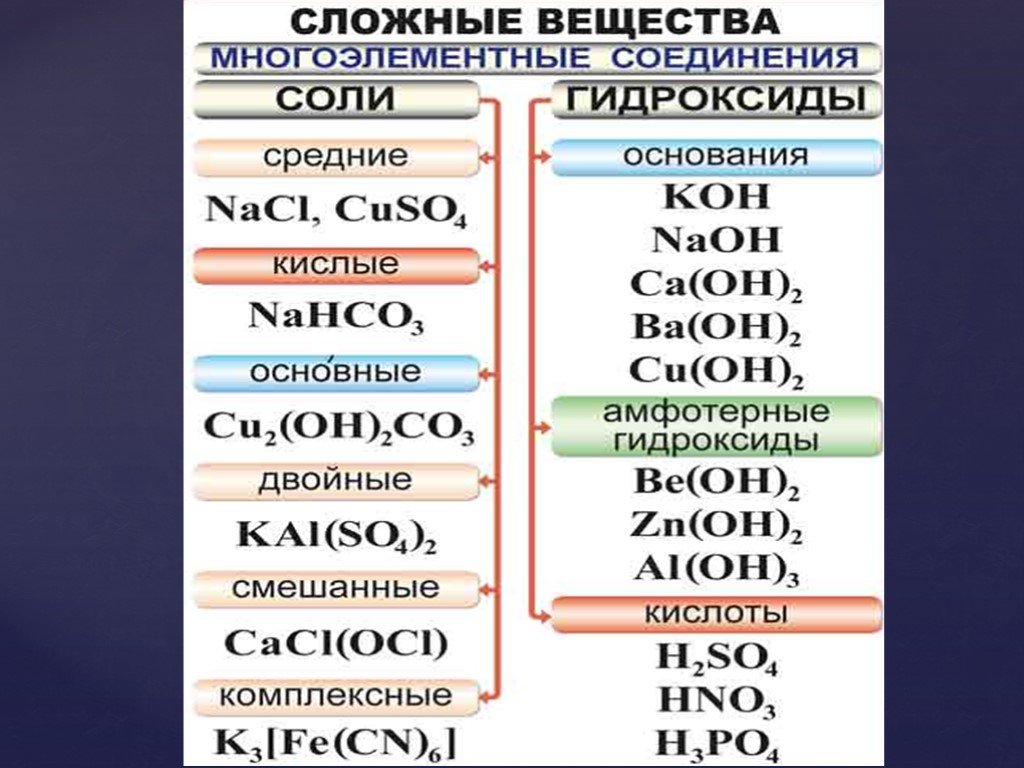
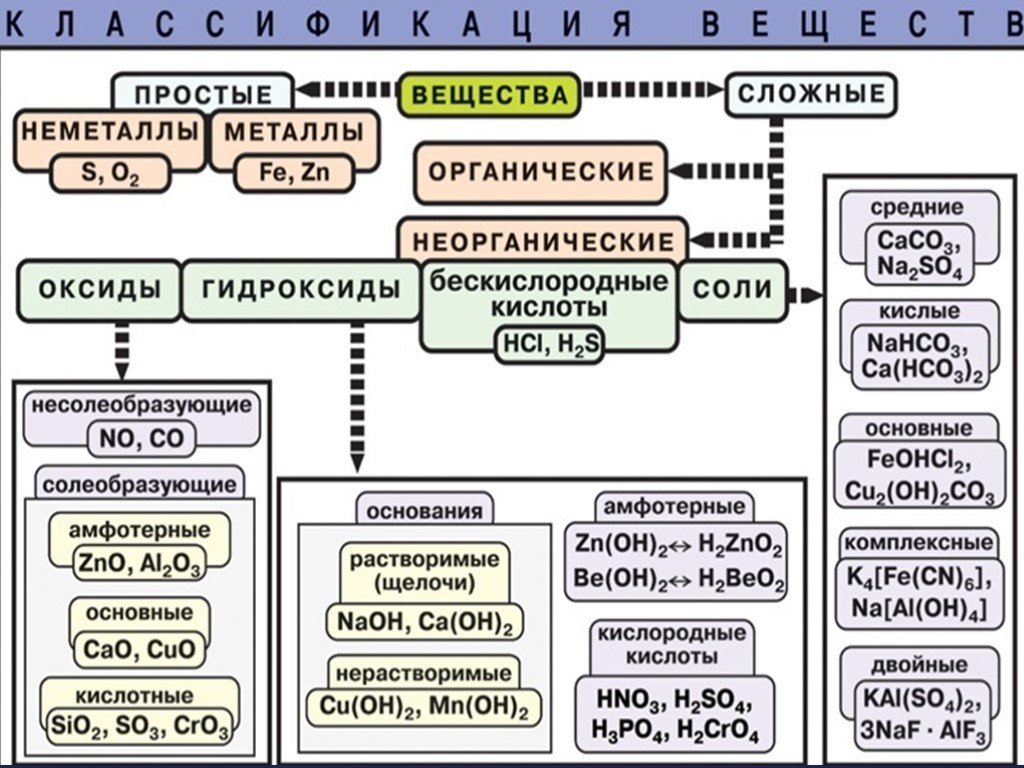
ОКСИДЫ. Оксиды- бинарные соединения с кислородом в степени окисления (-2). Общая формула оксидов: ЭmOn где m число атомов элемента Э, а n – число ...Алкены. Строение. Изомерия. Химические свойства. Получение
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Оксиды, их применение
Один из распространенных оксидов – диоксид углерода CO2 – содержится в составе вулканических газов. В природе. Газ, необходимый растениям для фотосинтеза. ...Классификация сложных и неорганических веществ. Оксиды". 8-й класс
Na2O – оксид натрия. Al2O3 – оксид алюминия ВаО – оксид бария. FeO – оксид железа Fe2O3 – оксид железа N2O – оксид азота NO2 – оксид азота ? N2O – ...Оксиды, их классификация
Это газ, необходимый растениям для фотосинтеза. Это газ, выделяемый нами при выдохе. Что это за газ? … на рукомойнике моём Позеленела медь, Но так ...Конспекты
Жиры, их состав и свойства. Биологическая роль жиров. Получение и применение жиров
Тема:. Жиры, их состав и свойства. Биологическая роль жиров. Получение и применение жиров. Цель:. Формировать знания учащихся о составе жиров, ...Кислород: химический элемент и простое вещество. Свойства, получение и применение кислорода
Тема. :. Кислород: химический элемент и простое вещество. Свойства, получение и применение кислорода. Цель: Развитие исследовательских способностей ...Аминокислоты. Состав, строение, физические свойства и получение
Министерство образования и науки РФ. Муниципальное общеобразовательное учреждение СОШ №2. п. Спирово Тверской области. Конспект урока ...Оксиды, их классификация и свойства
Тимофеева Ольга Николаевна. . Приложение 4.1.4. Конспект урока химии. Тема урока:. Оксиды, их классификация и свойства. Класс: 8. . Тип ...Водород. Получение, свойства, применение
Тема урока. «Водород. Нахождение в природе. Физические и химические свойства. Получение и применение.». Учитель химии И.А.Калашникова. ...Оксиды, их классификация и свойства
Тема урока. Оксиды, их классификация и свойства. Цель:. Формирование целостного представления об оксидах, как классе неорганических соединений. ...Вода в природе. Состав, свойства и применение воды
Дата:. 26.02. 15 г. Предмет:. химия, 8 класс. Тема: Вода в природе. Состав, свойства и применение воды. ЦЕЛЬ:. . Сформировать знания о распространении ...Аммиак. Физические и химические свойства. Получение, применение
Конспект урока по химии. Учитель: Сапрыкина Людмила Анатольевна. Предмет: химия класс: 9. Тема урока: «. Аммиак. Физические и химические свойства. ...Аммиак. Строение молекулы. Физические и химические свойства. Получение, применение
ПЛАН-КОНСПЕКТ УРОКА Аммиак. Строение молекулы. Физические и химические свойства. Получение, применение. ФИО:. Исмаилова Венера Владимировна. ...Галогены. Нахождение в природе. Физические и химические свойства. Применение
Урок по теме: «Галогены. Нахождение в природе. Физические и химические свойства. Применение ». Тип урока. : изучение нового материала. Вид урока. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 ноября 2018
Категория:Химия
Содержит:39 слайд(ов)
Поделись с друзьями:
Скачать презентацию