Презентация "Первое применение начало термодинамики к экзопроцэссам" по физике – проект, доклад
Презентацию на тему "Первое применение начало термодинамики к экзопроцэссам" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
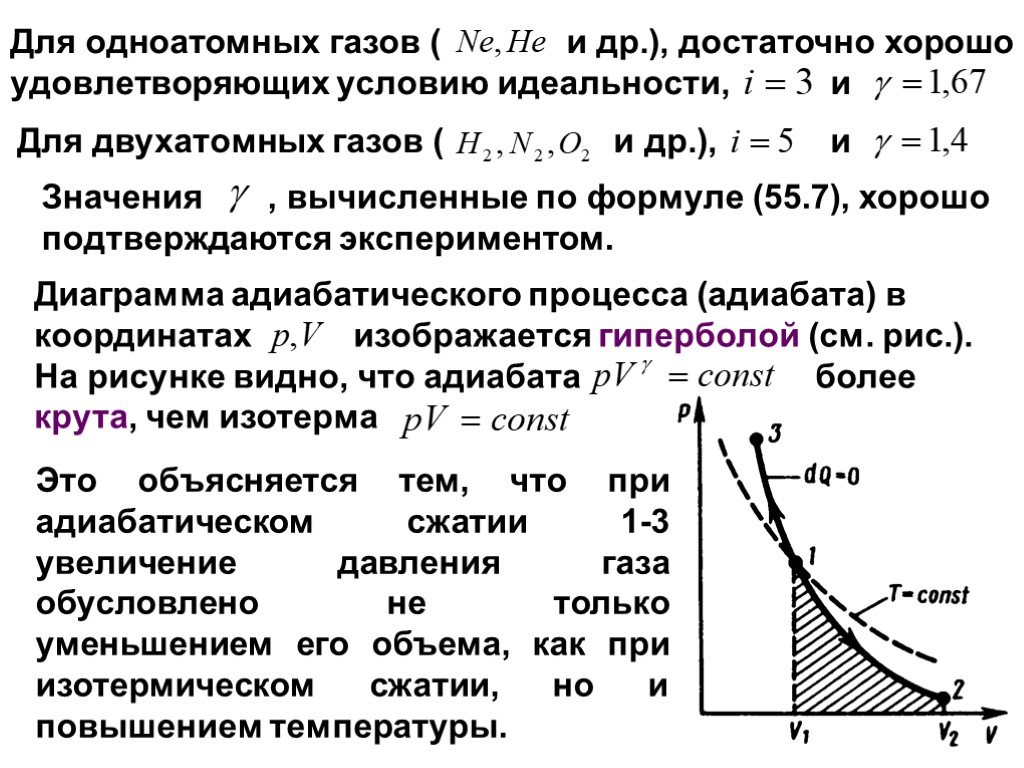
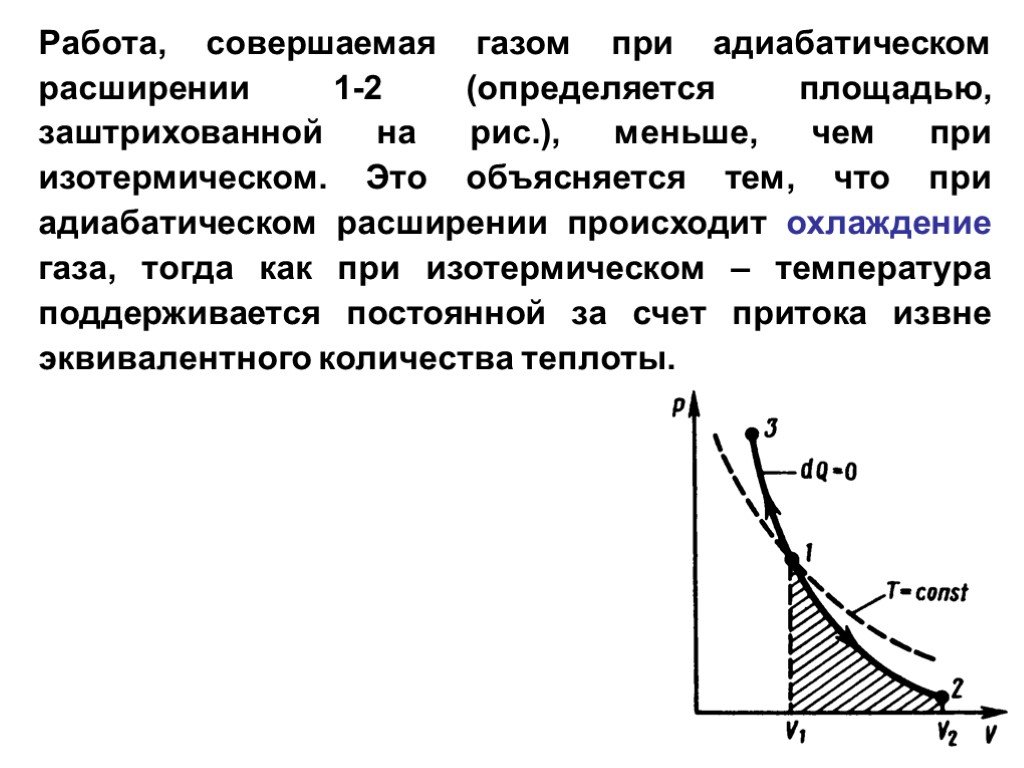
Первое начало термодинамики
Вечный двигатель - воображаемое устройство, способное бесконечно совершать работу без затрат топлива или других энергетических ресурсов. Одна из древнейших ...14 2-е начало термодинамики
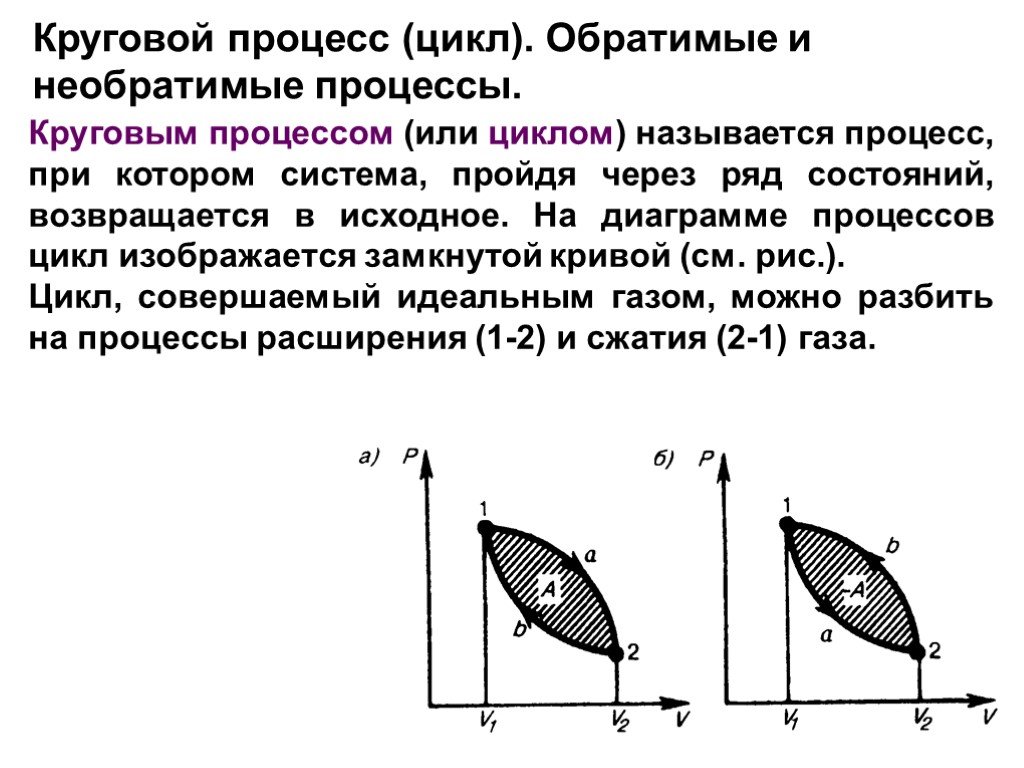
Изменение внутренней энергии рабочего тела за цикл равно нулю потому, что тело возвращается в исходное состояние. Следовательно, вся полученная теплота ...Применение первого закона термодинамики
1. Два принципа первого закона термодинамики. Первый закон термодинамики является частным случаем всеобщего закона о превращении и сохранении энергии ...Применение первого закона термодинамики к различным процессам
Науки юношей питают, Отраду старым подают, В счастливой жизни украшают, В несчастный случай берегут…. М. В. Ломоносов. ∆U=A+Q. Изменение внутренней ...13 1-е начало термодинамики, теплоемкость, работа
Напомним: Функцией состояния. Так как все определяется изменением (производной) энергии, а энергия взаимодействия электронов внутренних оболочек с ...Применение первого закона термодинамики к изопроцессам
Внутренняя энергия газа зависит от температуры газа. Газ может совершать работу при любых происходящих с ним процессах. При изобарном расширении газ ...Второе начало термодинамики
Используя понятие энтропии и неравенство Клаузиуса, второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы ...Первый закон термодинамики
Что надо выяснить:. Выполнение закона сохранения энергии в тепловых процессах. Как применить закон сохранения энергии к изопроцессам. Что такое адиабатный ...Первый закон термодинамики
Изменение потенциальной энергии системы равно работе, совершаемой над системой при перемещении ее из одного места силового поля в другое. Внутренняя ...I закон термодинамики
Закон сохранения энергии. Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы ...Второй закон термодинамики
Обратимый процесс. Это процесс, который может происходить как в прямом, так и в обратном направлении Обратимый процесс – это идеализация реального ...Электродвигатели и их применение
Электрический двигатель -это (электромеханический преобразователь), в которой электрическая энергия преобразуется в механическую, побочным эффектом ...Теоретические основы ИК-спектроскопии и применение в фармации
План лекции: Теоретические основы метода. ИК-спектр. Аппаратура ИК–спектроскопии. Применение в фармации. Теоретические основы метода Явление взаимодействия ...применение магнитов
Что же такое магнит? – это объект, сделанный из определенного материала,. Магнит. который создает магнитное поле. Каждый магнит имеет, по крайней ...Законы термодинамики
НУЛЕВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. Нулевое начало термодинамики сформулированное всего около 50 лет назад , по существу представляет собой полученное «задним ...Законы термодинамики
Первый закон термодинамики постулирует существование внутренней энергии – некоторой функции состояния[1] , такой, что если к системе подводится тепло ...Закон отражения и его применение
Как возникает такая красота ! Закон отражения света:. Угол падения равен углу отражения. 2. Луч падающей волны, луч отраженной волны и перпендикуляр ...Закон Кулона и его применение
Как называется раздел физики, изучающий неподвижные заряженные тела? Электростатика Какое взаимодействие существует между заряженными телами, частицами? ...Второй закон термодинамики
1. Два положения второго закона термодинамики. Различные формы передачи энергии неравноценны. Энергия теплового движения стремиться в большей степени, ...Второй закон термодинамики
Цель занятия: знать второй закон термодинамики, принцип работы теплового двигателя. Уметь приводить примеры тепловых двигателей и определять КПД. ...Конспекты
Первое начало термодинамики
. Урок разработала:. Свириденко Ольга Владимировна – учитель физики МОУ «СОШ р.п. Красный Текстильщик Саратовского района Саратовской области». ...Электромагниты, их свойства и применение
Урок по теме: Электромагниты, их свойства и применение. План-конспект урока. Цель урока. : актуализировать знания . об устройстве и принципе ...Электромагниты, их свойства и применение
Электромагниты, их свойства и применение. Конспект деловой игры для 8 класса. Ц е л ь у р о к а: Продолжить развитие навыков самостоятельной работы ...Электрическое поле и ее применение в конденсаторах
Повторительно- обобщающий урок. (Лабораторная работа). Тема: «Электрическое поле и ее применение в конденсаторах». . Цель и задача урока:. Обобщить ...Самостоятельный разряд в газах. Различные типы самостоятельного разряда и их применение
Схема проведения урока. Физика 10 класс. Учитель физики. МОУ СОШ № 9. Ст. Расшеватской. Новоалександровского района. Ставропольского края. ...Решение задач на применение формулы тонкой линзы
МОУ СОШ №25. С углубленным изучением отдельных предметов. Муниципальный округ Орехово-Зуево. Открытый урок по физике. КЛАСС: 11А. ТЕМА: ...Решение задач на применение законов Ньютона
План-конспект урока. ТЕМА 2. Динамика. ЗАКОНЫ ДВИЖЕНИЯ НЬЮТОНА. УРОК № 5. . Решение задач на применение законов Ньютона. ТИП УРОКА:. комбинированный. ...Решение задач на применение законов Ньютона
Урок физики в 10 классе по теме: (слайд №1). «Решение задач на применение. законов Ньютона». Цель урока:. Систематизация знаний о законах Ньютона. ...Разработка и применение комплекса дистанционных веб-ресурсов по физике
. Разработка и применение комплекса. дистанционных веб-ресурсов по физике. Львовский Марк Бениаминович, канд. техн. наук, учитель физики высшей ...Практическое применение законов постоянного тока
Урок по физике. «Практическое применение законов постоянного тока». Общеобразовательная программа.9класс. Учитель: Бражникова Татьяна ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:2 мая 2019
Категория:Физика
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию