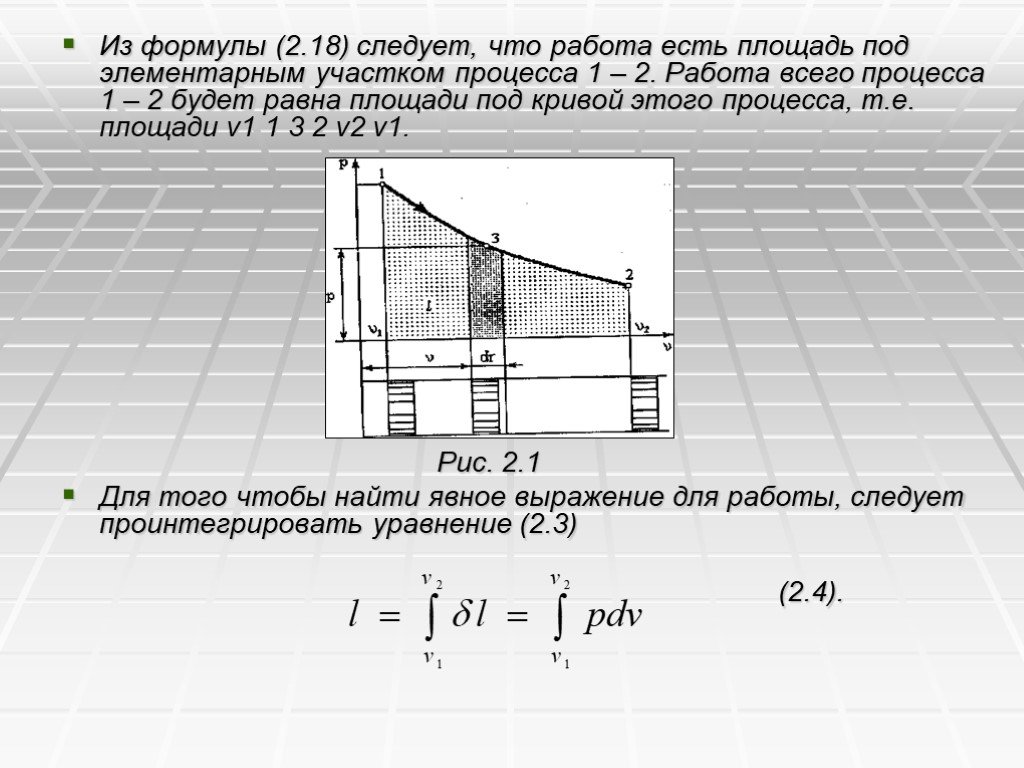
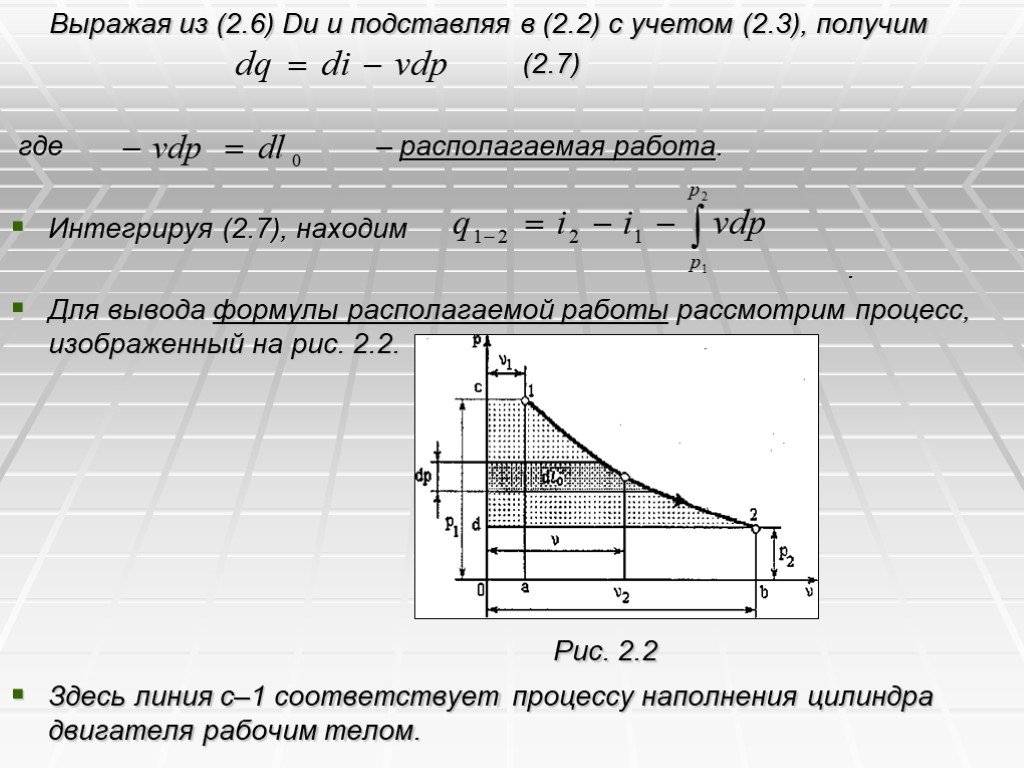
Презентация "Первый закон термодинамики" по физике – проект, доклад
Презентацию на тему "Первый закон термодинамики" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Второй закон термодинамики,вечный двигатель
Второй закон. энтропия. Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что ...1 закон термодинамики
Внутренняя энергия Количество теплоты Теплопередача Конвекция Теплопроводность Излучение Закон сохранения энергии 1 закон термодинамики Закон Бойля-Мариотта ...Взаимодействие тел. Первый закон Ньютона
Основы динамики. Законы Ньютона объясняют, в каких случаях тела сохраняют, а в каких изменяют скорость своего движения. ? ? ? ? ? ·Всякое движение ...I закон термодинамики
Закон сохранения энергии. Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы ...Второй закон термодинамики
1. Два положения второго закона термодинамики. Различные формы передачи энергии неравноценны. Энергия теплового движения стремиться в большей степени, ...Обратимые и необратимые процессы. Необратимость тепловых процессов. Второй закон термодинамики
Закон сохранения энергии утверждает, что количество энергии при любых ее превращениях остается неизменным. Между тем многие процессы, вполне допустимые ...Закон инерции- первый закон Ньютона. Место человека во Вселенной
Цели урока:. Дать понятия: инерции, инерциальных систем отсчета, закона инерции, принципа относительности Галилея Дать понятие о развитии представления ...Законы термодинамики
Первый закон термодинамики постулирует существование внутренней энергии – некоторой функции состояния[1] , такой, что если к системе подводится тепло ...Второй закон термодинамики
Цель занятия: знать второй закон термодинамики, принцип работы теплового двигателя. Уметь приводить примеры тепловых двигателей и определять КПД. ...Из истории законов термодинамики
Каждый выдающийся исследователь вносит своё имя в историю науки не только собственными открытиями, но и теми открытиями, к которым он побуждает других. ...Второй закон термодинамики
Энергия и энтропия являются неотъемлемыми свойствами материи, причем энергия есть мера движения материи, а энтропия – мера рассеивания (деградации) ...Второй закон термодинамики
Обратимый процесс. Это процесс, который может происходить как в прямом, так и в обратном направлении Обратимый процесс – это идеализация реального ...Законы термодинамики
НУЛЕВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. Нулевое начало термодинамики сформулированное всего около 50 лет назад , по существу представляет собой полученное «задним ...Законы термодинамики в геологических процессах
Внутренняя энергия. 1. Согласно первому закону термодинамики, все системы, находящиеся в одном и том же состоянии, имеют одну и ту же внутреннюю энергию, ...Давление твердых тел , жидкостей , газов, закон Архимеда
Физические величины. Давление-это…. Давление: p=F/S; Па. Давление жидкостей. . Атмосфера. Азот-78% Кислород-21% Аргон-0,93% Углекислый газ-0,03%. ...13 1-е начало термодинамики, теплоемкость, работа
Напомним: Функцией состояния. Так как все определяется изменением (производной) энергии, а энергия взаимодействия электронов внутренних оболочек с ...Второй закон Ньютона
Исаак Ньютон - выдающийся английский ученый, заложивший основы классической механики. Самым известным его открытием был закон всемирного тяготения. ...Импульс тела, закон сохранения импульса
Повторение изученного Тест №1 « Движение тела по окружности.». Вариант 1 1 б 2 Б 3 в 4 б 5 в. Вариант 2 1 б 2 б 3 В 4 в 5 б. Леонардо да Винчи. «Знание ...Второй закон Ньютона
Блиц-опрос. Что изучает динамика? Какое движение называется движением по инерции? Какую систему отсчета называют инерциальной? Сформулируйте первый ...Второй закон Ньютона
а1. чем больше масса, тем меньше ускорение. Второй закон Ньютона. Чему равно ускорение, с которым движется тело массой 3 кг, если на него действует ...Конспекты
Первый закон термодинамики
Урок по теме «Первый закон термодинамики». 10 класс. Цели урока:. . образовательные:. ввести первый закон термодинамики как закон сохранения ...Направление процессов в природе. Хаос и порядок.2 закон Термодинамики
План карта. . Урок физики в 10 классе. Тема урока: Направление процессов в природе. Хаос и порядок.2 закон Термодинамики. Тип урока:. формирование ...Относительность движения. Первый закон Ньютона
Кошикова Виктория Александровна. Учитель физики. МБОУ СОШ № 47 города Белгорода. «Относительность движения. Первый закон Ньютона». Цели урока:. ...Принципы относительности Галилея. Первый закон Ньютона
Автор:. Борисова Екатерина Сергеевна, преподаватель физики, информатики. Место работы:. ГООУ СПО «Мурманский строительный колледж им. Н.Е.Момота», ...Первый закон Ньютона. Инерциальные системы отсчёта
План урока №_______. Тема :. Первый закон Ньютона. Инерциальные системы отсчёта. Цели урока:. Сформировать понятие об инерциальной системе ...Исследование первого закона термодинамики к различным изопроцессам
Открытый урок по физике в 10 классе. Тема урока. «Исследование первого закона термодинамики к различным изопроцессам». Тип урока –. интегрированный, ...Законы термодинамики
Урок рок физики по теме " Законы термодинамики". . Познавательные цели и задачи урока. Повторить и закрепить понятия: внутренняя энергия, тепловое ...Инерциальные системы отсчёта. Первый закон Ньютона
Урок "Инерциальные системы отсчёта. Первый закон Ньютона". Задачи:. Образовательные:. Сформулировать понятие об инерциальной системе отсчёта, ...Решение задач на закон Ома для участка цепи
ОТКРЫТЫЙ УРОК по физике. «Решение задач на закон Ома для участка цепи». Учитель: _______ Васильева Зоя Константиновна. Урок по теме. : Решение ...Решение задач на закон Кулона, расчет напряженности и принцип суперпозиции полей
Малогорская Юлия Викторовна. . МОУ «Средняя общеобразовательная школа с углубленным изучением отдельных предметов №52». . Учитель физики. . ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:4 марта 2019
Категория:Физика
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию