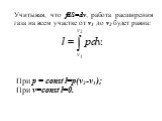Презентация "Применение первого закона термодинамики" по физике – проект, доклад
Презентацию на тему "Применение первого закона термодинамики" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 12 слайд(ов).
Слайды презентации
Список похожих презентаций
Применение первого закона термодинамики к изопроцессам
Внутренняя энергия газа зависит от температуры газа. Газ может совершать работу при любых происходящих с ним процессах. При изобарном расширении газ ...Применение первого закона термодинамики к различным процессам
Науки юношей питают, Отраду старым подают, В счастливой жизни украшают, В несчастный случай берегут…. М. В. Ломоносов. ∆U=A+Q. Изменение внутренней ...Применение второго закона Ньютона
Проверим домашнее задание. Вопросы: Что является причиной ускоренного движения тел? Приведите примеры из жизни, показывающие как взаимосвязаны сила, ...Применение закона равновесия рычага к блоку. «Золотое правило» механики
Блоки. Неподвижный блок ОА=ОВ=r. Подвижный блок. Комбинация блоков. Равенство работ при использовании рычага. При использовании рычага выигрыша в ...Первое применение начало термодинамики к экзопроцэссам
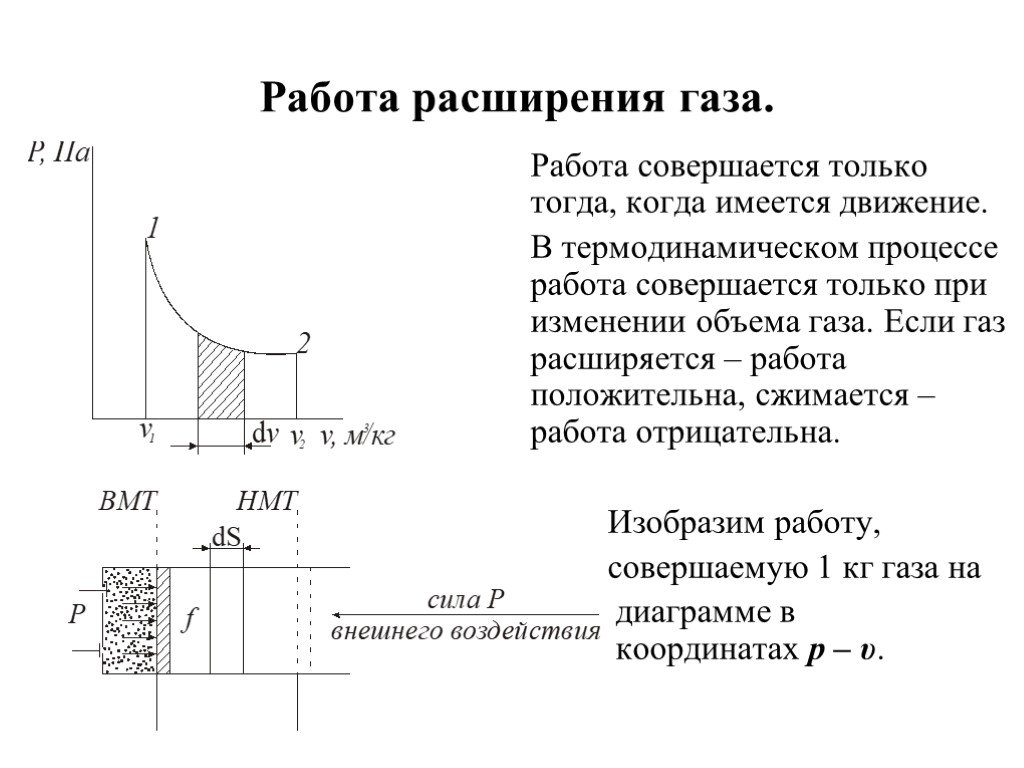
Изохорный процесс. Диаграмма этого процесса (изохора) в координатах изображается прямой, параллельной оси ординат (см. рис.), где процесс 2-1 есть ...Момент силы. Применение закона равновесия рычага к блоку
Подвесим на левую и правую части рычага грузы. Нарушится ли равновесие рычага? Запишем условие равновесия рычага, предварительно определив плечи сил. ...Применение закона рычага к блоку
Рычаг представляет собой твёрдое тело, которое может вращаться вокруг неподвижной опоры. Кратчайшее расстояние между точкой опоры и прямой, вдоль ...Применение закона Блеза Паскаля
Цель. Применение закона Блеза Паскаля. Задачи. Рассмотреть закон Блеза Паскаля Применение его в повседневной жизни Рассмотреть экологические подводные ...Применение ядерной энергии
Ядерный реактор. • это устройство, предназначенное для осуществления управляемой ядерной реакции. История. 1895 г. В.К.Рентген открывает ионизирующее ...Применение фотоэффектов
Фотоэффект. Уравнение Эйнштейна для фотоэффекта. Применение. Вакуумные фотоэлементы. Полупроводниковые фотоэлементы. Вентильные фотоэлементы. В вентильных ...Применение тепловых двигателей
A. ТЕПЛОВЫЕ ДВИГАТЕЛИ - это устройства, которые преобразуют внутреннюю энергию в механическую работу. ХОЛОДИЛЬНИК НАГРЕВАТЕЛЬ РАБОЧЕЕ ТЕЛО Q 1 T1 ...Применение радиоактивных изотопов
- в биологии и медицине - в промышленности -в сельском хозяйстве - в архиологии. Изотопы в медицине и биологии. Таблица 1.Основные характеристики ...14 2-е начало термодинамики
Изменение внутренней энергии рабочего тела за цикл равно нулю потому, что тело возвращается в исходное состояние. Следовательно, вся полученная теплота ...Второй закон термодинамики
1. Два положения второго закона термодинамики. Различные формы передачи энергии неравноценны. Энергия теплового движения стремиться в большей степени, ...Второй закон термодинамики
Обратимый процесс. Это процесс, который может происходить как в прямом, так и в обратном направлении Обратимый процесс – это идеализация реального ...Лазеры. Применение лазеров в медицине
ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА:. Лазер как физический прибор. Лазер (оптический квантовый генератор) (аббревиатура слов английской фразы: Light Amplification ...Как научить ученика действовать ? Применение познавательных стратегий на уроках физики
Моя цель. Физика – наука о природе, имеющая свой специфический понятийный аппарат и методологию. И своей целью я поставила не столько усвоение учебной ...Из истории законов термодинамики
Каждый выдающийся исследователь вносит своё имя в историю науки не только собственными открытиями, но и теми открытиями, к которым он побуждает других. ...Законы термодинамики в геологических процессах
Внутренняя энергия. 1. Согласно первому закону термодинамики, все системы, находящиеся в одном и том же состоянии, имеют одну и ту же внутреннюю энергию, ...Законы термодинамики
НУЛЕВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. Нулевое начало термодинамики сформулированное всего около 50 лет назад , по существу представляет собой полученное «задним ...Конспекты
Исследование первого закона термодинамики к различным изопроцессам
Открытый урок по физике в 10 классе. Тема урока. «Исследование первого закона термодинамики к различным изопроцессам». Тип урока –. интегрированный, ...Фотоэффект. Применение фотоэффекта
Урок пресс-конференция. Тема урока:» «Фотоэффект. Применение фотоэффекта». Цели урока:. Обобщение изученного материала, выделение главного в ...Силы природы. Применение законов динамики
Конспект урока на тему «Силы природы. Применение законов динамики». Задания на 1 балл. 3.01. Какая сила сообщает ускорение свободного падения ...Применение элементов математического анализа при решении физических задач
КОМБИНИРОВАННЫЙ УРОК. . Аннотация. . Урок построен на основе принципа действенного подхода к обучению, принципа сотрудничества, принципа обоснованного ...Применение технологии интегрированного обучения на уроках физики
Применение технологии интегрированного обучения на уроках физики. В современной школе на первый план выходит умение учителя мотивировать ученика ...Применение сообщающихся сосудов
МБОУ «НИЖНЕ-ГАЛИНСКАЯ ОСНОВНАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА». ВЕРЕЩАГИНСКОГО РАЙОНА. ПЕРМСКОГО КРАЯ. Проектный урок на конкурс «Учитель ...Применение производной для решения задач ЕНТ по физике и математике
Тема урока: «. Применение производной для решения задач ЕНТ по физике и математике». Тип. : интегрированный урок физики и математики. Цели. :. ...Законы термодинамики
Урок рок физики по теме " Законы термодинамики". . Познавательные цели и задачи урока. Повторить и закрепить понятия: внутренняя энергия, тепловое ...Применение законов гидростатики и аэростатики в технике
Муниципальное казенное образовательное учреждение. «. СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №3. ». . РФ. . 646020. Омская область, Исилькульский район, ...Практическая работа. Задачи на использование закона Кулона
Урок по физике в 10 классе по теме ". Практическая работа. . . Задачи на использование закона Кулона". . Учитель: Умралина М.Д. Цели:. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:11 июня 2019
Категория:Физика
Содержит:12 слайд(ов)
Поделись с друзьями:
Скачать презентацию