Презентация "Ковалентная полярная и неполярная связь" по химии – проект, доклад
Презентацию на тему "Ковалентная полярная и неполярная связь" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 18 слайд(ов).
Слайды презентации
Список похожих презентаций
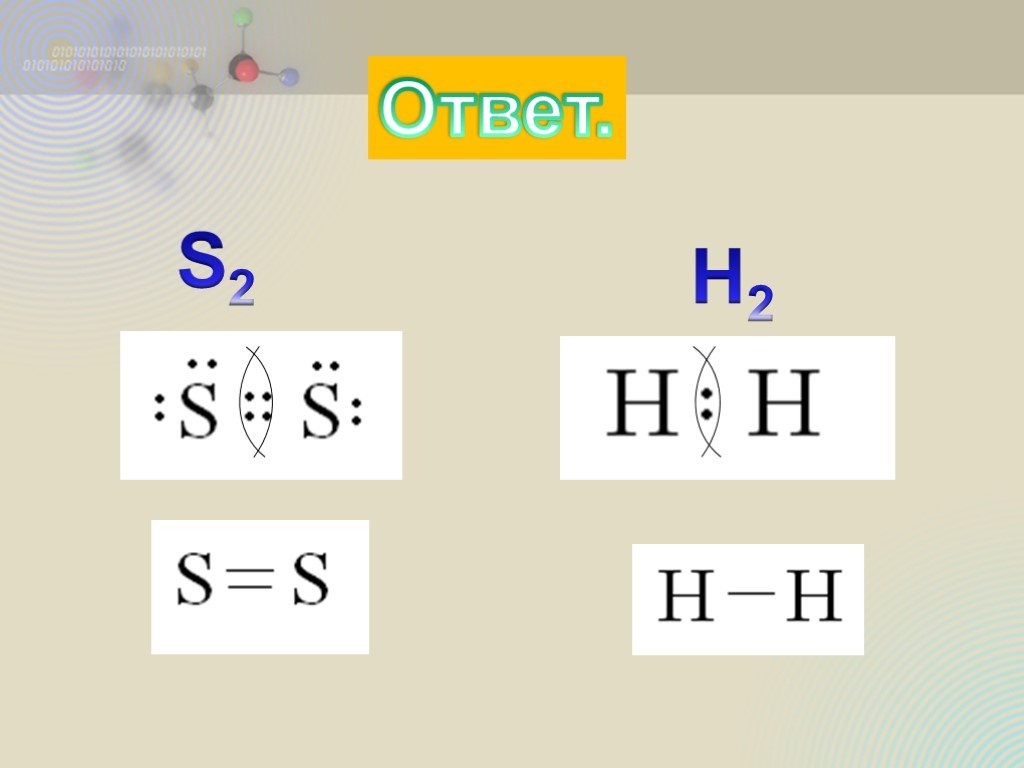
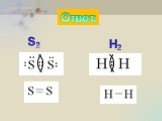
Ковалентная неполярная связь
. VIIIB He Гелий 2 4,0026 1 H Водород 1,00794 Li Литий 6,939 Be Бериллий 4 9,012 В Бор 5 10,811 С Углерод 6 12,011 N Азот 7 14,0067 О Кислород 8 15,9994 ...Ковалентная связь: полярная и неполярная
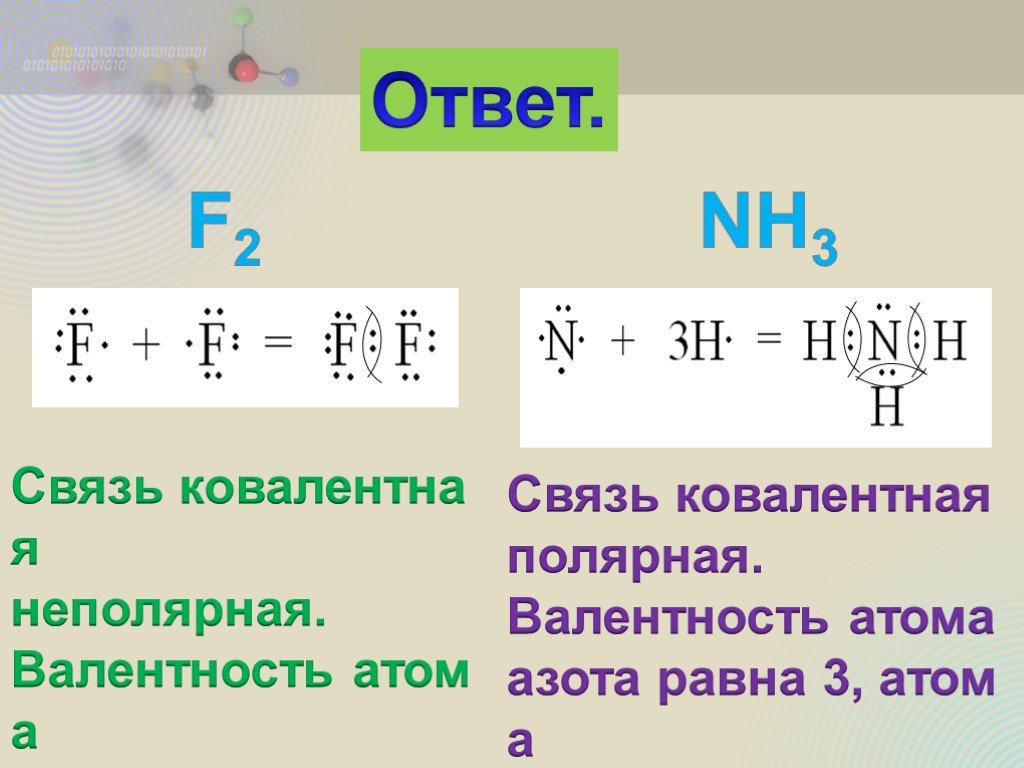
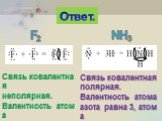
ОПРЕДЕЛЕНИЕ \ВЫУЧИТЬ\. КОВАЛЕНТНАЯ СВЯЗЬ-ЭТО ХИМИЧЕСКАЯ СВЯЗЬ МЕЖДУ АТОМАМИ,ОСУЩЕСТВЛЯЕМАЯ С ПОМОЩЬЮ ОБЩИХ ЭЛЕКТРОННЫХ ПАР. ОБРАЗОВАНИЕ КОВАЛЕНТНОЙ ...Ковалентная полярная связь
Мы условно разделили элементы на металлы и неметаллы. Рассмотрели, как образуются связи между атомами металлов и неметаллов (как называется такой ...Ковалентная полярная химическая связь
29/01/19. Тема: Ковалентная полярная химическая связь. I. Ковалентная связь. Химическая связь, возникающая в результате образования общих электронных ...Ковалентная химическая связь
Химический диктант.Валентность – это ……. Валентные электроны – это Высшая валентность по кислороду равна ……….. Низшая валентность по водороду равна ...
Ковалентная связь и ее принципы
Ковалентная связь. - это химическая связь, возникающая между атомами за счет образования общих электронных пар. Классификация КС. 1. По механизму ...Понятие о валентности и химической связи. Ковалентная химическая связь
Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы. Способность атома элемента образовывать ...Генетическая связь между неорганическими веществами
Что? Почему? Как? « - Поиграй со мной, - попросил Маленький принц. – Мне так грустно … - Не могу я с тобой играть, - сказал Лис. – Я не приручен. ...Химическая связь
Энергетическая диаграмма двух постепенно сближающихся атомов А + А = А2 + энергия выделяется!!! 1 – расстояние большое, энергия взаимодействия близка ...Химическая связь
Учащиеся должны знать: определение понятия химическая связь, виды химической связи, механизмы образования каждого вида связи. Учащиеся должны уметь: ...Строение атома, химическая связь
Цель урока:. Обобщить и систематизировать знания по теме «Строения атома, химическая связь». Задание № 1 Определите химический элемент по распределению ...Основные классы неорганических соединений. Генетическая связь между классами неорганических соединений
Девиз урока! Все знать, изведать, испытать! Путешествие на подводной лодке «Генезис". соляндия. основайские острова. кислотостан оксидония. Работа ...Металлическая химическая связь
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов ...Ионы. Ионная связь
Почему атомы соединяются друг с другом? +1. Что является результатом отдачи электронов? Положительный ион - катион. 1+ Н -1е = Н+. 1-. Что является ...Ионы и ионная химическая связь
Проверка знаний.Какие изменения происходят в строении внешней электронной оболочки элементов одного периода и одной группы? Как изменяется число ...
Ионная химическая связь
Цель урока. обобщить и систематизировать знания о видах химической связи и их классификации как о важнейшем универсальном понятии теоретической химии. ...Ионная химическая связь
Катионы – положительно заряженные ионы. Их образуют атомы, в которых мало валентных электронов и они слабо связаны с ядром. Это атомы щелочных и щелочноземельных ...Ионная связь как химическая связь
ХИМИЧЕСКАЯ СВЯЗЬ -. сила, связывающая атомы в молекулы или другие частицы. - совокупность электростатических сил притяжения, связывающих атомы друг ...Генетическая связь между неорганическими соединениями
Есть на свете наука, без которой сегодня невозможно воплотить в жизнь самые фантастические проекты и сказочные мечтания. это Х И М И Я. Задание 1. ...Металлическая связь
Металлы сокровища природы. Металлы золото, серебро, платина встречаются в самородном состоянии. Благодаря блеску, пластичности, твёрдости и редкости ...Конспекты
Ковалентная полярная химическая связь
Конспект урока химии. Тема 11:. . Ковалентная полярная химическая связь. . . Цель урока:. изучить механизм образования ковалентной неполярной ...Ковалентная полярная связь
. Муниципальное бюджетное общеобразовательное учреждение. . Журавенская средняя общеобразовательная школа. . Методическая разработка ...Ковалентная химическая связь
Г. Гуково Ростовской области. Конспект урока по химии. . 8 класс. Тема урока «Ковалентная химическая связь». Подготовила Берлизова Юлия ...Ковалентная связь
Методическая разработка. Ф.И.О. автор. . Шурыгина Валентина Сергеевна. Место работы. . МБСКОУ СКОШ № 34 VII. вида. г. Озерск, Челябинской ...Ковалентная химическая связь
Муниципальное Автономное Образовательное Учреждение. . Ветлужская Основная Общеобразовательная Школа. Конспект урока химии. ...Генетическая связь между классами неорганических соединений
Класс- 8. Тема :. « Генетическая связь между классами неорганических соединений». Цель:. . Образовательная:. Опираясь на знания учащихся ...Понятие о жесткости воды и способы их устранения. Биологическая роль кальция. Генетическая связь соединений кальция
УРОК. № 35. ТЕМА УРОКА:. Понятие о жесткости воды и способы их устранения. Биологическая роль кальция. . Генетическая связь соединений кальция. ...Положение металлов в периодической системе Д.И.Менделеева. Металлическая связь
План – конспект. урока химии в 9в классе. «Положение металлов в периодической системе Д.И.Менделеева. Металлическая связь». Учитель: Кубусиди ...Основные классы неорганических соединений. Генетическая связь классов неорганических соединений
Муниципальное бюджетное образовательное учреждение. «Жарынская средняя (полная) общеобразовательная школа». План-конспект открытого ...Генетическая связь неорганических соединений
Тема урока: Генетическая связь неорганических соединений. Цель урока: дать понятие о генетической связи неорганических соединений. Задачи урока:. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:12 декабря 2018
Категория:Химия
Содержит:18 слайд(ов)
Поделись с друзьями:
Скачать презентацию