Слайд 1Химия технеция
Ядерные свойства, получение Применение Химические свойства Технеций в растворах Аналитическая химия: методы очистки, выделения и идентификации
Слайд 230 изотопов А =85 – 118 Самый лёгкий из элементов, не имеющий стабильных изотопов. Впервые синтезирован физиком Эмилио Сегре и минерологом Карло Перье в 1937 в г. Палермо (Сицилия). 92,93Тс обнаружены в молибденовой детали циклотрона Е.Лоуренса (Беркли, Калифорнийский университет, США) Новый элемент – аналог рения, в качестве специфического носителя в опытах по химической идентификации технеция использовались соли рения (перренаты).
Ядерные свойства и получение
Слайд 3В 1939 О.Ган и Ф.Штрассман: в «осколках», образующихся при делении U-235 в ядерном реакторе, содержатся значительные количества долгоживущего изотопа 99Tc. В 1940 Э.Сегре и Ву Цзяньсюн: технеций в чистом виде. «Искусственный»: первый элемент, полученный искусственно. Э. Сегре и Г.Сиборг: из продуктов деления облучённого нейтронами урана короткоживущий изомер 99mТс.
Слайд 5Применение технеция
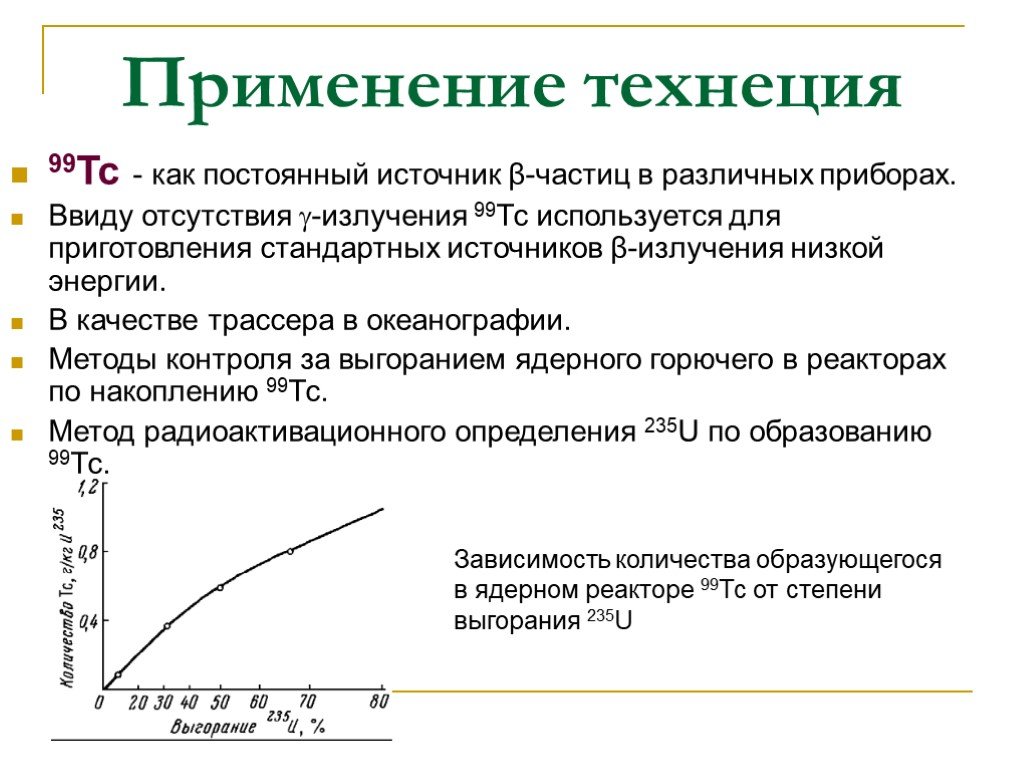
99Тс - как постоянный источник β-частиц в различных приборах. Ввиду отсутствия -излучения 99Тс используется для приготовления стандартных источников β-излучения низкой энергии. В качестве трассера в океанографии. Методы контроля за выгоранием ядерного горючего в реакторах по накоплению 99Тс. Метод радиоактивационного определения 235U по образованию 99Тс.
Зависимость количества образующегося в ядерном реакторе 99Тс от степени выгорания 235U
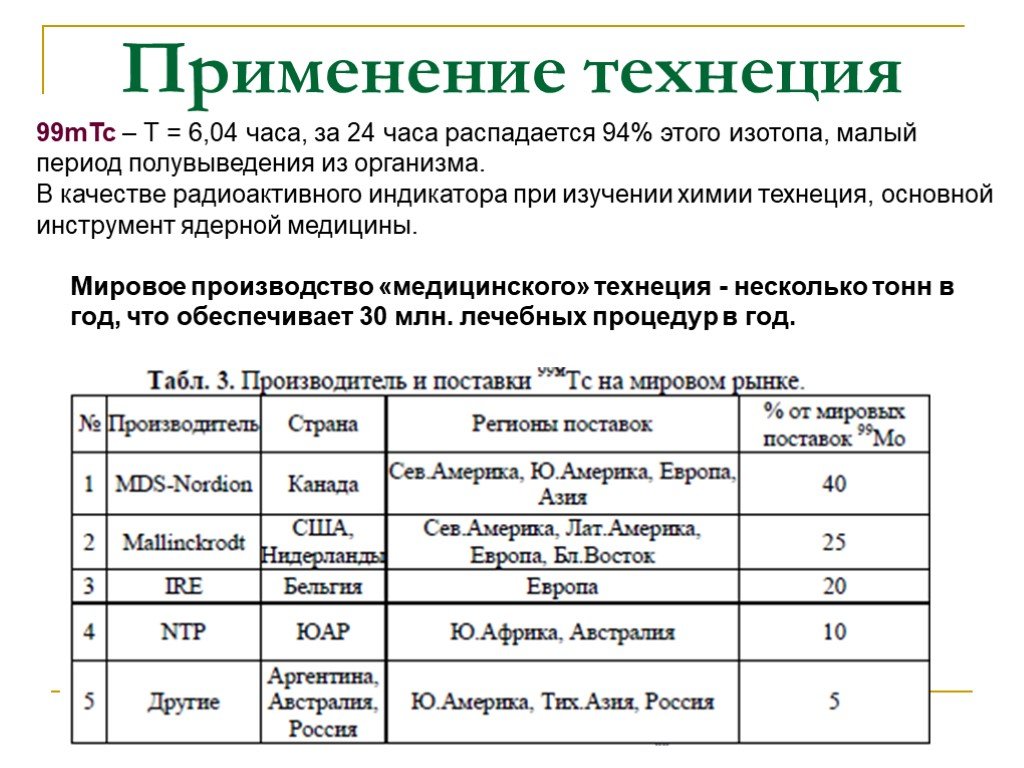
Слайд 6Мировое производство «медицинского» технеция - несколько тонн в год, что обеспечивает 30 млн. лечебных процедур в год.
99mТс – Т = 6,04 часа, за 24 часа распадается 94% этого изотопа, малый период полувыведения из организма. В качестве радиоактивного индикатора при изучении химии технеция, основной инструмент ядерной медицины.
Слайд 7Короткоживущие изотопы технеция 95Tc (T=20 ч), 95mTc (T=61 сут), 96Tc (T=4.28 сут) - в качестве радиоактивных меток при анализе технеция в природных пробах, для исследования химических свойств технеция. 94m Tc - для позитронно-эмиссионной томографии, поскольку при распаде испускает позитроны с высоким выходом.
Слайд 8Высокая ингибирующая способность пертехнетат-иона (аналогично MO4-, где М = Cr, Мо, W) Наиболее эффективный ингибитор коррозии углеродистой и нержавеющей стали. ТcО4- - более радиационно-стойкий, чем СrО42- и WO42-. Тс в качестве ингибитора коррозии в ядерных реакторах с водяным охлаждением. Покрытия из технеция для защиты подводных частей морских судов от воздействия микроорганизмов. Краски с примесью технеция препятствуют обрастанию днищ кораблей ракушками.

Слайд 9Сверхпроводимость технеция: переход в сверхпроводящее состояние начинается при 11.2 К и заканчивается при 7.7 - 7.8 К. Технеций - второй (после ниобия с Тс = 9.25К) среди всех сверхпроводящих элементов. Единственный представитель сверхпроводников II рода с гексагональной сингонией. Области применения: замена сверхчистого ниобия в инерциальных системах наведения в ракетной технике, в качестве конструкционного материала для сверхпроводящих магнитов, элемента памяти в компьютерах, в установках по термоядерному синтезу для получения магнитного поля высокой напряженности.
Слайд 10VII группа периодической системы, аналог Mn и Re. По физическим и химическим свойствам ближе к Re (следствие лантанидного сжатия). Строение электронной оболочки 4s24p64d65s1 или 4s2p64d55s2 сверх структуры криптона Тяжёлый (плотность 11,5 г/см3), тугоплавкий (Тпл = 2140°С), химически стойкий металл.
Металл
Кристаллическая решетка гексагональная плотноупакованная
Слайд 11Восстановлением Н2 сульфида Tc2S7 при 1100 оС или пертехната аммония NH4TcO4 при 500-600 оС.
Не растворяется в НCl, H2SO4 разб.
Растворяется в бромной воде и перекиси водорода.
При нормальных условиях с водой не реагирует. При температуре 400 оС взаимодействует с фтором и хлором с образованием гексафторида, гексахлорида и тетрахлорида технеция. При 700-1100 оС реагирует с С с образованием ТсС.

Слайд 12Соединения технеция различной валентности
Технеций (I): комплексные соединения. Технеций (II) существует только в составе комплексов, в которых низшая степень окисления стабилизирована -связыванием между атомом металла и лигандом. Химия технеция(III) представлена в основном галогенидами и комплексными соединениями. Многие комплексы Тс(III) легко окисляются до высших степеней окисления. Технеций со степенью окисления +4, соответствующей электронной конфигурации 4d3, устойчив. Для химии технеция(IV) практически не характерно наличие катионных форм, поэтому простые соли неизвестны. Для технеция (V) известны фториды, галогениды и двойные фториды. Tc(VI): наиболее устойчивы фториды и хлориды, оксофториды. Технеций в степени окисления +7 проявляет координационное число 4, образуя тетраэдр ТсО4-.
![Гидрид. Восстановлением КТсО4 раствором калия в этилендиамине. Состав [ТсН4.хН2О] Отрицательно заряженный ион гидрида [TcH9]2−, состоящий из тригональных призм с атомом технеция в центре и шестью атомами водорода по углам. TcO4-+17C2H5OH+18K→[TcH9]2- + 17C2H5OK + K+ + 4H2O Гидрид. Восстановлением КТсО4 раствором калия в этилендиамине. Состав [ТсН4.хН2О] Отрицательно заряженный ион гидрида [TcH9]2−, состоящий из тригональных призм с атомом технеция в центре и шестью атомами водорода по углам. TcO4-+17C2H5OH+18K→[TcH9]2- + 17C2H5OK + K+ + 4H2O](https://prezentacii.org/upload/cloud/18/12/82546/images/thumbs/screen13.jpg)
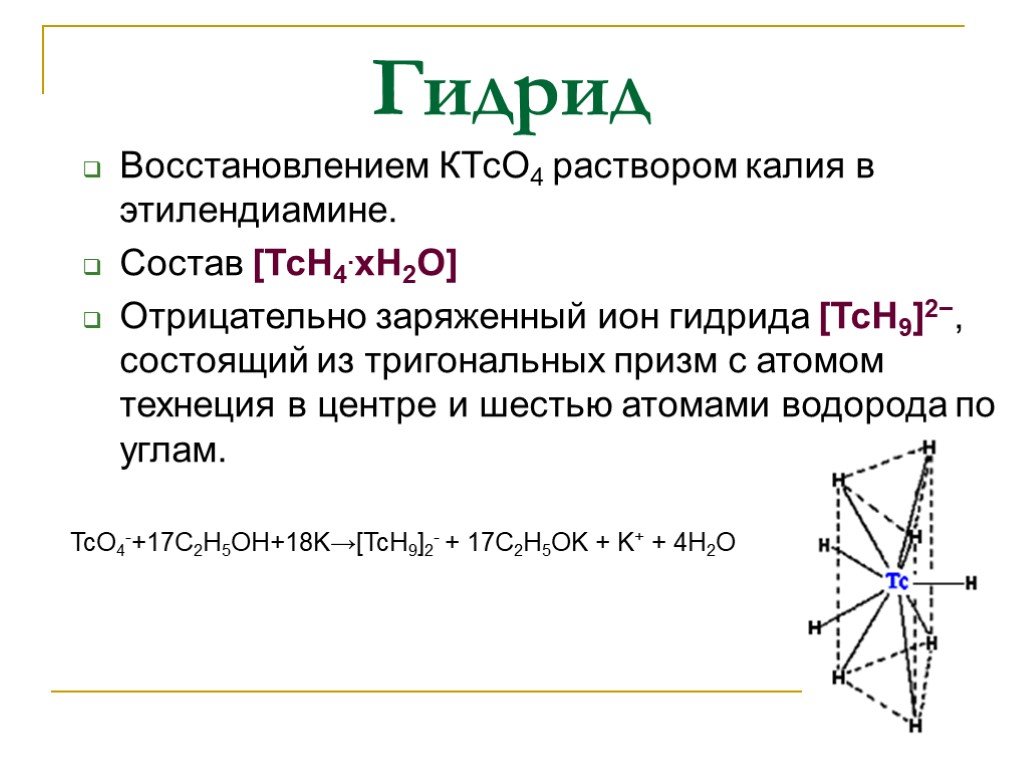
Слайд 13Гидрид
Восстановлением КТсО4 раствором калия в этилендиамине. Состав [ТсН4.хН2О] Отрицательно заряженный ион гидрида [TcH9]2−, состоящий из тригональных призм с атомом технеция в центре и шестью атомами водорода по углам.
TcO4-+17C2H5OH+18K→[TcH9]2- + 17C2H5OK + K+ + 4H2O
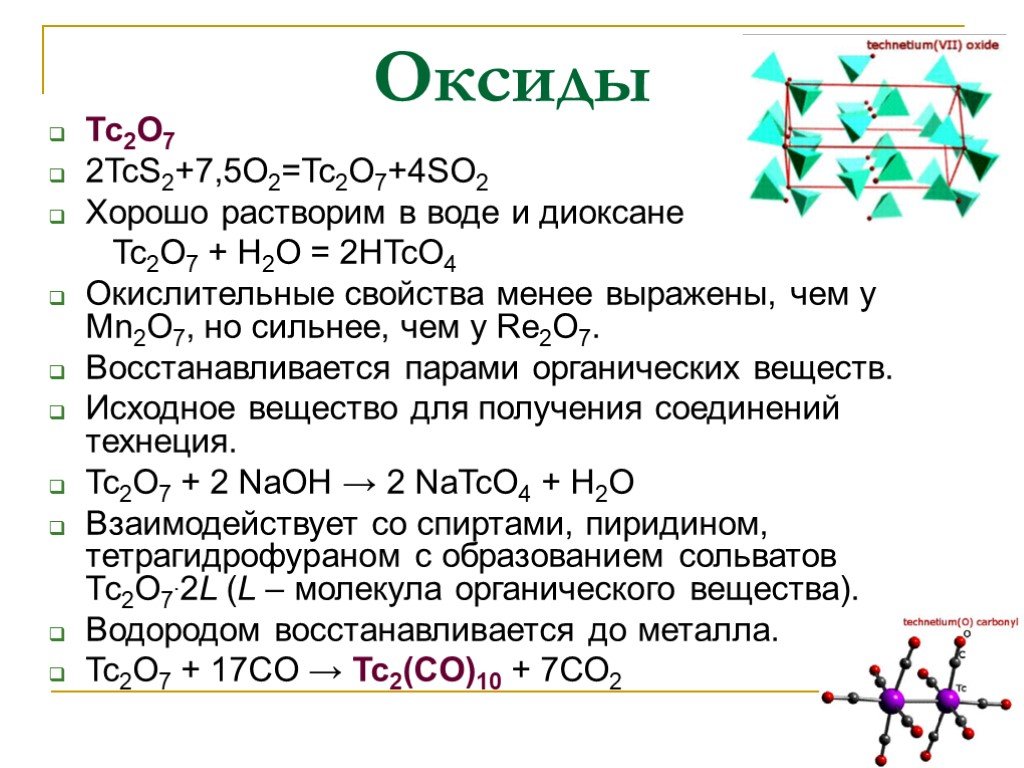
Слайд 14Оксиды
Тс2О7 2TcS2+7,5O2=Tc2O7+4SO2 Хорошо растворим в воде и диоксане Tc2O7 + H2O = 2HTcO4 Окислительные свойства менее выражены, чем у Mn2O7, но сильнее, чем у Re2O7. Восстанавливается парами органических веществ. Исходное вещество для получения соединений технеция. Tc2O7 + 2 NaOH → 2 NaTcO4 + H2O Взаимодействует со спиртами, пиридином, тетрагидрофураном с образованием сольватов Тс2О7.2L (L – молекула органического вещества). Водородом восстанавливается до металла. Tc2О7 + 17CO → Tc2(CO)10 + 7СО2

Слайд 15TcО2 Наиболее устойчивое соединение Tc(IV). Используется в технологической схеме получения технеция особой чистоты. NН4TcO4→TcО2 +2Н2О+ 1/2N2 Две формы - негидратированная (ТсО2) и гидратированная (ТсО2.nН2О, менее устойчива). В щелочных растворах ТсО2 растворяется с образованием иона Тс(ОН)62- (характерный оранжевый цвет). В отличие от MnO2 и ReO2 термически устойчив до 1100 оС и возгоняется в вакууме при температурах выше 900 оС; выше 1100 oС диспропорционирует на технеций и Тc2О7. Энергично реагирует с кислородом воздуха (с образованием Tc2O7), с фтором, хлором и бромом (с образованием оксогалогенидов). В нейтральных и щелочных растворах: 4ТcO2 + 3O2 + 2H2O = 4HTcO4
Слайд 16Сульфиды
TcS2, Tc2S7 2 HTcO4 + 7 H2S → Tc2S7 + 8 H2O 2NH4TcO4 + 8H2S = Tc2S7 + (NH4)2S + 8H2O Tc2S7 →2TcS2 + 3S Tc + 2S = TcS2 2TcS2 + 7,5 O2 = Tc2O7 + 4SO2 2Тс2S7 + 21O2 = 2Тс2О7 + 14SО2 Tc2S7 - промежуточное соединение при очистке технеция.
Слайд 17Соединения с галогенами
ТсXn TcF5, TcF6, TcCl4,TcCl6,,ТсBr4 Tc+3F2→TcF6 Tc + 3Cl2 = TcCl6 (темно-зеленый) Tc + 2Cl2 = TcCl4 (красно-коричневый) Оксогалогениды ТсО3F, ТсОF4, ТсО3Сl, ТсОВr3 Галогенотехнетаты NaTcF6, KTcF6, К2ТсСl6, К2ТсВr6, К2Тсl6, K2TcF6
Слайд 18Металлорганические соединения
Технетат тетраметиламмония [(CH3)4N]2TcO4 Гексафторофосфат дибензолтехнеция Tc(C6H6)2[PF6] Октахлордитехнетат(III) тетра-н-бутиламмония [н-(C4H9)4N]2 [Tc2Cl8] Бис-(дициклопентадиенил)технеций [Тс(С5Н5)2]2 Характерно образование карбонильных соединений.
Слайд 19Кластеры и кластерные соединения
Известно несколько кластеров технеция: Tc4, Tc6, Tc8 и Tc13
Кластеры технеция Tc6 и Тс8
Полиядерные призматические кластерные комплексы галогенидов [Me4]2Tc6Cl12
16 полиядерных кластеров: степени окисления Tc +1,5; +1,67; +1,83 и +2
Слайд 20Комплексные соединения
Гидридные Галогенидные: [ТсOX4]-, [ТсNX4]-, [ТсX6]2- (где X = Cl, Br, I) Диарсинаты технеция (II), (III) и (V) [TcR2Cl2]Cl (R—диарсин), [TcR2Br2]Br, [TcR2I2]I.I2 Цианидные: [Tc(CN)6]5-, [Tc(OH)3(CN)4]3- Карбонильные трикарбонильные комплексы технеция(I) [Tc(CO)3(H2O)3]+ пента-, тетра, трикарбонильные комплексы технеция [Tc(CO)5X] (Х = Cl, Br, I), [Tc(CO)4X]2, [Tc(CO)3X]4
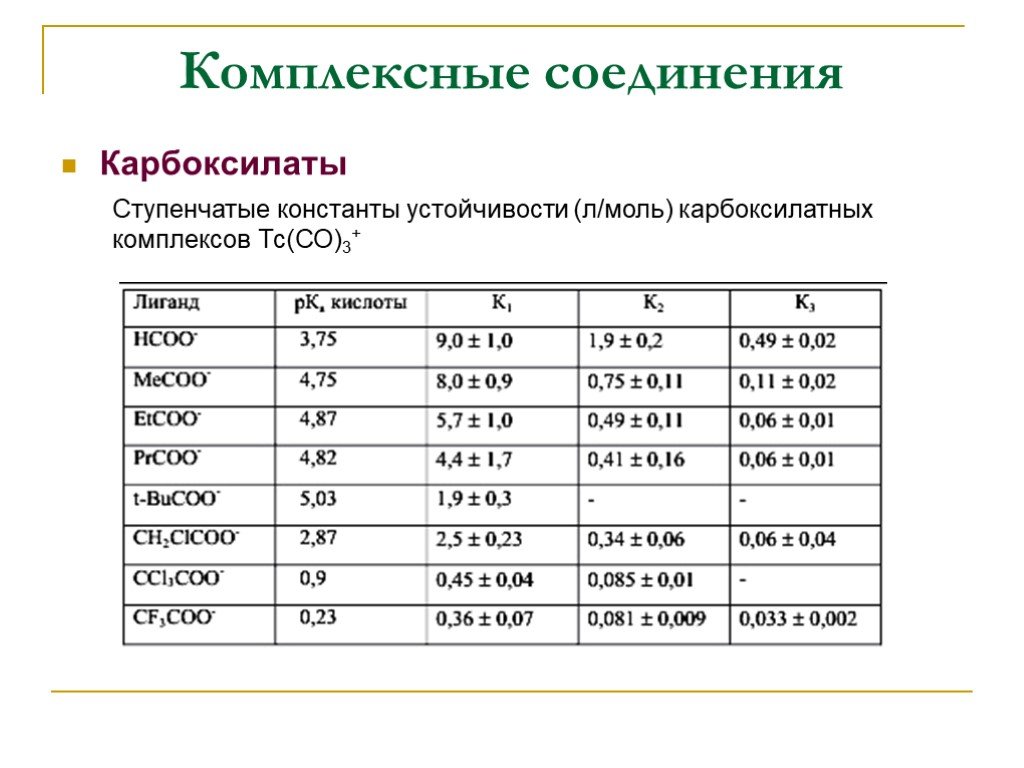
Слайд 21Карбоксилаты
Ступенчатые константы устойчивости (л/моль) карбоксилатных комплексов Тс(СО)3+
Слайд 22Технеций в растворах
Слайд 23Устойчивость в растворах HNO3: Tc(VII) > Tc(IV) > Tc(V) > Tc(VI) В кислых средах Tc(IV) устойчив только в присутствии комплексообразующих веществ ([TcCl6]2-). Тс (V, VI) склонен к диспропорционированию. На практике имеют значение только соединения Tc(VII) и Тc (IV): техногенные отходы химических производств, объекты окружающей среды.
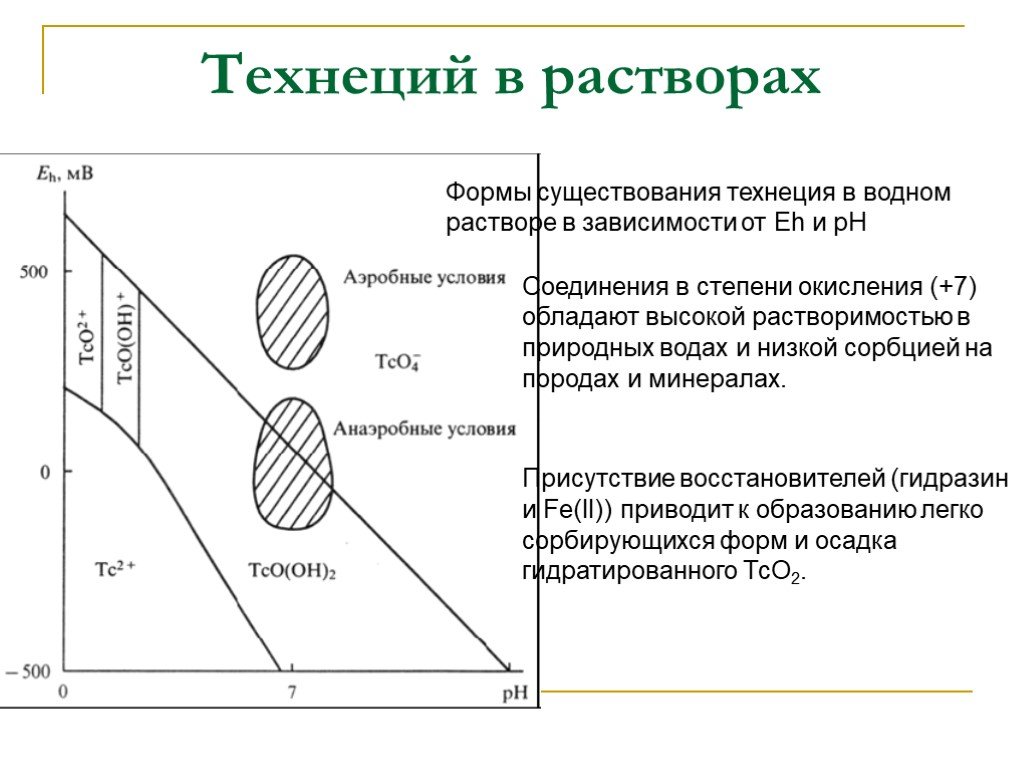
Слайд 24Формы существования технеция в водном растворе в зависимости от Eh и рН
Соединения в степени окисления (+7) обладают высокой растворимостью в природных водах и низкой сорбцией на породах и минералах.
Присутствие восстановителей (гидразин и Fe(II)) приводит к образованию легко сорбирующихся форм и осадка гидратированного ТсО2.
Слайд 25Технеций в окружающей среде
Ядерные испытания (1945-94 гг. 160 ТБк (250 кг) 99Тс). АЭС (ежегодно 6 т) Атмосферные выпадения после Чернобыльской катастрофы (0,75 ТБк) Выбросы заводов по переработки ЯТ Ядерная медицина

Слайд 26Основными поставщиками технеция в окружающую среду в настоящее время являются 3 завода по переработке ОЯТ: Селлафилд в Англии, Ля Аг (La Hague) во Франции, «Маяк» в России. Перерабатывающий ОЯТ завод «Селлафилд» расположен на северо-западном побережье Англии (Ирландское море). 2 установки по переработке и очистное сооружение для высокоактивных жидких отходов. Размещаются остановленные реакторы и установки, проходящие процесс утилизации. Радиоактивные выбросы, распространение которых прослеживается от северной части Ирландского моря к побережью Норвегии и к Баренцеву морю, вплоть до Шпицбергена. В результате проводимых Селлафилдом сливов Ирландское море считается самой радиоактивной зоной в мире. В период 1995-99 общий сброс составил 550 ТБк, после 2000 завод сбрасывал 90 Бк в год. Водоросли и некоторые рыбы накопили заметное количество технеция. В европейском лобстере (омаре) содержится 1 Бк/кг технеция.

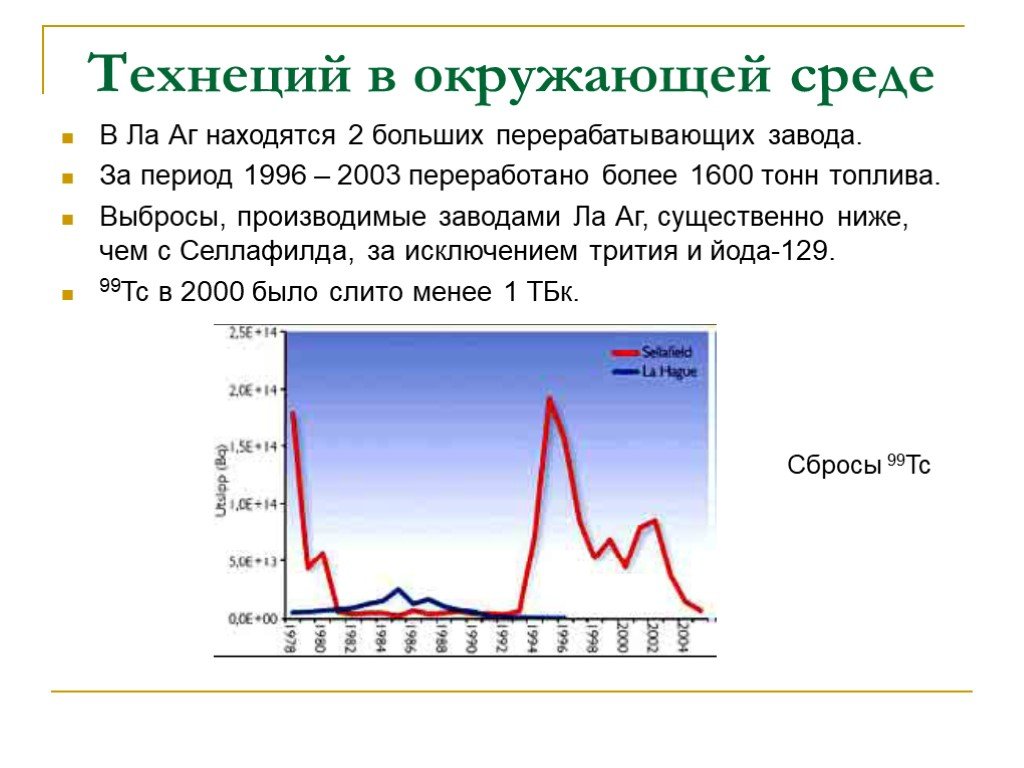
Слайд 27В Ла Аг находятся 2 больших перерабатывающих завода. За период 1996 – 2003 переработано более 1600 тонн топлива. Выбросы, производимые заводами Ла Аг, существенно ниже, чем с Селлафилда, за исключением трития и йода-129. 99Тс в 2000 было слито менее 1 ТБк.
Сбросы 99Tc
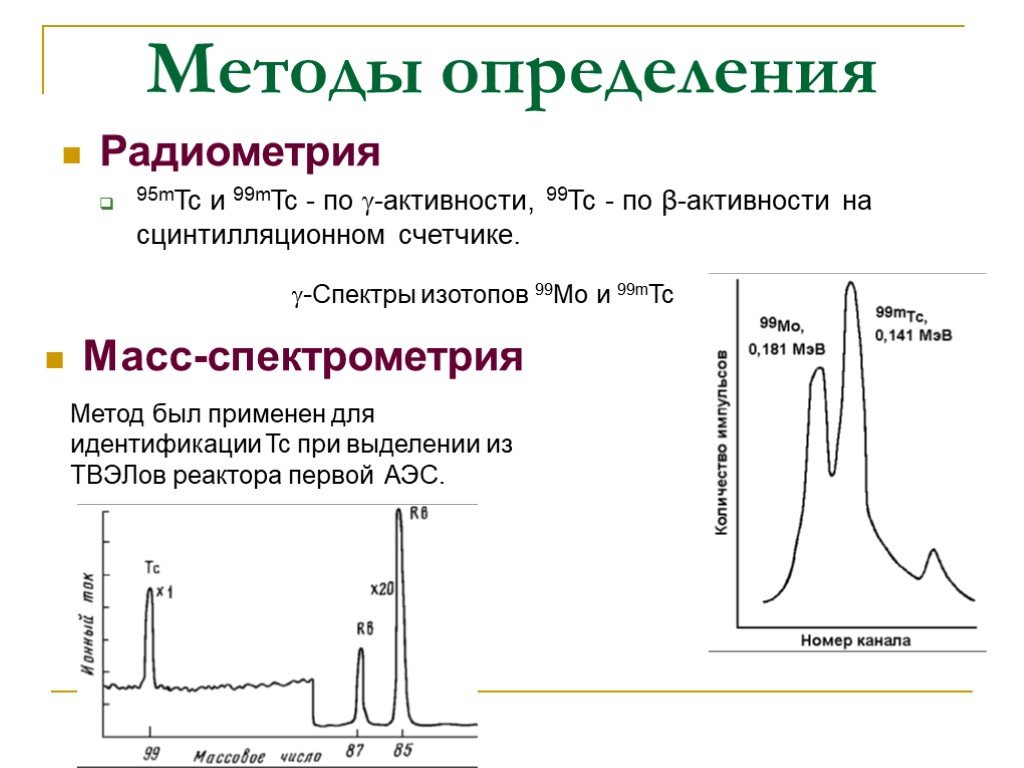
Слайд 28Методы определения
Масс-спектрометрия
Радиометрия 95mTc и 99mTc - по -активности, 99Тс - по β-активности на сцинтилляционном счетчике.
-Спектры изотопов 99Мо и 99mTc
Метод был применен для идентификации Tc при выделении из ТВЭЛов реактора первой АЭС.
Слайд 29Нейтронно-активационный метод Самый чувствительный метод определения следовых количеств Облучение образца медленными нейтронами: 99Тс(n,)100Тс (Т= 15,8 сек). C вероятностью 94% 100Тс распадается с испусканием 3,38 МэВ β-частиц на стабильный 100Ru. Низкофоновый счётчик. Предел определения 5х10-12 г 99Тс. Недостаток метода: малый период полураспада 100Тс. Ядерная реакция на быстрых нейтронах 99Тс(n,n’)99mTc. Иногда используется фотоядерная реакция 99Тс(,’)99mTc. Предел обнаружения 10-9 г.

Слайд 30Эффективность выделения технеция: экстракционные>ионообменные>осадительные>дистилляционные>электрохимические Экстракционные методы основаны на экстракции технеция в форме ТсО4- органическими растворителями: кетонами, аминами, фосфорорганическими экстрагентами из кислых и щелочных сред. При понижении валентности уменьшается коэффициент распределения. Экстракционное отделение технеция от рения основано на более легком восстановлении пертехната по сравнению с перренатом: из солянокислых сред метилэтилкетоном или четвертичными аммониевыми и арсониевыми основаниями. Из смеси продуктов деления урана выделяют Tc(VII) из кислой среды трибутилфосфатом в хлороформе.
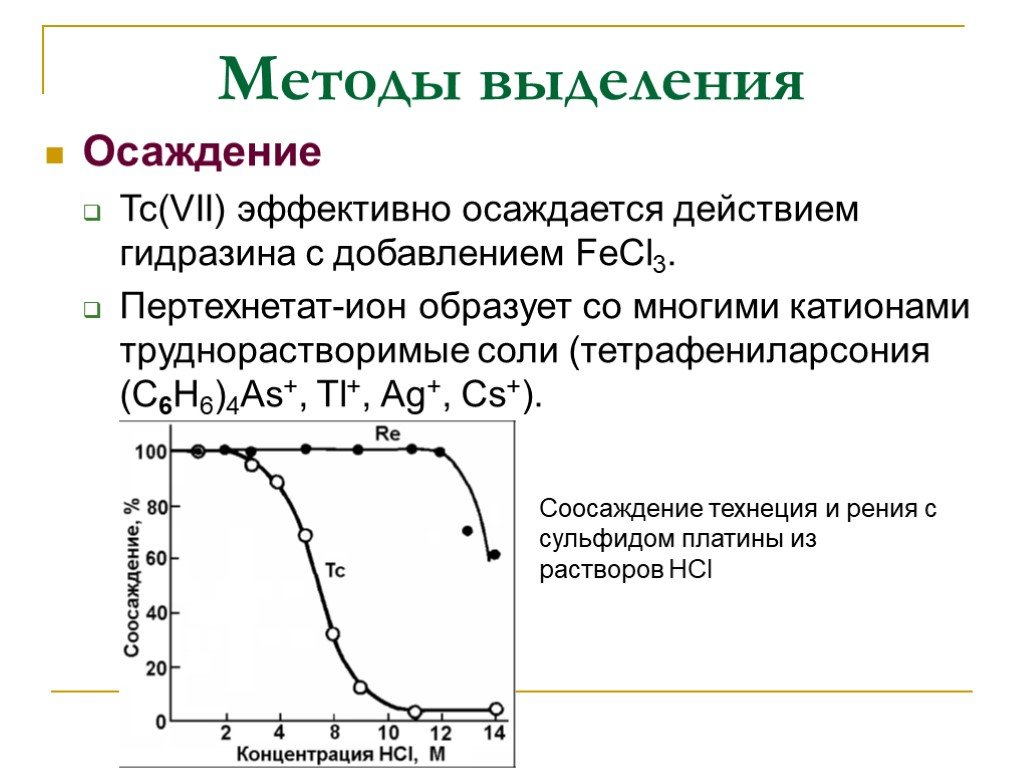
Методы выделения
Слайд 31Хроматография Пертехнетат-ион отличается от многих других анионов чрезвычайно высокой сорбцией на сильноосновных анионитах. Поглощение из растворов различных кислот проходит неодинаково и увеличивается: НСlO4
Слайд 32Осаждение Tc(VII) эффективно осаждается действием гидразина с добавлением FeCl3. Пертехнетат-ион образует со многими катионами труднорастворимые соли (тетрафениларсония (C6H6)4As+, Тl+, Ag+, Cs+).
Соосаждение технеция и рения с сульфидом платины из растворов НСl
Слайд 33Дистилляция Летучесть соединений технеция Вследствие большой упругости паров Тс2O7 и НТсO4 технеций дистиллируется в форме высшего оксида и технециевой кислоты. По степени дистилляции технеция с кислотами выделяют 3 группы: 1) кислоты типа НСlО4 (дистилляция происходит количественно, до 75% технеция дистиллируется с первыми 20% дистиллята); 2) кислоты HNО3, царская водка, H2SО4 и дымящая H2SO4 (дистилляция технеция протекает неполно); 3) кислоты НСl, НВr и HI (технеций не дистиллируется, так как эти кислоты восстанавливают технеций (VII) до более низких валентных состояний с образованием нелетучих комплексных соединений).
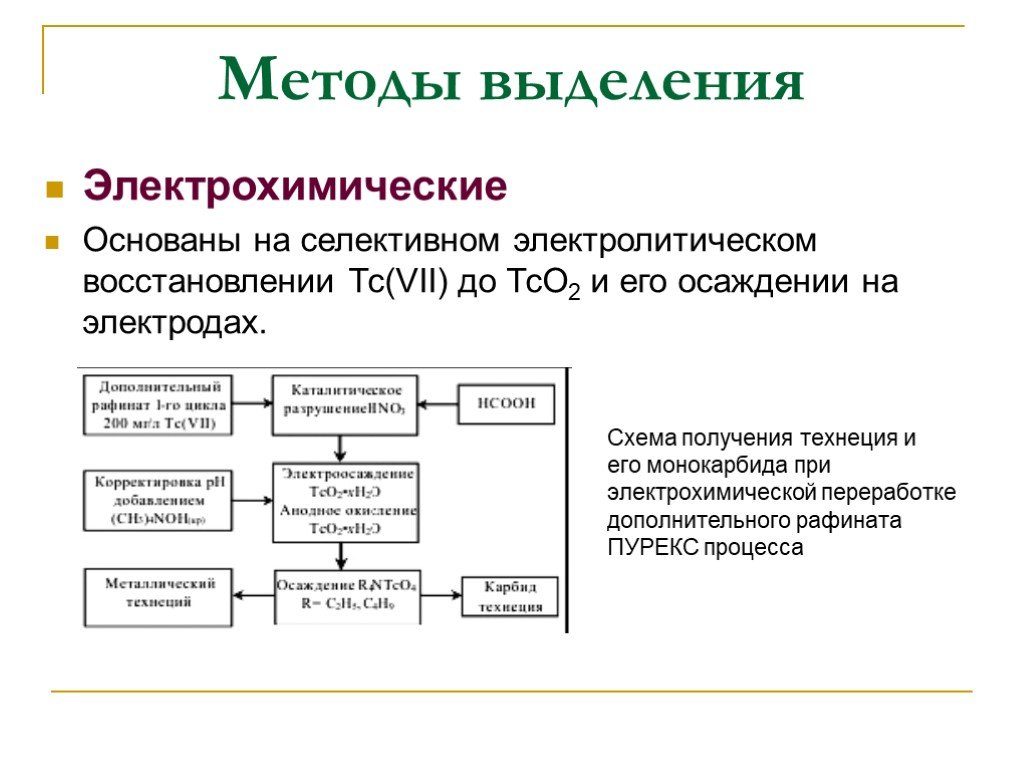
Слайд 34Электрохимические Основаны на селективном электролитическом восстановлении Тс(VII) до ТсО2 и его осаждении на электродах.
Схема получения технеция и его монокарбида при электрохимической переработке дополнительного рафината ПУРЕКС процесса
Слайд 35Отверждение технеция
Основные процессы на перерабатывающих заводах приводят к образованию катионов (137Cs или 90Sr). При этом пертехнетат-анион проскакивает через все стадии переработки и оказывается в сточных водах. Одним из возможных методов изоляции технеция является его цементирование с образованием матриц, устойчивых при хранении. При цементировании содержащих технеций ВАО необходимо перевести его в нерастворимую в воде форму (ТсО2). В качестве восстанавливающего агента используют шлак или добавки FeS и Na2S. Tc(VII) до Tc(IV) восстанавливается не полностью, что делает процесс недостаточно эффективным.

Слайд 36Насыщение силикагеля технецием при упаривании раствора технеция в присутствии добавок, способствующих сорбции технеция (комплексообразователей). Обработка силикагеля, насыщенного технецием, восстановительным раствором, сушка и прокалка для перевода технеция в малорастворимый диоксид. Технеций в матрице неорганического сорбента - непылящая форма, высокое насыщение по поглощаемому элементу, химическая стойкость.
Слайд 37ТРАНСАКТИНОИДНЫЕ ЭЛЕМЕНТЫ
104 Rutherfordium, Rf 5f14 6d27s2 (Hf) 105 Dubnium, Db 5f14 6d37s2 (Ta) 106 Seaborgium, Sg 107 Bohrium, Bh 108 Hassium, Hs 109 Meitnerium, Mt 110 Darmstadtium, Ds 111 Roentgenium, Rg 112 Copernicium, Cn 5f14 6d107s2 (Hg) 113 Ununtrium, Uut* 5f14 6d107s27p1 (Tl) 114 Ununquadium, Uuq 115 Ununpentium, Uup* 116 Ununhexium, Uuh 117 Ununseptium, Uus* 118 Ununoctium, Uuo* 5f14 6d107s27p6 (Rn)
Характеризуются заполнением электронами 6d- и 7s-уровней.
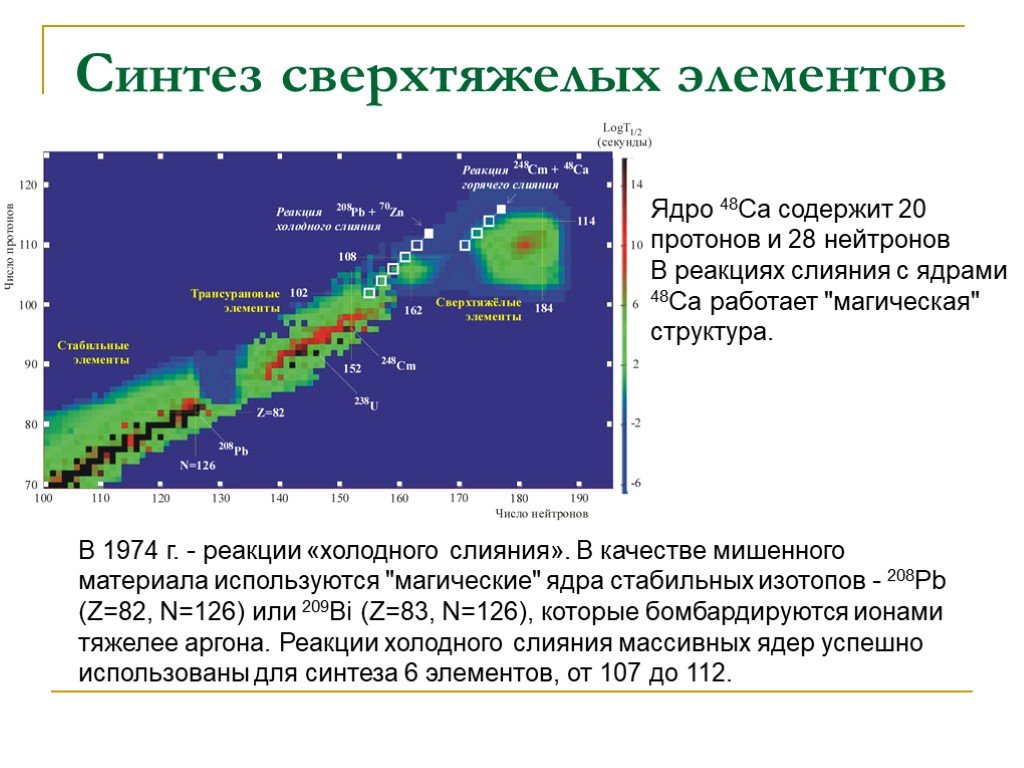
Слайд 38Синтез сверхтяжелых элементов
Эксперименты по синтезу ведутся с конца 60-ых годов. Традиционный метод, основанный на слиянии тяжелых ядер с образованием составного ядра. Мишень – Pu, Am, Cm, Bk, Cf Бомбардирующая частица – 45Ca, 66Zn и др. Недостаток метода: образование неустойчивых изотопов с большим дефицитом нейтронов. Могут быть получены ядра с магическим числом нейтронов (184).
Слайд 39В 1974 г. - реакции «холодного слияния». В качестве мишенного материала используются "магические" ядра стабильных изотопов - 208Рb (Z=82, N=126) или 209Bi (Z=83, N=126), которые бомбардируются ионами тяжелее аргона. Реакции холодного слияния массивных ядер успешно использованы для синтеза 6 элементов, от 107 до 112.
Ядро 48Са содержит 20 протонов и 28 нейтронов В реакциях слияния с ядрами 48Са работает "магическая" структура.
Слайд 40Второе направление – образование ядер в качестве осколков при мгновенном делении гигантских составных ядер 238U + 238U, 238U + 136Хe Осколки деления обычно имеют большой избыток нейтронов и могут включать ядра с Z=110-114 и N=184. Детектирование сверхтяжелых элементов осуществляется как по осколкам спонтанного деления, так и путем непосредственной регистрации в зависимости от типа распада.
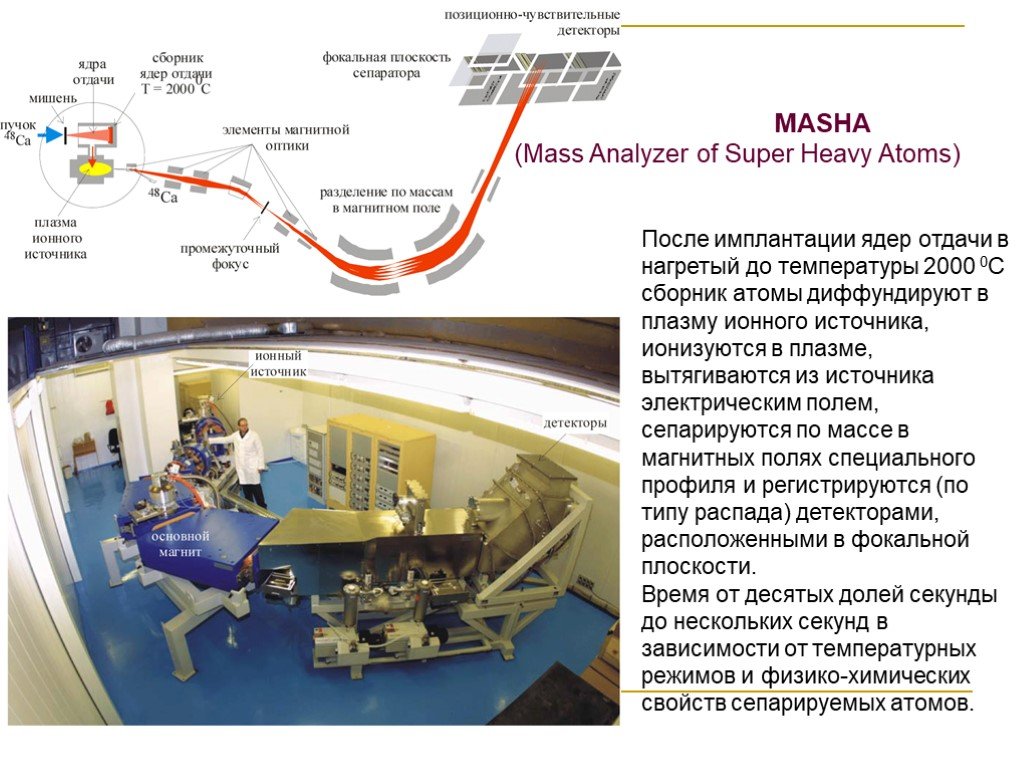
Слайд 41MASHA (Маss Analyzer of Super Heavy Atoms)
После имплантации ядер отдачи в нагретый до температуры 2000 0С сборник атомы диффундируют в плазму ионного источника, ионизуются в плазме, вытягиваются из источника электрическим полем, сепарируются по массе в магнитных полях специального профиля и регистрируются (по типу распада) детекторами, расположенными в фокальной плоскости. Время от десятых долей секунды до нескольких секунд в зависимости от температурных режимов и физико-химических свойств сепарируемых атомов.

Слайд 42Сверхтяжелые элементы - в природе?
Поиск сверхтяжелых элементов в природе и космосе. Объект исследования – океанические донные отложения, подземные воды, метеориты. В космосе – исследование тяжелой компоненты первичного космического излучения. Среди возможных кандидатов - изотопы 108-го элемента (Нs), ядра которых содержат около 180 нейтронов. Химические опыты, проведенные с короткоживущим изотопом 269Нs (Т1/2 ~ 9 с): 108 элемент - химический гомолог 76 элемента - (Оs). Образец металлического осмия может содержать в очень малых количествах 108 элемент. Возможно, сверхтяжёлый «долгожитель» будет испытывать спонтанное деление, либо спонтанное деление наступит после предшествующих альфа или бета - распадов более легкого и более короткоживущего дочернего ядра.

Слайд 43Сверхтяжелые элементы – в природе?
Распад сверхтяжёлого ядра будет регистрироваться по нейтронной вспышке, сопровождающей спонтанное деление. Защита установки от фона нейтронов, возникающего под действием космических лучей, измерения будут проводиться в подземной лаборатории на глубине, соответствующей 4000-метровому слою водного эквивалента. Если в течение года измерений будет хотя бы одно событие спонтанного деления, то это будет соответствовать концентрации 108 элемента в Оs-образце около 5×10-15 г/гр. в предположении, что его период полураспада равен 109лет.

Слайд 44Некоторые химические свойства
104 и 105: высокая летучесть хлоридов. Химия растворов Rf в сравнении с Zr, Hf, Th(IV), Pu(IV): Rf подобен 4 группе, отличия в комплексообразовании с различными лигандами. 105: сорбируется на стекле подобно Nb(V), Ta(V) в отличие от Zr, Hf и тривалентных актинидов: 5 группа. Экстракция метилизобутилкетоном в HNO3/HF: Та экстрагируется, Ha остается вместе с Nb. 106: вероятно, самый тяжелый элемент 6 группы, аналог вольфрама, летучие оксигалогениды (Sg02Cl2). Sg остается на катионнобменной смоле, а W элюируется 0.1 M HNO3. Sg в меньшей степени склонен к гидролизу в разбавленной HNO3,, чем W (или Mo) – образуют нейтральные формы MO2(OH)2.











































![Гидрид. Восстановлением КТсО4 раствором калия в этилендиамине. Состав [ТсН4.хН2О] Отрицательно заряженный ион гидрида [TcH9]2−, состоящий из тригональных призм с атомом технеция в центре и шестью атомами водорода по углам. TcO4-+17C2H5OH+18K→[TcH9]2- + 17C2H5OK + K+ + 4H2O Гидрид. Восстановлением КТсО4 раствором калия в этилендиамине. Состав [ТсН4.хН2О] Отрицательно заряженный ион гидрида [TcH9]2−, состоящий из тригональных призм с атомом технеция в центре и шестью атомами водорода по углам. TcO4-+17C2H5OH+18K→[TcH9]2- + 17C2H5OK + K+ + 4H2O](https://prezentacii.org/upload/cloud/18/12/82546/images/thumbs/screen13.jpg)




![Металлорганические соединения. Технетат тетраметиламмония [(CH3)4N]2TcO4 Гексафторофосфат дибензолтехнеция Tc(C6H6)2[PF6] Октахлордитехнетат(III) тетра-н-бутиламмония [н-(C4H9)4N]2 [Tc2Cl8] Бис-(дициклопентадиенил)технеций [Тс(С5Н5)2]2 Характерно образование карбонильных соединений. Металлорганические соединения. Технетат тетраметиламмония [(CH3)4N]2TcO4 Гексафторофосфат дибензолтехнеция Tc(C6H6)2[PF6] Октахлордитехнетат(III) тетра-н-бутиламмония [н-(C4H9)4N]2 [Tc2Cl8] Бис-(дициклопентадиенил)технеций [Тс(С5Н5)2]2 Характерно образование карбонильных соединений.](https://prezentacii.org/upload/cloud/18/12/82546/images/thumbs/screen18.jpg)
![Кластеры и кластерные соединения. Известно несколько кластеров технеция: Tc4, Tc6, Tc8 и Tc13. Кластеры технеция Tc6 и Тс8. Полиядерные призматические кластерные комплексы галогенидов [Me4]2Tc6Cl12. 16 полиядерных кластеров: степени окисления Tc +1,5; +1,67; +1,83 и +2 Кластеры и кластерные соединения. Известно несколько кластеров технеция: Tc4, Tc6, Tc8 и Tc13. Кластеры технеция Tc6 и Тс8. Полиядерные призматические кластерные комплексы галогенидов [Me4]2Tc6Cl12. 16 полиядерных кластеров: степени окисления Tc +1,5; +1,67; +1,83 и +2](https://prezentacii.org/upload/cloud/18/12/82546/images/thumbs/screen19.jpg)
![Комплексные соединения. Гидридные Галогенидные: [ТсOX4]-, [ТсNX4]-, [ТсX6]2- (где X = Cl, Br, I) Диарсинаты технеция (II), (III) и (V) [TcR2Cl2]Cl (R—диарсин), [TcR2Br2]Br, [TcR2I2]I.I2 Цианидные: [Tc(CN)6]5-, [Tc(OH)3(CN)4]3- Карбонильные трикарбонильные комплексы технеция(I) [Tc(CO)3(H2O)3]+ пента Комплексные соединения. Гидридные Галогенидные: [ТсOX4]-, [ТсNX4]-, [ТсX6]2- (где X = Cl, Br, I) Диарсинаты технеция (II), (III) и (V) [TcR2Cl2]Cl (R—диарсин), [TcR2Br2]Br, [TcR2I2]I.I2 Цианидные: [Tc(CN)6]5-, [Tc(OH)3(CN)4]3- Карбонильные трикарбонильные комплексы технеция(I) [Tc(CO)3(H2O)3]+ пента](https://prezentacii.org/upload/cloud/18/12/82546/images/thumbs/screen20.jpg)


![Устойчивость в растворах HNO3: Tc(VII) > Tc(IV) > Tc(V) > Tc(VI) В кислых средах Tc(IV) устойчив только в присутствии комплексообразующих веществ ([TcCl6]2-). Тс (V, VI) склонен к диспропорционированию. На практике имеют значение только соединения Tc(VII) и Тc (IV): техногенные отходы химич Устойчивость в растворах HNO3: Tc(VII) > Tc(IV) > Tc(V) > Tc(VI) В кислых средах Tc(IV) устойчив только в присутствии комплексообразующих веществ ([TcCl6]2-). Тс (V, VI) склонен к диспропорционированию. На практике имеют значение только соединения Tc(VII) и Тc (IV): техногенные отходы химич](https://prezentacii.org/upload/cloud/18/12/82546/images/thumbs/screen23.jpg)



















































