Презентация "Закон Авогадро" по химии – проект, доклад
Презентацию на тему "Закон Авогадро" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 12 слайд(ов).
Слайды презентации
Список похожих презентаций
Закон сохранения массы веществ
Цель урока:. Изучение закона сохранения массы вещества. Задачи:. Обучение учащихся составлению уравнений химических реакций. Усвоение учащимися закона ...Закон сохранения массы веществ. Уравнения химических реакций
Единственный путь, ведущий к знанию, - это деятельность. Цели урока: Обучающие - экспериментально доказать закон сохранения массы веществ. На основе ...Закон постоянства состава
Закон постоянства состава. Был открыт французским химиком Прустом: всякое чистое вещество (химическое соединение), каким бы путем оно ни было получено, ...Закон збереження маси
Закон збереження маси речовини. Відкритий М.В. Ломоносовим в 1748 році. До таких же висновків, вивчаючи процес горіння прийшов в 1772 році А. Лавуазьє. ...Вещества молекулярного строения. Закон постоянства состава
Цель урока:. Познакомить с веществами молекулярного строения,их свойствами. Сформулировать представления о молекулярной кристаллической решетке. План ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия
история развития органической химии предмет органической химии особенности органических веществ Бутлеров теория строения органических соединений Бутлерова ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Сложные эфиры химия
Цели урока:. 1.Изучить строение сложных эфиров. 2.Познакомиться с механизмом реакции этерификации. Номенклатура. Названия сложных эфиров происходит ...Аналитическая химия
Определение. Аналити́ческая хи́мия — раздел химии, изучающий химический состав и структуру веществ; имеет целью определение элементов или групп элементов, ...Аналитическая химия
План доклада. Аналитическая химия (определение) Гармонизация терминологии по аналитической химии Роль терминологии Источники терминологии Цели и задачи ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...алюминий химия
получение алюминия. Применение алюминия. ...«Электролитическая диссоциация» химия
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...«Окислительно-восстановительные реакции» химия
СОДЕРЖАНИЕ:. 1. Какие реакции называются окислительно-восстановительными? 2. Что называют окислителем, восстановителем? 3. Окислительно-восстановительный ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Конспекты
Химическая формула. Валентность. Закон постоянства состава вещества
8 класс. Тема урока:. Химическая формула. Валентность. Закон постоянства состава вещества. . Тематическое и поурочное планирование по биологии. ...Закон сохранения массы веществ
Муниципальное общеобразовательное учреждение. «Средняя общеобразовательная школа №13». Конспект урока по химии в 8 классе«Закон сохранения ...Сущность химических реакций. Закон сохранения атомов
Урок химии в 8 классе. . Учитель Димчикова Людмила Дымбрыловна. Тема урока: «Сущность химических реакций. Закон сохранения атомов». Новое содержание:. ...Закон Авагадро
Джоробекова Нургуль Дуйшенбековна . – . учитель химии I. категории СШ № 35 . . им. Рзы Қонақовой с. Ноғайбай Кордайского района, Жамбылской ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:12 декабря 2018
Категория:Химия
Содержит:12 слайд(ов)
Поделись с друзьями:
Скачать презентацию










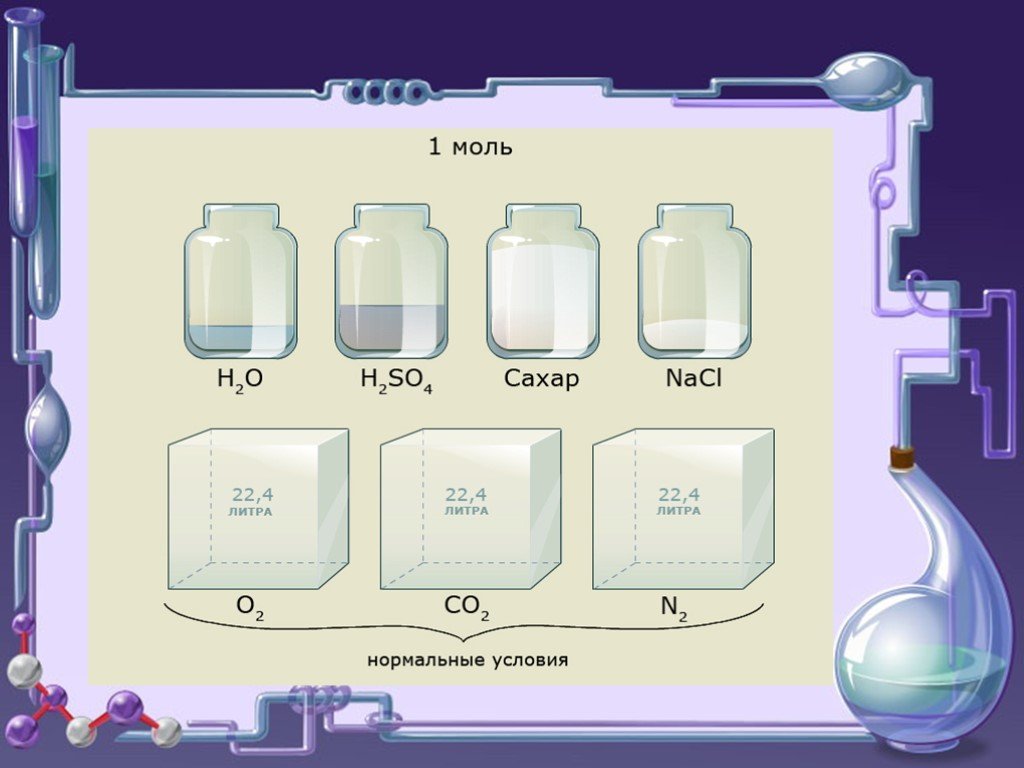





![Молярная масса. -это масса одного моля вещества. М=[г/моль] ( молярная масса численно равна молекулярной массе) , отсюда Молярная масса. -это масса одного моля вещества. М=[г/моль] ( молярная масса численно равна молекулярной массе) , отсюда](https://prezentacii.org/upload/cloud/18/12/82545/images/thumbs/screen4.jpg)