Презентация "d — элементы" по химии – проект, доклад
Презентацию на тему "d — элементы" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 37 слайд(ов).
Слайды презентации
Список похожих презентаций
Химические элементы космоса
Работу выполнили Ученики 8 «А» класса Никитин Андрей Афонин Николай Руководитель учитель химии Рябова О. Е. Меркурий. Ядро планеты – железное, ферромагнитное, ...Химические элементы металлы и здоровье человека
Ионы этого металла входят в состав вещества, употребляемого в пищу и называемого «белой смертью». Существенными источниками этого элемента являются ...Химические элементы в организме человека
Роль химических элементов в организме человека. «Надо учиться не для того, чтобы стать ученым, а только для того, чтобы научиться жить лучше» Л.Н.Толстой. ...Химические элементы и организм человека
Многие учёные считают, что в живом организме не только присутствуют все химические элементы, но каждый из них выполняет определённую биологическую ...Химические элементы в нашем организме
Из чего же мы состоим? Тело молекул атомов химических элементов. Сколько элементов в нашем организме? Для организма человека определенно установлена ...Химические элементы в организме человек
Введение. Многие учёные считают, что в живом организме не только присутствуют все химические элементы, но каждый из них выполняет определённую биологическую ...Химические элементы
Поначалу древние философы полагали, что все сущее состоит из четырех элементов – воды, земли, огня и воздуха. Впоследствии обнаружилось, что таких ...Химические элементы в клетках живых организмов
Цели урока:. 1)Познакомить учащихся с химическими элементами в клетках живых организмов; 2)рассмотреть значение химических элементов в клетках живых ...Организм человека и химические элементы
Организм человека – это сложная химическая система, которая не может функционировать самостоятельно, без взаимосвязи с окружающей средой. Современный ...Интерактивная игра "Химия в ребусах: Химические элементы"
НИКЕЛЬ. ИОД. АЗОТ. БОР. МАГНИЙ Й. МАРГАНЕЦ. КРЕМНИЙ Л=й. МЫШЬЯК. УГЛЕРОД О. ЦИРКОНИЙ. АРГОН. МЕДЬ ДВЕ. КРИПТОН. ЗОЛОТО. СЕРА П=А. ВОДОРОД А=О Т=Д. ...ВОДА — САМОЕ УДИВИТЕЛЬНОЕ ВЕЩЕСТВО
ВОДА – САМОЕ УДИВИТЕЛЬНОЕ ВЕЩЕСТВО. Вода и человек. Тема элективного курса. "Вода!.. Нельзя сказать, что ты необходима для жизни, ты - сама жизнь!" ...Химический элементы в нашей жизни
Какие вещества важны для жизнедеятельности человека? Минеральные вещества - химические элементы, необходимые организму человека или животного для ...Щелочные металлы - элементы I группы главной подгруппы
Li Na K Rb Cs Fr. Физические свойства щелочных металлов:. Серебристого цвета Мягкие, легко режутся ножом Твердость от Li → Na → K → Rb → Cs → Fr уменьшается: ..."Химические элементы и вещества"
Цель урока:. Повторить основные вопросы по изученному разделу “Вещества и химические явления”, закрепить полученные знания. Физические свойства веществ. ...Биогенные элементы
Дать понятие о биогенных элементах Дать характеристику биогенным элементам Показать роль их в жизни человека. Цель работы:. Работа с литературой. ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Конспекты
Химические элементы и здоровье человека
. Отдел образования администрации. . Тальменского района Алтайского края. Муниципальное общеобразовательное учреждение. Тальменская средняя ...Ценные элементы в нашей жизни
Обобщающий урок по теме: «Ценные элементы в нашей жизни». Цель урока: . Обобщить знания учащихся о физических и химических свойствах металлов, ...Химические элементы
Тема урока: «Химические элементы». Тип урока. :. урок проверки и оценки знаний. Цель урока:. проверить знание учащимися понятий «химический элемент», ...Медь и цинк – d- элементы
Медь и цинк – d- элементы. Цель. : обобщить и конкретизировать знания учащихся о строении металлов и зависимости строения и свойств. ...Кислород — химический элемент и простое вещество. Получение кислорода
Муниципальное общеобразовательное автономное учреждение. . «СОШ № 10». Урок по теме "Кислород — химический элемент и простое ...Глюкоза, сахароза — важнейшие представители углеводов. Крахмал и целлюлоза — природные полимеры
Дата_____________ Класс_______________. Тема:. . Глюкоза, сахароза — важнейшие представители углеводов. Крахмал и целлюлоза — природные полимеры. ...Белки — биополимеры
Дата_____________ Класс_______________. Тема:. . Белки — биополимеры. . Цели урока:. рассмотреть биополимеры - белки. Ход работы. 1. Организационный ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:25 августа 2018
Категория:Химия
Содержит:37 слайд(ов)
Поделись с друзьями:
Скачать презентацию



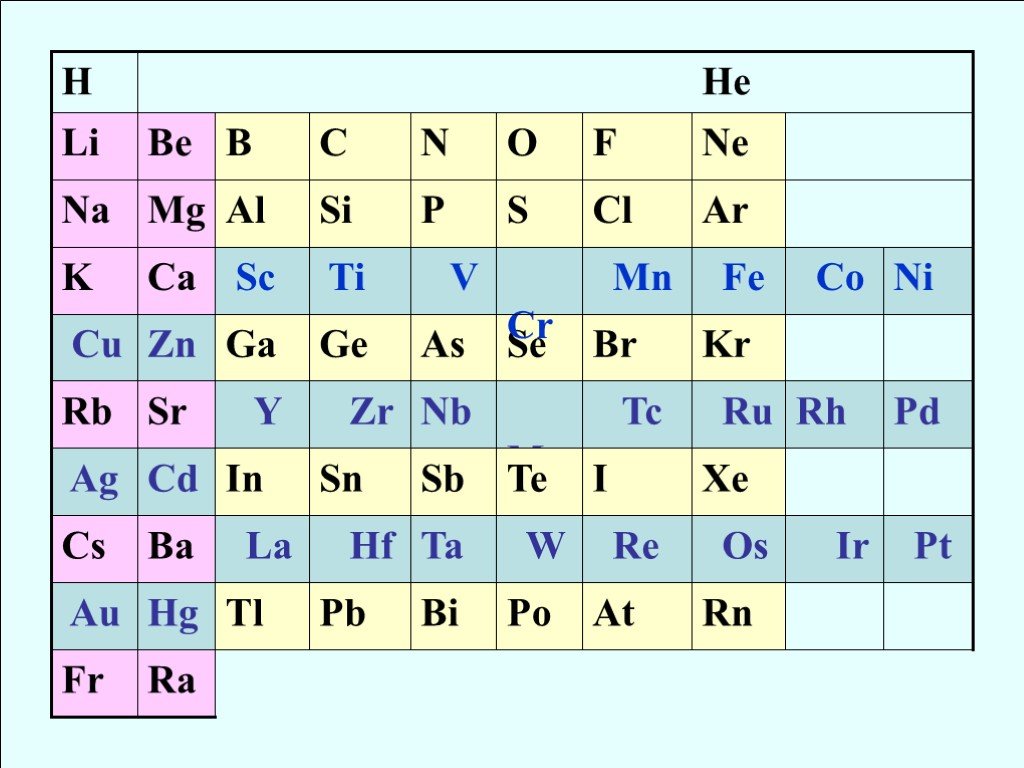


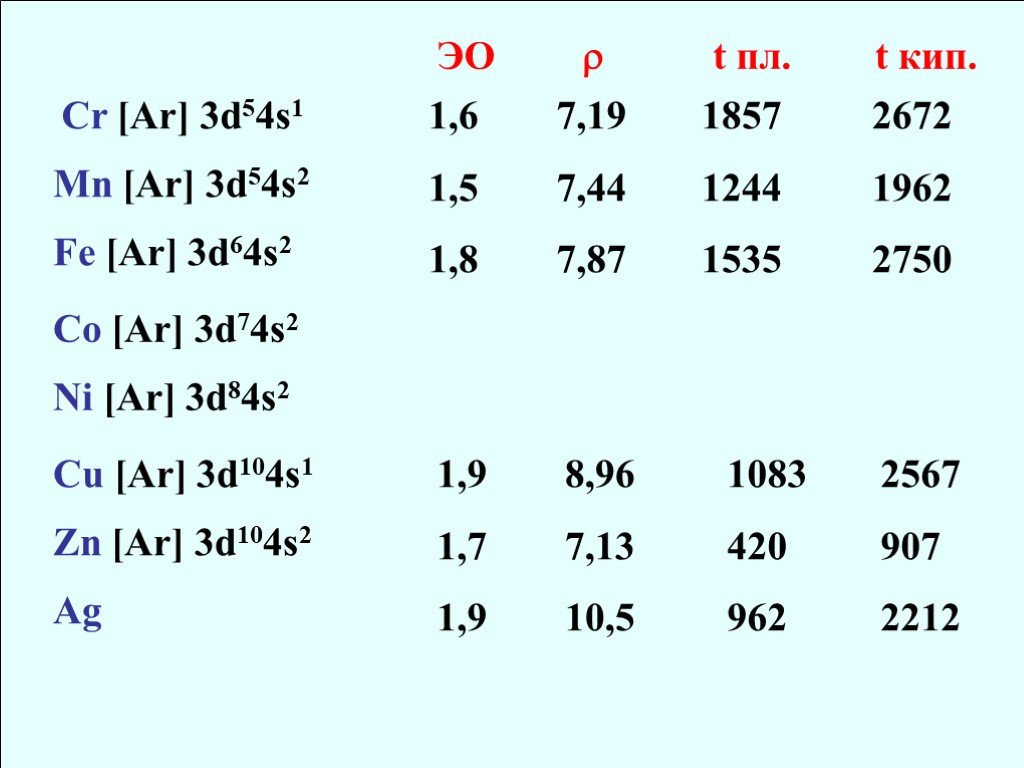







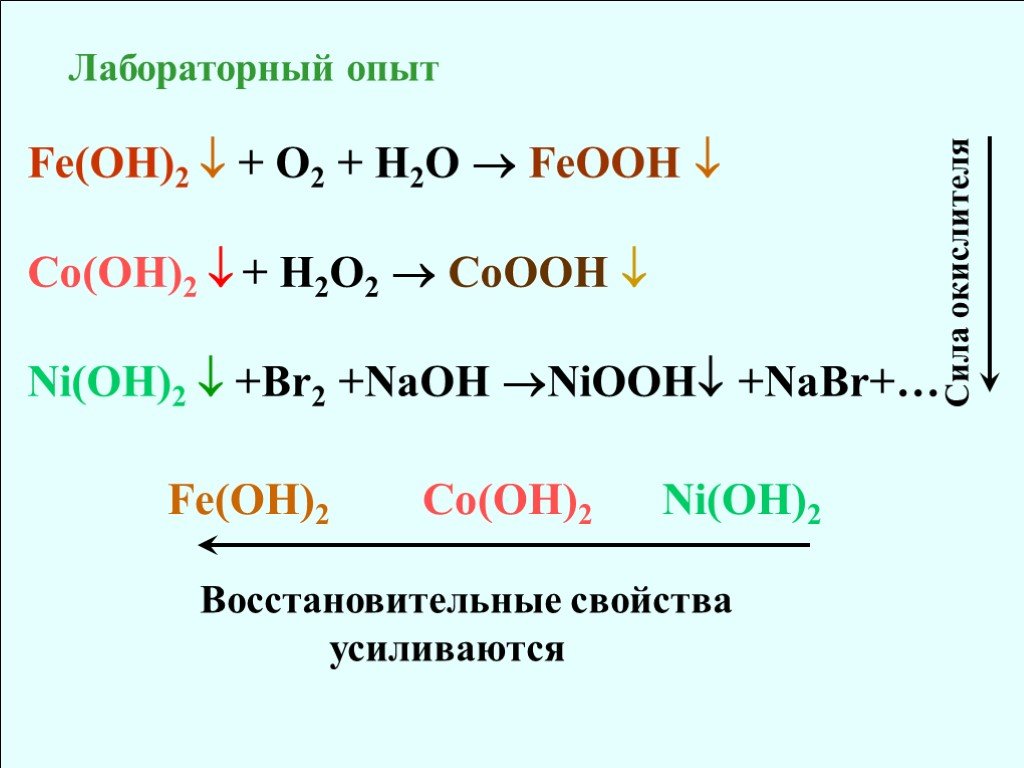





















![Cr [Ar] 3d54s1 Mn [Ar] 3d54s2 Fe [Ar] 3d64s2 Co [Ar] 3d74s2 Ni [Ar] 3d84s2 Cu [Ar] 3d104s1 Zn [Ar] 3d104s2 Ag ЭО 1,6 1,5 1,8 1,9 1,7 1,9 7,19 7,44 7,87 8,96 7,13 10,5 t пл. 1857 1244 1535 1083 420 962 t кип. 2672 1962 2750 2567 907 2212 Cr [Ar] 3d54s1 Mn [Ar] 3d54s2 Fe [Ar] 3d64s2 Co [Ar] 3d74s2 Ni [Ar] 3d84s2 Cu [Ar] 3d104s1 Zn [Ar] 3d104s2 Ag ЭО 1,6 1,5 1,8 1,9 1,7 1,9 7,19 7,44 7,87 8,96 7,13 10,5 t пл. 1857 1244 1535 1083 420 962 t кип. 2672 1962 2750 2567 907 2212](https://prezentacii.org/upload/cloud/18/08/70689/images/thumbs/screen6.jpg)

![На d-подуровне наблюдается повышенная устойчивость конфигурации d0, d5, d10. Ti:[Ar]3d24s2 Ti+IV: [Ar]3d04s0 Ti: (II),III,IV Fe:[Ar]3d64s2 Fe: II, III, (VI) Fe+III: [Ar]3d54s0 Zn+II: [Ar]3d104s0 Zn: II Zn:[Ar]3d104s2 На d-подуровне наблюдается повышенная устойчивость конфигурации d0, d5, d10. Ti:[Ar]3d24s2 Ti+IV: [Ar]3d04s0 Ti: (II),III,IV Fe:[Ar]3d64s2 Fe: II, III, (VI) Fe+III: [Ar]3d54s0 Zn+II: [Ar]3d104s0 Zn: II Zn:[Ar]3d104s2](https://prezentacii.org/upload/cloud/18/08/70689/images/thumbs/screen9.jpg)



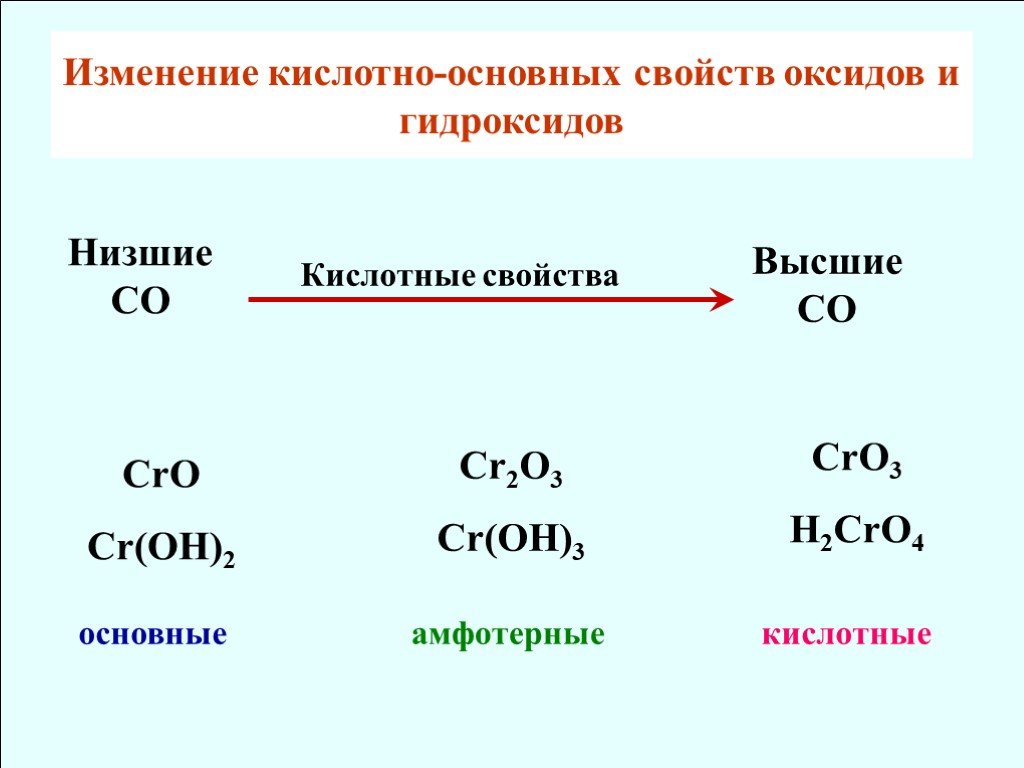
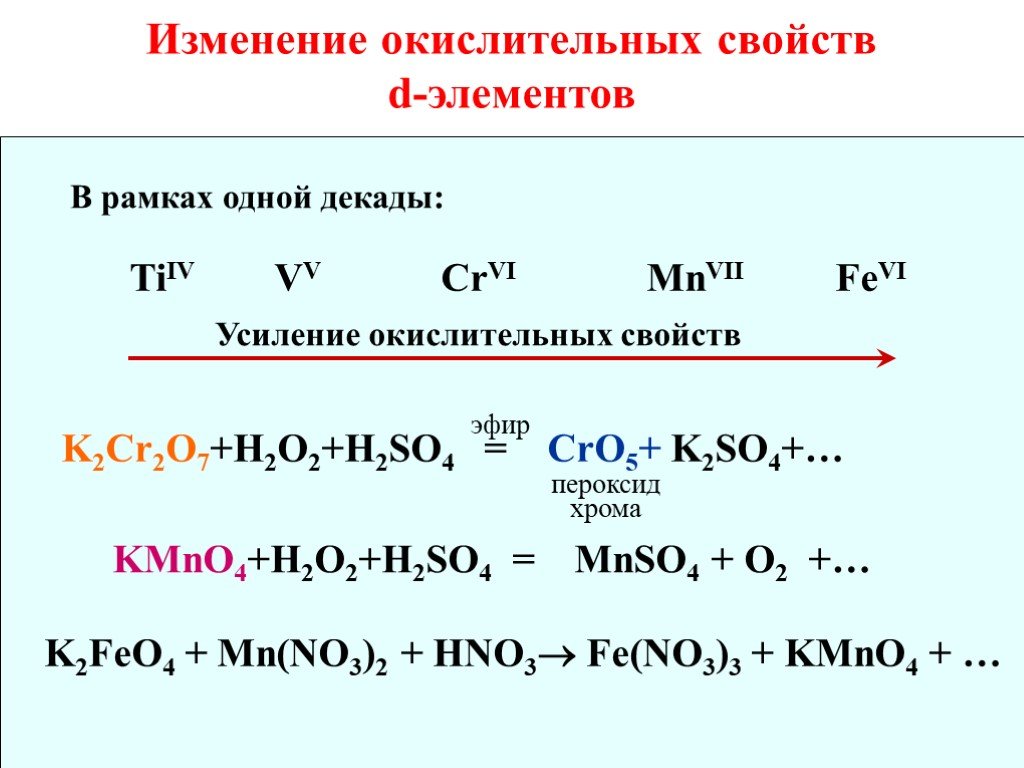
![Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O. Cr(OH)3 + NaOH = Na[Cr(OH)4]. тетрагидроксохромит натрия. Cr2O3 + NaOH = NaCrO2 + H2O хромит натрия t СrO3 - кислотный оксид CrO3 + KOH = K2CrO4 + H2O хромат калия. В кислой среде хроматы переходят в дихроматы: СrO42- + H+ = Cr2O72- + H2O Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O. Cr(OH)3 + NaOH = Na[Cr(OH)4]. тетрагидроксохромит натрия. Cr2O3 + NaOH = NaCrO2 + H2O хромит натрия t СrO3 - кислотный оксид CrO3 + KOH = K2CrO4 + H2O хромат калия. В кислой среде хроматы переходят в дихроматы: СrO42- + H+ = Cr2O72- + H2O](https://prezentacii.org/upload/cloud/18/08/70689/images/thumbs/screen13.jpg)
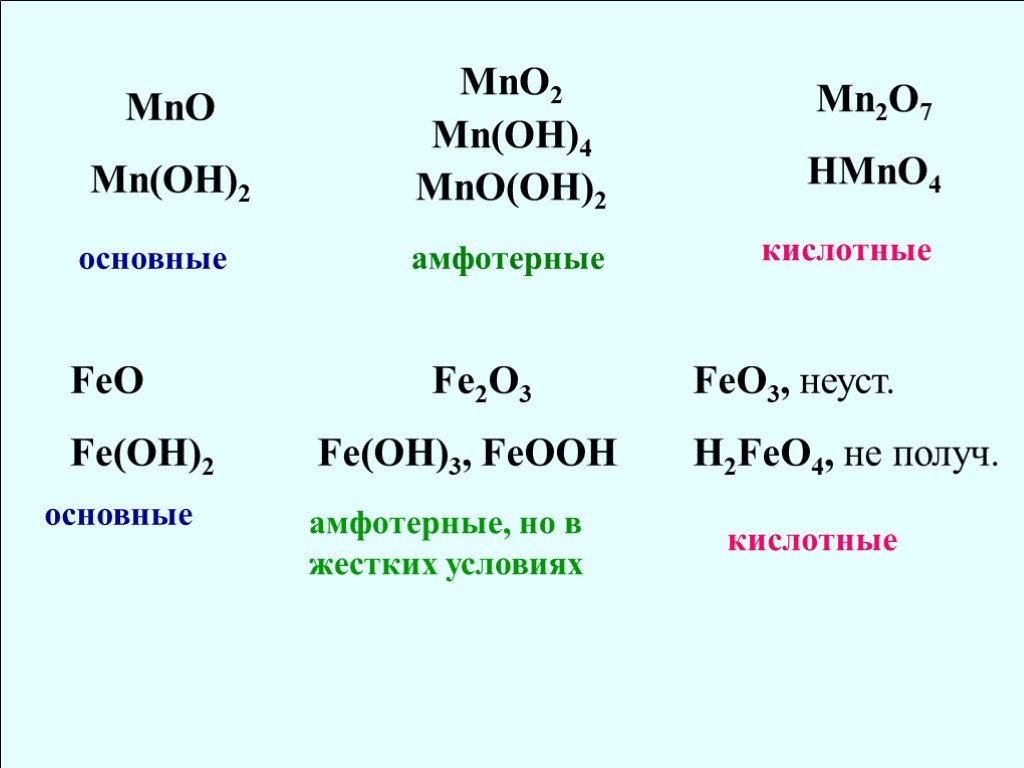
![Fe2O3. - обладает амфотерными свойствами, но в жестких условиях: Fe2O3 + HCl = FeCl3 + H2O Fe2O3 + KOH = KFeO2 + H2O феррит калия. Ферриты - соли железистой кислоты HFeO2. Zn + HCl = ZnCl2 + H2. Амфотерными являются оксид и гидроксид цинка: ZnO, Zn(OH)2. Zn + NaOH + H2O = Na2[Zn(OH)4] + H2. ZnO + Na Fe2O3. - обладает амфотерными свойствами, но в жестких условиях: Fe2O3 + HCl = FeCl3 + H2O Fe2O3 + KOH = KFeO2 + H2O феррит калия. Ферриты - соли железистой кислоты HFeO2. Zn + HCl = ZnCl2 + H2. Амфотерными являются оксид и гидроксид цинка: ZnO, Zn(OH)2. Zn + NaOH + H2O = Na2[Zn(OH)4] + H2. ZnO + Na](https://prezentacii.org/upload/cloud/18/08/70689/images/thumbs/screen14.jpg)





![CoCl2 + 4KSCN K2[Co(SCN)4] + 2KCl. Эту способность используют: 1) для очистки d-элементов от примесей. Ni + 4CO = [Ni(CO)4]. Тетракарбонил никель. Для d-элементов характерно образование комплексных соединений. Карбонилы являются особым типом комплексных соединений. [Fe(CO)5] [Co(CO)4]. тетракарбон CoCl2 + 4KSCN K2[Co(SCN)4] + 2KCl. Эту способность используют: 1) для очистки d-элементов от примесей. Ni + 4CO = [Ni(CO)4]. Тетракарбонил никель. Для d-элементов характерно образование комплексных соединений. Карбонилы являются особым типом комплексных соединений. [Fe(CO)5] [Co(CO)4]. тетракарбон](https://prezentacii.org/upload/cloud/18/08/70689/images/thumbs/screen20.jpg)
![2) Для разделения близких по свойствам элементов: ZnSO4CdSO4 + NaOHизбыток Na2[Zn(OH)4]раствор Cd(OH)2 + Na2SO4. AgCl + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaCl. 3) для перевода малорастворимых соединений в раствор: 2) Для разделения близких по свойствам элементов: ZnSO4CdSO4 + NaOHизбыток Na2[Zn(OH)4]раствор Cd(OH)2 + Na2SO4. AgCl + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaCl. 3) для перевода малорастворимых соединений в раствор:](https://prezentacii.org/upload/cloud/18/08/70689/images/thumbs/screen21.jpg)
![Fe2+ + K3[Fe(CN)6] = KFeFe(CN)6 + …. III II III Fe3+ + 6 SCN- = [Fe(SCN)6]3-. CoSO4+ KNO2 = K3[Co(NO2)6] + NO +... Для обнаружения ионов калия. 4) обнаружение ионов металлов в растворе: Fe2+ + K3[Fe(CN)6] = KFeFe(CN)6 + …. III II III Fe3+ + 6 SCN- = [Fe(SCN)6]3-. CoSO4+ KNO2 = K3[Co(NO2)6] + NO +... Для обнаружения ионов калия. 4) обнаружение ионов металлов в растворе:](https://prezentacii.org/upload/cloud/18/08/70689/images/thumbs/screen22.jpg)








![Au + KCN + O2 + H2O = K[Au(CN)2] + KOH. K[Au(CN)2] + Zn = K2[Zn(CN)4] + Au. цементация золота. Гидрометаллургический способ извлечения золота. 2. Растворение золота в ртути с последующей разгонкой амальгамы. Амальгама – сплав Hg с металлами (Zn, Cu, щелочные металлы). Au + KCN + O2 + H2O = K[Au(CN)2] + KOH. K[Au(CN)2] + Zn = K2[Zn(CN)4] + Au. цементация золота. Гидрометаллургический способ извлечения золота. 2. Растворение золота в ртути с последующей разгонкой амальгамы. Амальгама – сплав Hg с металлами (Zn, Cu, щелочные металлы).](https://prezentacii.org/upload/cloud/18/08/70689/images/thumbs/screen31.jpg)
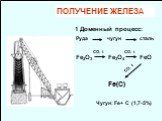
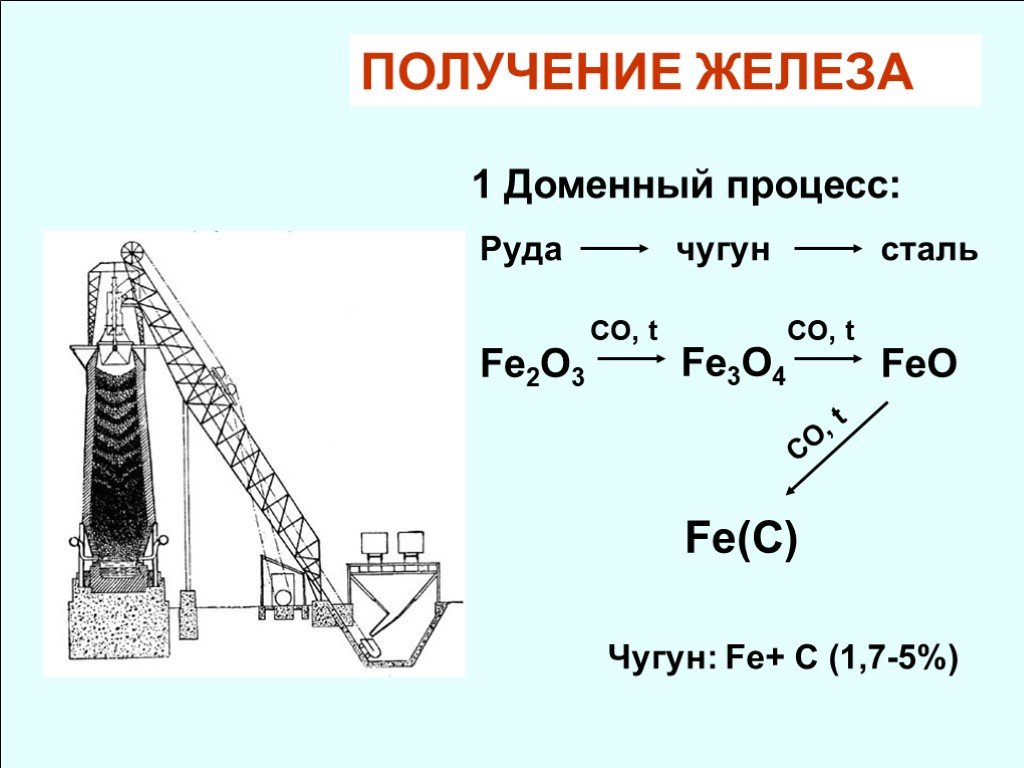
![1. Разложение карбонильных комплексов (Ni, Co, Cr…). Fe + 5CO = Fe(CO)5 Порошок желтая жидкость пентакарбонил железо. Pt, t. Получение металла высокой чистоты. [Fe(CO)5] Fe + 5CO 160-200оС. Железо высокой чистоты. 2. Иодидное рафинирование. 3. Электролиз водных растворов солей. 1. Разложение карбонильных комплексов (Ni, Co, Cr…). Fe + 5CO = Fe(CO)5 Порошок желтая жидкость пентакарбонил железо. Pt, t. Получение металла высокой чистоты. [Fe(CO)5] Fe + 5CO 160-200оС. Железо высокой чистоты. 2. Иодидное рафинирование. 3. Электролиз водных растворов солей.](https://prezentacii.org/upload/cloud/18/08/70689/images/thumbs/screen33.jpg)


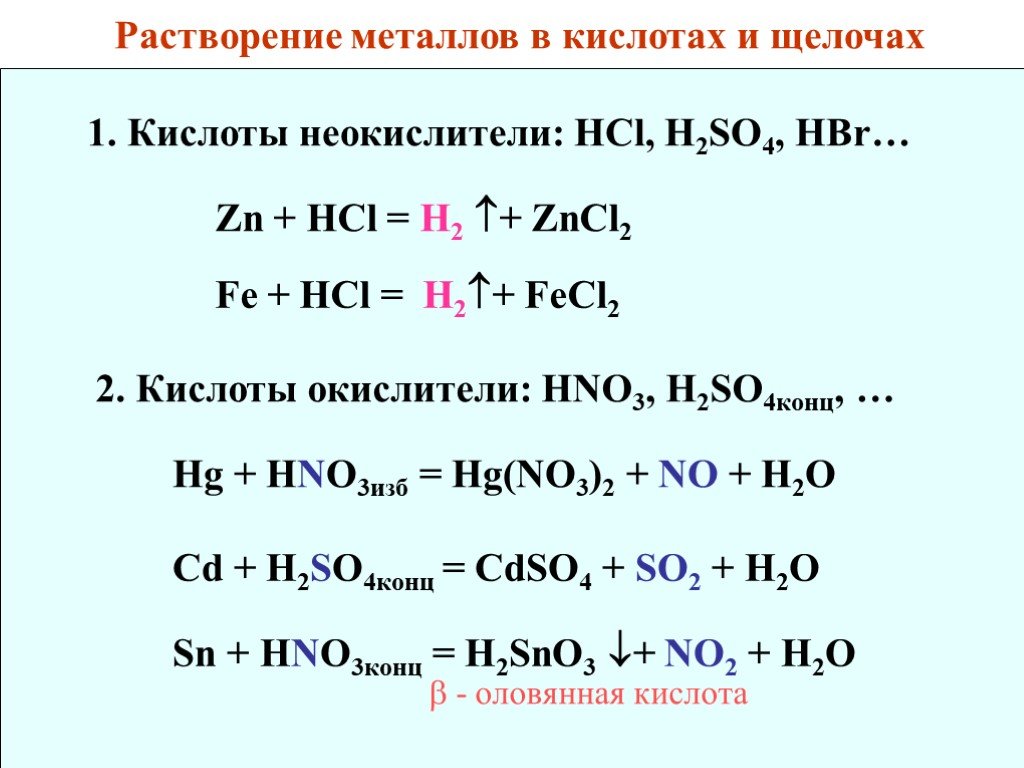
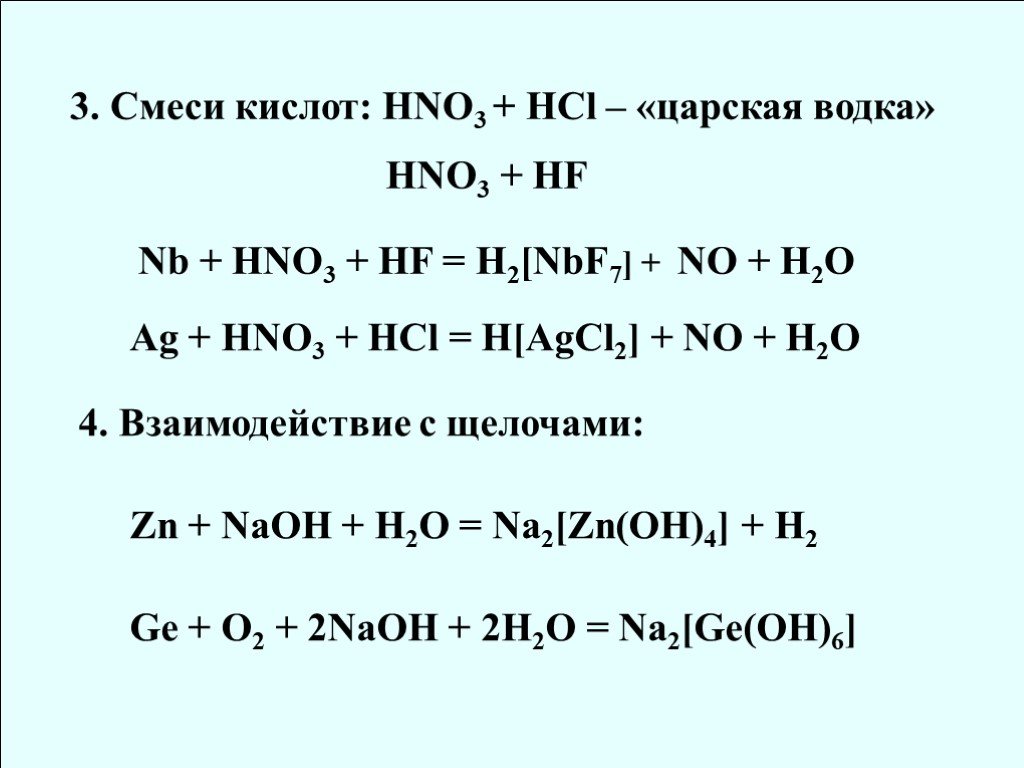
![3. Смеси кислот: HNO3 + HCl – «царская водка». HNO3 + HF. Nb + HNO3 + HF = H2[NbF7] + NO + H2O. 4. Взаимодействие с щелочами: Ge + O2 + 2NaOH + 2H2O = Na2[Ge(OH)6]. Ag + HNO3 + HCl = H[AgCl2] + NO + H2O 3. Смеси кислот: HNO3 + HCl – «царская водка». HNO3 + HF. Nb + HNO3 + HF = H2[NbF7] + NO + H2O. 4. Взаимодействие с щелочами: Ge + O2 + 2NaOH + 2H2O = Na2[Ge(OH)6]. Ag + HNO3 + HCl = H[AgCl2] + NO + H2O](https://prezentacii.org/upload/cloud/18/08/70689/images/thumbs/screen36.jpg)
2 + H2↑. Cd + O2 + NH3· H2O = [Cd(NH3)4](OH)2 + H2O. 6. Окислительное щелочное плавление (V,Nb, Ta, Cr, MO, W…): V + O2 + Na2CO3 = Na3VO4 + CO2 . Cr + O2 + NaOH = Na2 Cr O4 + H2O. Полученные соли легко растворяются в воде 5. Взаимодействие с гидратом аммиака: Zn + NH3·H2O = [Zn(NH3)4](OH)2 + H2↑. Cd + O2 + NH3· H2O = [Cd(NH3)4](OH)2 + H2O. 6. Окислительное щелочное плавление (V,Nb, Ta, Cr, MO, W…): V + O2 + Na2CO3 = Na3VO4 + CO2 . Cr + O2 + NaOH = Na2 Cr O4 + H2O. Полученные соли легко растворяются в воде](https://prezentacii.org/upload/cloud/18/08/70689/images/thumbs/screen37.jpg)






























