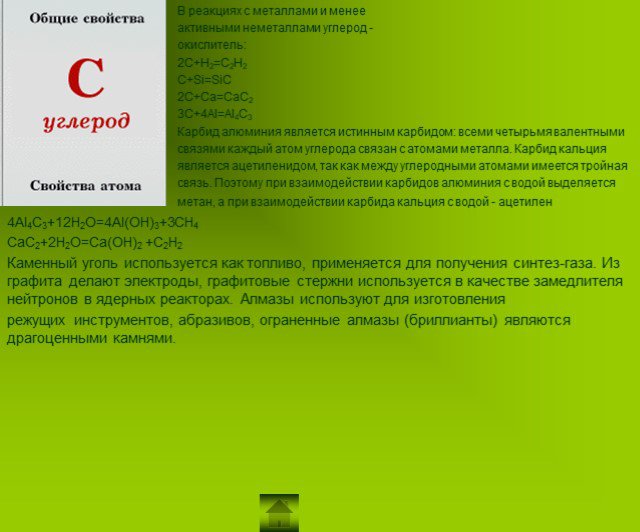
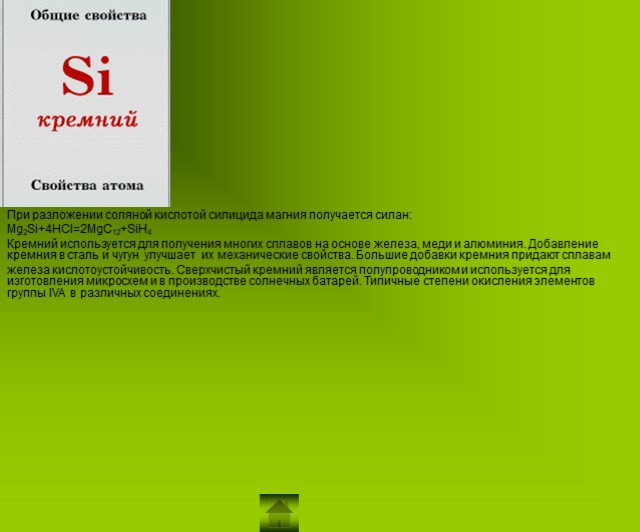
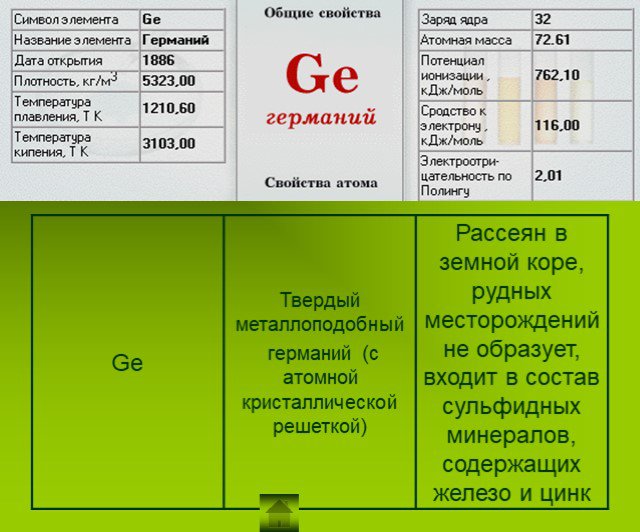
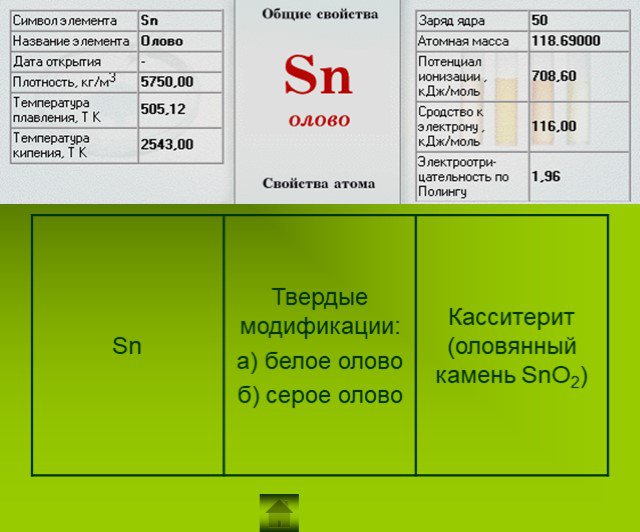
Презентация "Подгруппа углерода" по химии – проект, доклад
Презентацию на тему "Подгруппа углерода" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 14 слайд(ов).
Слайды презентации
Список похожих презентаций
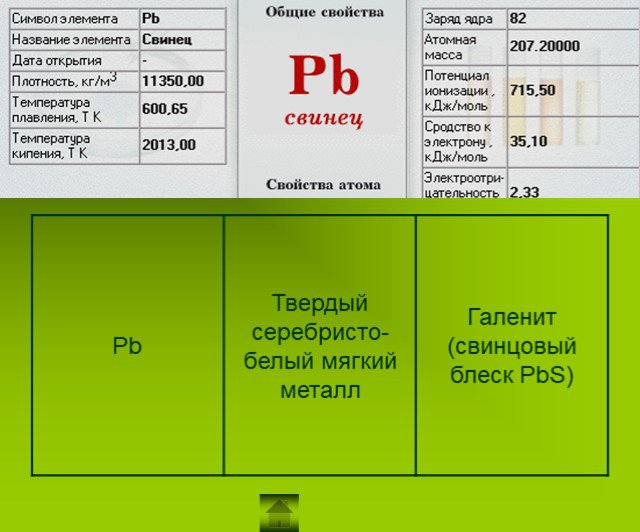
Подгруппа углерода
Загадка: Из меня состоит все живое: Я – графит, антрацит и алмаз, Я на улице, в школе и в поле, Я в деревьях и в каждом из вас. Работа с учебником ...Подгруппа углерода и азота
Цель урока:. Закрепить и обобщить знания об основных физических и химических свойствах углерода, азота и их соединений. Продолжить формировать умение ...Подгруппа углерода
Цель урока:. Выяснить насколько усвоен материал по теме, дополнить знания учащихся об оксидах углерода и кремния и других соединениях. Совершенствовать ...Углерод, соединения углерода
Цель занятия: обобщение, систематизация и углубление знаний по теме «Углерод и его соединения». Вопросник:. Элементы, содержащиеся в живых организмах. ...Подгруппа кислорода
Реактивы: сульфат натрия, сульфат меди (ll), лакмус, фенолфталеин, хлорид бария, гидроксид калия, серная кислота Оборудование: набор пробирок (ПХ-14, ...Подгруппа азота (V - А группа)
N P As Sb Bi - азот - фосфор. - мышьяк ( арсеникум). - сурьма (стибиум) - висмут. Чем похожи и чем различаются элементы главной подгруппы V группы? ...Подгруппа азота
1.С ростом порядкового номера элемента кислотные свойства оксидов в ряду…. N2O - P2O3 - As2O3 - Sb2O3 -Bi2O3. а) усиливаются б) ослабевают в) остаются ...Оксиды углерода
Оксиды углерода (II) и (IV). Тема: Содержание. Входной тест Строение молекул Физические свойства Физиологическое воздействие Получение Химические ...Круговорот углерода в биосфере
цели урока. - Выяснить, какие организмы участвуют в круговороте углерода - Составить схему процесса круговорота углерода. - Проследить и уточнить ...Круговорот углерода
КРУГОВОРОТ УГЛЕРОДА. Зависит как от биохимических, так и от физических процессов. АТМОСФЕРНЫЙ УГЛЕКИСЛЫЙ ГАЗ. Наиболее доступный источник углерода, ...Кислородные соединения углерода
Взаимопроверка. Отметка: 10 правильных ответов – «5» 8-9 правильных ответов – «4» 5-7 правильных ответов – «3» Менее 5 – «2». Урок химии в 9 классе ...Кислородные соединения углерода
Угарный газ (СО)содержится в выхлопных газах автомобилей. Воздух, окутывающий Землю, содержит около 3 млрд. т. СО2. План изучения веществ. Состав ...Кислородные соединения углерода
Без углерода не существует ни одного растения или животного... Кристаллическая решетка графита (плоскостная). Кристаллическая решетка алмаза (тетраэдрическая). ...Задачи Подгруппа кислорода
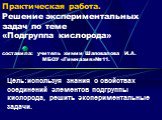
Практическая работа№2 Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: опытным путем определить растворы следующих веществ: H2SO4 ...Гибридизация атомов углерода
1s sp3 – ГИБРИДИЗАЦИЯ. Электронная структура атома углерода. С – 1s22s22p2 С* – 1s22s12p3. Процессы выравнивания орбиталей по форме и энергии называют. ...Валентные состояния атома углерода
Первое валентное состояние атома углерода (на примере молекулы метана). СН4 Н Н С Н Н. Два «противоречия» в строении метана:. Валентность углерода ...Оксиды углерода
. . . . . . . . Вывод однозначен – все это аллотропные модификации атома углерода! У элемента номер шесть Достоинств очень много есть. «Людям я совсем ...Круговорот углерода в природе
Вся земная жизнь основана на углероде. Каждая молекула живого организма построена на основе углеродного скелета. Атомы углерода постоянно мигрируют ...Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
В 300 мг 20% раствора HNO3 растворили 10 мл аммиака. Определить массу полученной соли. Задача:. CO2 углекислый газ Без цвета Без запаха В воде растворяется ...Круговорот углерода в природе
Самый интенсивный биогеохимический цикл круговорот углерода. В природе углерод существует в двух основных формах в карбонатах (известняках) и углекислом ...Конспекты
Подгруппа углерода. Углерод как простое вещество
Тема: «Подгруппа углерода. Углерод как простое вещество». Цель урока. :. Дать общую характеристику элементам. VI. А группы, показать аллотропные ...Суд над оксидом углерода (II)
Урок – игра. . . «Суд над оксидом углерода (. II. )». Урок химии в 9 классе. . Цели: 1) обобщение и углубление знаний об оксиде углерода( ...Превращения углерода в природе
МУНИЦИПАЛЬНОЕ АВТОНОМНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №5 ИМЕНИ Ю.А.ГАГАРИНА г. ТАМБОВА. Интегрированное ...Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Углерод, аллотропные модификации
Дата_____________ Класс_______________. Тема:. . Положение углерода и кремния в периодической системе химических элементов, строение их атомов. ...Подгруппа кислорода
Урока по химии 9 класс по теме:. «Подгруппа кислорода». Составлен учителем химии. МОУ «СОШ №5 г.Кировска». Зудковой Верой Сергеевной. Цель ...Подгруппа кислорода
Дата_____________ Класс_______________. Тема:. . Практическая работа №2 Решение экспериментальных задач по теме «Подгруппа кислорода». Цели урока:. ...Подгруппа галогенов
Конспект урока. Аттестуемый педагог Краснова Оксана Владимировна. Предмет Химия. Класс 9. . Тема урока. «Подгруппа галогенов». Цель. : ...Оксиды углерода
Цель. : сформировать знания об оксиде углерода (II) и оксиде углерода (IV). Задачи:. На основе электронного строения атома углерода определить ...Подгруппа азота
Урок-семинар в 9 классе. по теме: «Подгруппа азота». Девиз урока: « Мало знать, надо и применять. Мало хотеть, надо и делать» (Гёте). Цели ...Подгруппа азота
АЗОТ. Тема. : подгруппа азота. Тема урок. : азот. Цели. . . . 1. . Образовательная. . Выявление и оценка степени овладения учащимися системой ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Пивоварова Татьяна Николаевна
Содержит:14 слайд(ов)
Поделись с друзьями:
Скачать презентацию