Презентация "Амфотерные оксиды и гидроксиды" по химии – проект, доклад
Презентацию на тему "Амфотерные оксиды и гидроксиды" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 30 слайд(ов).
Слайды презентации
Список похожих презентаций
Химические оксиды
Н2О. самое распространенное вещество на нашей планете. Вода покрывает 71% площади поверхности Земли. Льдом покрыто 20% суши. Вода влияет на климат. ...Обобщение темы: «Кислоты, основания, оксиды и соли, их классификация и свойства»
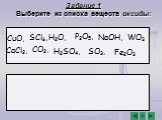
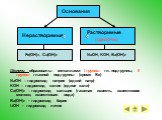
Вопрос №1. Сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид – ионов, называются: 1) кислоты 2) основания 3) оксиды 4) соли ...тест оксиды
Результат теста. Верно: 6 Ошибки: 2 Отметка: 3. Время: 0 мин. 38 сек. ещё исправить. Выберите формулу оксида натрия. 1 2 4 Н2СО3 СО2 N2О Na2О. Выберите ...Кислотные оксиды
№ 3 стр. 99. CaCl2 MgCO3 Zn(NO3)2 Al2(SO4)3 K2CO3 Na2SO4 Na2SiO3 AgCl MgSO3 Al2S3. H O S. Образование солей. Zn. Номенклатура солей. + =. Составить ...Важнейшие представители бинарных соединений – оксиды и летучие водородные соединения
Н2О - вода. СО2 углекислый газ. СУХОЙ ЛЁД. NH3 аммиак. HCL хлороводород. Бесцветный газ. Тяжелее воздуха. Хорошо растворяется в воде. Раствор хлороводорода ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
SiO2 , H2O , CO2 , AI2O3 , Fe2O3 , CO. Всесильная стихия природы-вода во все времена, во все периоды истории покоряла ум и воображение людей. Человек ...Бинарные соединения: оксиды, гидриды
Цели урока. Познакомиться с понятием оксиды и гидриды; Закрепить навыки составления формул по С.О. и определение С.О. по формуле; Произвести расчёты ...Амфотерные свойства воды
1. Катион – это: а) ион меди; б) атом серы; в) ион серы; г) атом меди. 2. Анион – это: а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода. ...Конспекты
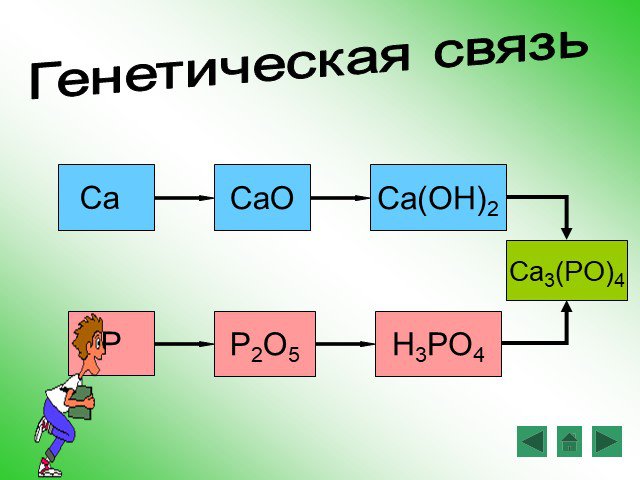
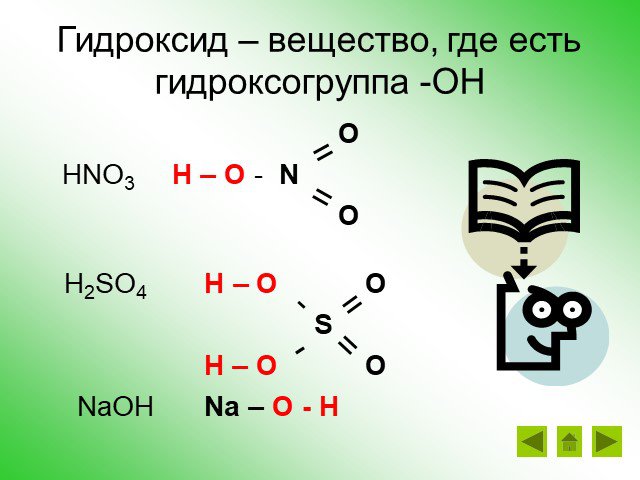
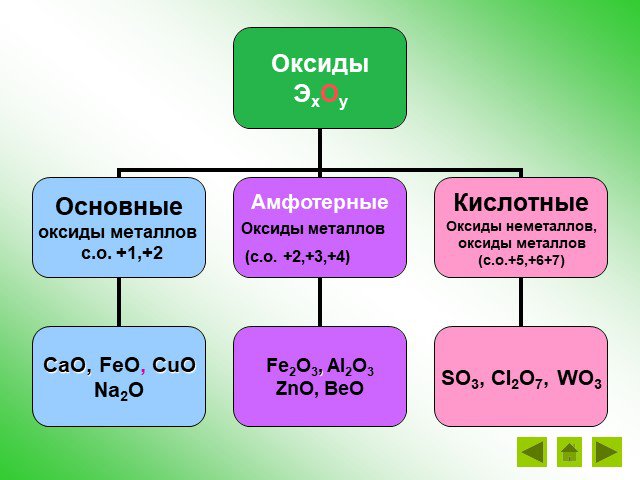
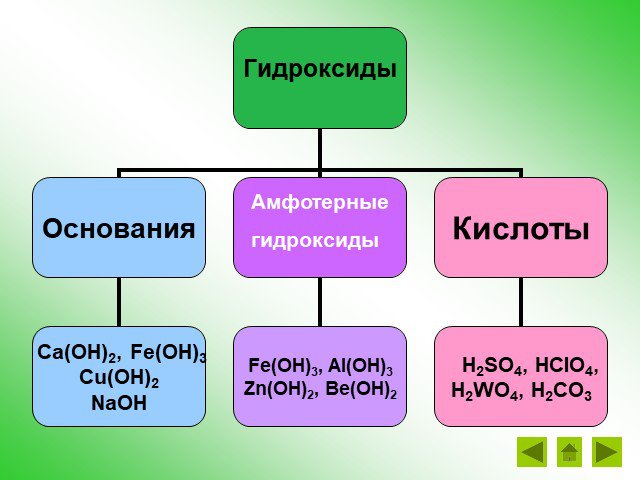
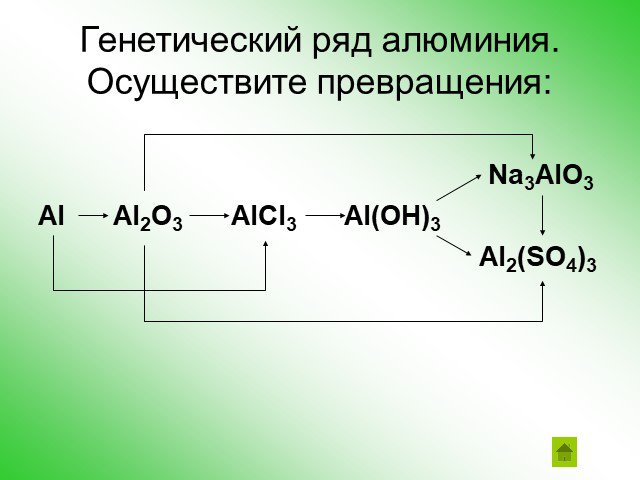
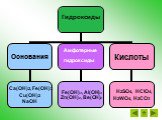
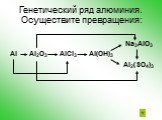
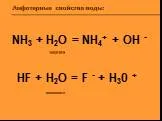
Амфотерные оксиды и гидроксиды
. МБОУ ООШ №12 х.К-Кужорский Кошехабльский район. . Открытый урок по химии для учащихся 9 класса:. « Амфотерные оксиды и гидроксиды». ...Амфотерные оксиды и гидроксиды
. Муниципальное казенное общеобразовательное учреждение средняя общеобразовательная школа № 2 г. Омутнинска. Кировской области. ...Амфотерные гидроксиды
Муниципальное общеобразовательное учреждение. «Средняя общеобразовательная школа № 3». Гиагинского района станицы Гиагинской. Тема ...Оксиды, гидроксиды и соли железа(II) и железа(III)
Дата_____________ Класс_______________. Тема:. Оксиды, гидроксиды и соли железа(II) и железа(III). . Цели урока:. рассмотреть электронное строение ...Основные классы неорганических соединений: кислоты, оксиды, основания, соли. Типы химических реакций
Дата ____________ Класс _____________. Тема: Основные классы неорганических соединений: кислоты, оксиды, основания, соли. Типы химических реакций. ...Общая характеристика элементов главной подгруппы VI группы. Кислород и сера.Важнейшие соединения: оксиды, кислоты и их соли
Класс: 10 , учитель: Султанова Е.А. СШ № 17 , г. Балхаш, химия. Тип урока:. комбинированный,. язык обучения. : русский. Оборудование:. флипчарт, ...Кислотные оксиды и окружающая среда
Открытый урок: «Кислотные оксиды. и окружающая среда». Берегите молодые всходыНа зеленом празднике природы,Небо в звездах, океан и сушуИ в бессмертье ...Важнейшие классы бинарных соединений – оксиды, их роль в природе и жизни человека
Урок химии в 8 классе по теме:. «Важнейшие классы бинарных соединений – оксиды, их роль в природе и жизни человека». Цели урока:. Предметные. ...Важнейшие классы бинарных соединений – оксиды их роль в природе и жизни человека
Государственное казённое образовательное учреждение Ростовской области. общеобразовательная школа-интернат основного общего образования. п. Шолоховского ...Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
Учитель химии первой квалификационной категории Никулина В.А. МОУ «СОШ с.Ново – Захаркино». Тема. Важнейшие классы бинарных соединений – оксиды ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Васильева Марина Анатольевна, учитель химии
Содержит:30 слайд(ов)
Поделись с друзьями:
Скачать презентацию