Презентация "Углеводороды" по химии – проект, доклад
Презентацию на тему "Углеводороды" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
Углеводороды ряда этилена
Этилен. Углеводороды ряда этилена Цель урока. Повторить строение молекулы этилена, виды изомерии и номенклатуру алкенов, химические свойства этилена. ...Углеводороды в вопросах ЕГЭ
Силу ума придают упражнения, а не покой. Учащиеся должны. Знать классы углеводородов и их общие формулы Уметь составлять формулы углеводородов Уметь ...Углеводороды и их природные источники. Прородный газ
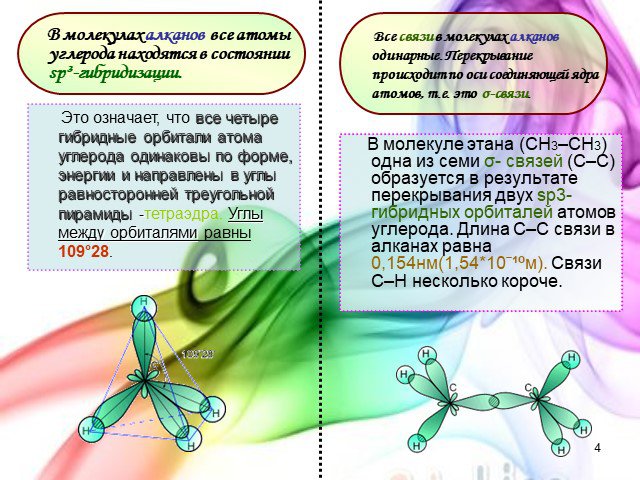
Углеводороды-это класс органических соединений,молекулы которых состоят только из углерода и водорода. Наиболее распространенными природными источниками ...Углеводороды алкены
Учебная цель:. изучить способы получения, химические свойства и применение алкенов на примере непредельного углеводорода - этилена. Эпиграф к уроку. ...Углеводороды ароматического ряда
Какие углеводороды называются ароматическими? Ароматические углеводороды (арены) – это углеводороды с общей формулой СnH2n-6, в молекулах которых ...Углеводороды
Задачи урока: 1. проверить качество усвоения материала 2. Стимулировать познавательную активность учащихся 3. Развивать смекалку, эрудицию, быстро ...Углеводороды
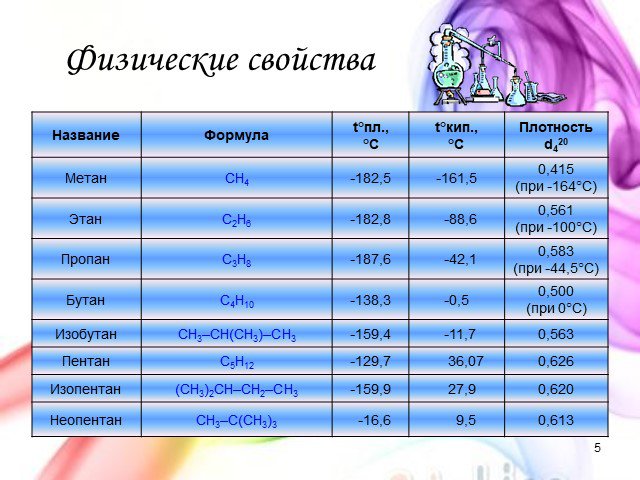
1. Гомологическому ряду алканов соответствует общая формула: а) СпН2п+2; б) СпН2п; в) СпН2п-2; г) СпНп+2 2. Название углеводорода СН3 – СН – СН3 а) ...Углеводороды
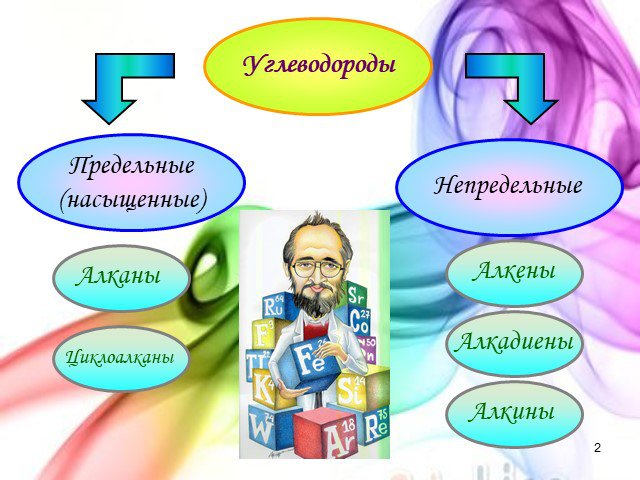
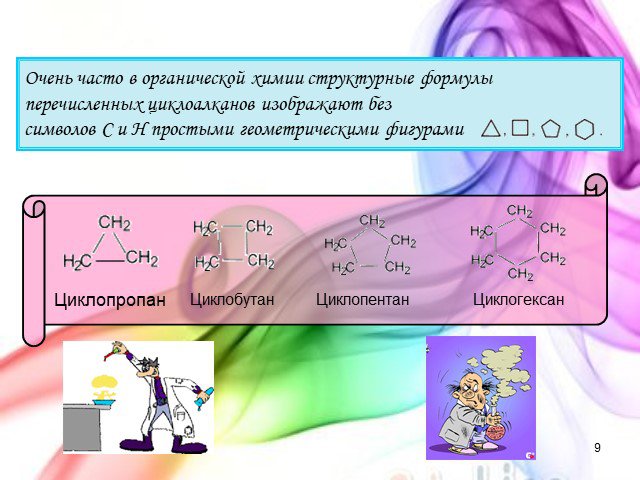
Урок - обобщение по теме "Углеводороды". Углеводороды: алканы алкены алкины алкадиены циклоалканы арены СnH2n+2 СnH2n СnH2n-2 СnH2n-6. Составьте молекулярные ...Углеводороды
Значение углеводородов. Энергоносители для получения света и тепла. Сырье для производства органических соединений:. Пластмассы и каучуки. Фреоны. ...Углеводороды
Цель урока: обобщить сведения об углеводородах. УЭ1 Обобщить знания по составу и классификации углеводородов, особенностях строения их молекул. Что ...Элемент водород
Содержание. Строение атома. История открытия и названия. Нахождение в природе. Элемент космоса. Физические свойства. Химические свойства. Получение. ...Химический элемент водород
Цели и задачи урока. повторить и закрепить знания, умения и навыки по теме «Свойства водорода и кислот. Формулы солей»; продолжить формирование познавательных ...Химический элемент - водород
Краткая характеристика элемента. H 1 1,00794 1s1 Водород. Водоро́д — первый элемент периодической системы элементов. Широко распространён в природе. ...Кислород и водород
повторить физические и химические свойства водорода и кислорода, распространение их в природе вспомнить уравнения горения простых и сложных веществ ...Конспекты
Углеводороды
Пояснительная записка. Шаповалова Ирина Анатольевна. Учитель химии. МОУ «СОШ№11 с углубленным изучением иностранных языков». г.Ноябрьск, ЯНАО. ...Углеводороды
. МИНИСТЕРСТВО ОБРАЗОВАНИЯ ОМСКОЙ ОБЛАСТИ. Бюджетное образовательное учреждение. . начального профессионального образования. . «Профессиональное ...Углеводороды
Технологическая карта урока. Тема раздела:. Углеводороды. СМК раздела. Основные классы УВ: алканы, алкены, алкины, алкадиены, циклоалканы, ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:25 апреля 2015
Категория:Химия
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию