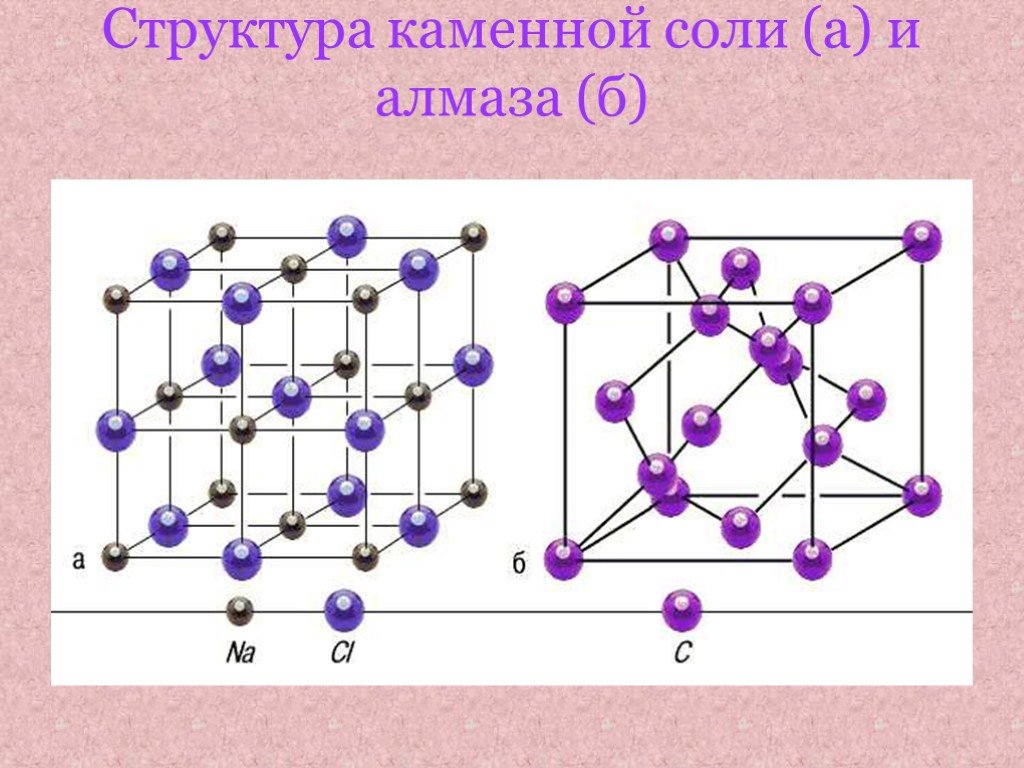
Презентация "Соль 2" по химии – проект, доклад
Презентацию на тему "Соль 2" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 18 слайд(ов).
Слайды презентации
Список похожих презентаций
Соль в организме человека
Выявить значение соли для организма человека. Цель проекта:. 1 занятие: -выбор темы проекта -постановка цели 2 занятие: -составление плана работы ...Соль азотной кислоты
знать и уметь. называть соли азотной кислоты, определять какие свойства окислительные или и восстановительные характерны для них; определять: степень ...Соль 1
Содержание. Состав солей Что такое соли? Алгоритм составления формулы соли бескислородной кислоты Алгоритм составления формулы соли кислородсодержа-щей ...Угольная и кремниевая кислоты и их соли
Напишите уравнения соответствующих реакций в ионном виде. Na2CO3 →NaHCO3 →Na2CO3.Запишите уравнения реакций, соответствующих схеме. Качественные ...
Азотная кислота и её соли
Вспомните! Какие степени окисления проявляет азот в своих оксидах? Какие окислы азота вы знаете? Расскажите о N2O, NO, NO2? Какое из этих соединений ...Своя игра. Физика и химия
Интегрированный урок ФИЗИКА+ХИМИЯ. Авторы: Орлова И.В., Шувалова Л.В. Муниципальное образовательное учреждение Фоминская средняя общеобразовательная ...Соляная кислота и её соли
« Просто знать - ещё не всё, знания нужно уметь использовать». Гёте. видео. Получение соляной кислоты:. 1.В промышленности получают сжиганием водорода ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Многоликая химия
«Счастливый случай». игра. Гейм I. «Многоликая химия». Общие химические знания. 1. Как называют вещества, которые изменяют скорость химической реакции ...Органическая химия
история развития органической химии предмет органической химии особенности органических веществ Бутлеров теория строения органических соединений Бутлерова ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...Коррозия металла химия
Цель презентации. В этой презентации мы рассмотрим процесс коррозии металлов как окислительно-восстановительную реакцию. Изучим : что такое коррозия; ...«Электролитическая диссоциация» химия
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...«Окислительно-восстановительные реакции» химия
СОДЕРЖАНИЕ:. 1. Какие реакции называются окислительно-восстановительными? 2. Что называют окислителем, восстановителем? 3. Окислительно-восстановительный ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...«Жиры» химия
жиры. Оглавление. Определение и общая формула Физические свойства Химические свойства Классификация жиров Животные жиры Растительные жиры Роль жиров ...Ломоносов и химия
В 2011 году исполнится 300 лет со дня рождения великого русского ученого, основателя Московского государственного университета Михаила Васильевича ...Азотная кислота и ее соли
План изучения азотной кислоты. 1.Состав . 2.Строение. 3.Физические свойства. 4.Химические свойства. 5.Получение и применение. Состав и строение азотной ...Конспекты
Соль и ее свойства
Муниципальное бюджетное дошкольное образовательное учреждение. д/с № 53 "Сказка". г. Озерска Челябинской области. Конспект урока на ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:1 апреля 2019
Категория:Химия
Содержит:18 слайд(ов)
Поделись с друзьями:
Скачать презентацию