Презентация "Неметаллы" по химии – проект, доклад
Презентацию на тему "Неметаллы" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 14 слайд(ов).
Слайды презентации
Список похожих презентаций
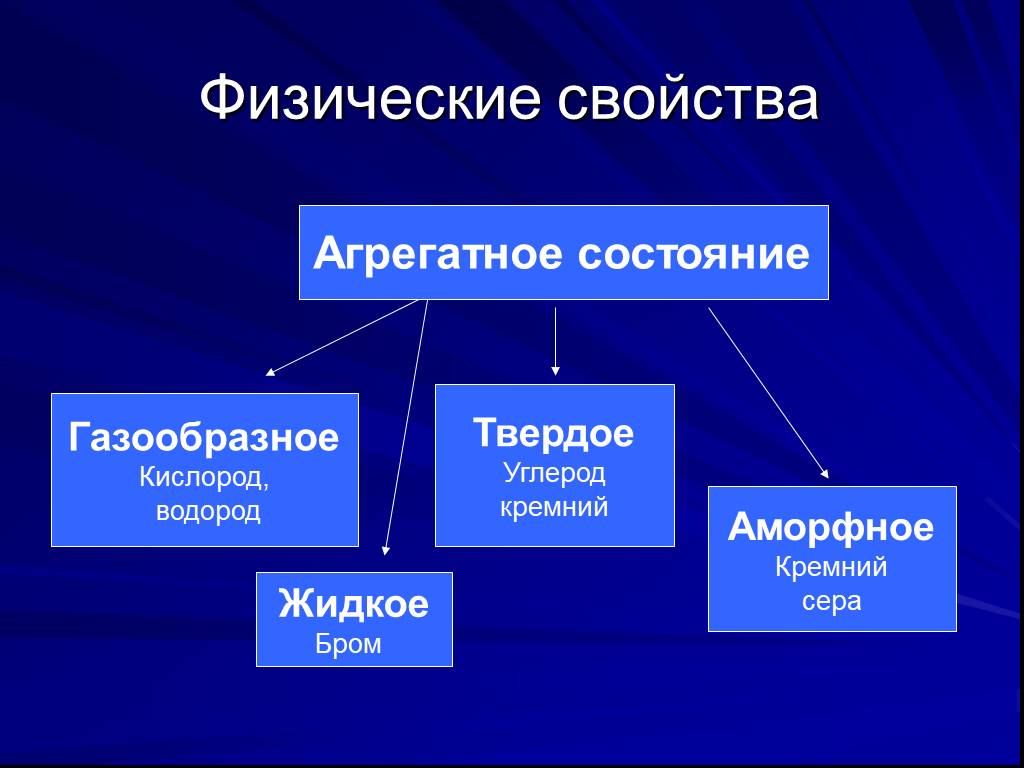
Неметаллы, особенности строения
Ответьте на вопросы:. Какой химический элемент входит в состав любого органического вещества? УГЛЕРОД. Элемент, в переводе с греческого «несущий свет»? ...Неметаллы и их характеристика
Разгадайте ребусы и назовите три химических элемента названия которых здесь зашифрованы:. уГ+лес,Т=Д , газ + , ,,,+. К какой группе относятся эти ...Неметаллы, особенности строения
Ответьте на вопросы:. Какой химический элемент входит в состав любого органического вещества? УГЛЕРОД. Элемент, в переводе с греческого «несущий свет»? ...Неметаллы
1.Сколько электронов на последнем уровне атома хлора? А) 1 Б) 3 В) 5 Г) 7. 2. Какое вещество состоит из трёхатомных молекул? А) алмаз Б) графит В) ...Неметаллы в жизни человека
Основные неметаллы. В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, твёрдые — иод, ...Неметаллы
Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Нахождение в природе. ...Неметаллы
Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ. Неметаллы характеризуются маленькими радиусами атомов и большим ...Неметаллы
Неметаллы - химические элементы с типично неметаллическими свойствами. Неметаллы занимают правый верхний угол Периодической Системы Химических Элементов ...Неметаллы
Проработать ключевые моменты изученной темы и подготовиться к контрольной работе. Цель. 1. Систематизировать и обобщить знания особенностей строения ...Металлы и Неметаллы в химии
Металлы. Большинство встречающихся в природе простых веществ - металлы. Некоторые из них мы часто встречаем в повседневной жизни, так что знаем, как ...Простые вещества: металлы и неметаллы
I Стадия «Вызова». Верите ли вы в то, что: Среди известных химических элементов большая часть – металлы? (да) Металлы бывают жидкие (да) «Оловянная ...Простые вещества - неметаллы
Цели урока:. 1)Познакомить учащихся с простыми веществами – неметаллами; 2)изучить практическое значение неметаллов; 3)продолжить формирование знаний ...Простые вещества - неметаллы
Периодическая система химических элементов Д.И. Менделеева. Неметаллы – химические элементы, которые образуют в свободном виде простые вещества, не ...Простые вещества - металлы и неметаллы
Цель урока:. Повторение основных сведений о простых веществах – металлах и неметаллах, путём выполнения различных заданий. Вопросы для обсуждения:. ...Металлы и неметаллы
Классификация веществ по составу:. Простые вещества состоят из атомов одного химического элемента. Сложные вещества состоят из атомов разных химических ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Органическая химия
история развития органической химии предмет органической химии особенности органических веществ Бутлеров теория строения органических соединений Бутлерова ...Незнайка в стране химия
Я – известный химик Незнайка. Я знаю все и все могу. Сейчас я взмахну волшебной палочкой и начнется извержение вулкана. Смотри! А теперь все за мной ...«Электролитическая диссоциация» химия
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Конспекты
Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:22 марта 2019
Категория:Химия
Содержит:14 слайд(ов)
Поделись с друзьями:
Скачать презентацию