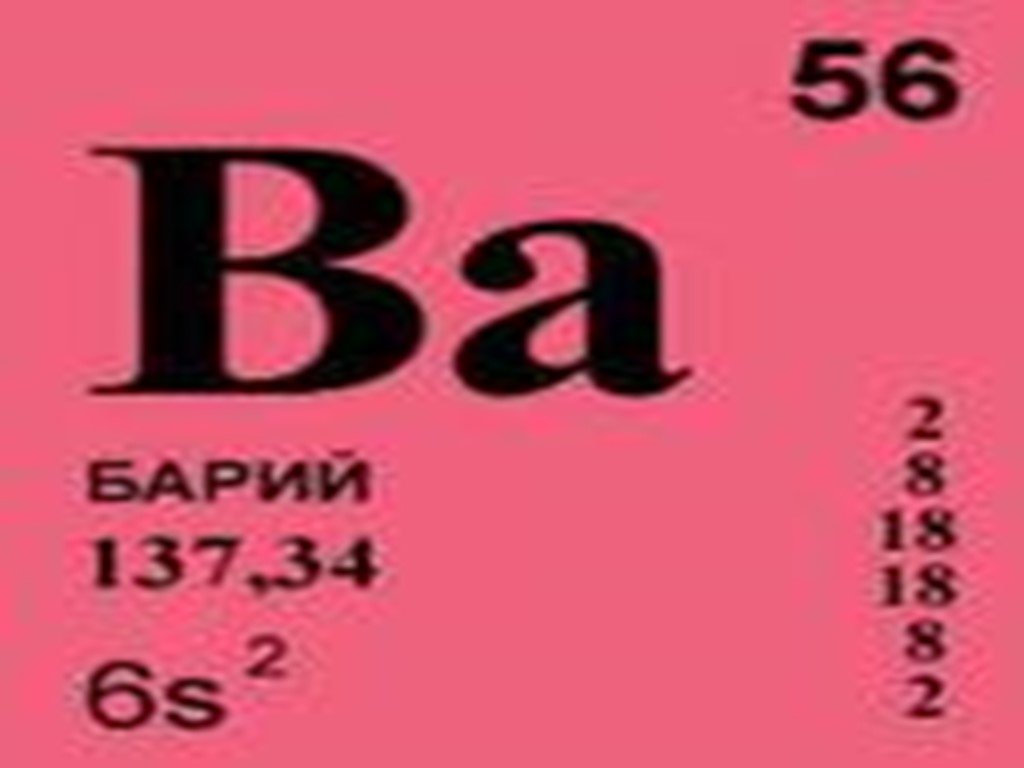Презентация "Или что Вы хотите узнать о Господине Барии:" по химии – проект, доклад
Презентацию на тему "Или что Вы хотите узнать о Господине Барии:" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 37 слайд(ов).
Слайды презентации
Список похожих презентаций
«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...Электролиз: что полезно знать
Автор работы: ученик 10 класса ГБОУ СОШ № 1465 Попов Сергей г. Москва. Руководитель : Учитель химии- Попова Светлана Анатольевна. Электролиз - это ...Фаст - фуд убийца: что есть, чтобы жить?
Чем больше будешь есть, тем будешь сильнее? Осново - полагающий вопрос:. Режим питания спасает организм от переедания? Гипотеза:. ПРОТИВОРЕЧИЯ. Между ...Пить или не пить? Вред энергетических напитков. Или польза
В каких ситуациях незаменимы энергетические напитки? Что содержится в энергетических напитках, и какой вред может быть причинён организму энергетическими ...Любовь, что движет Солнце и Светила
Храм Тадж-Махал в Агре. Троя. Цель:. Выяснить, какие вещества отвечают за состояние влюблённости, изучить структуру и состав этих веществ. Определить, ...Если Вы еще не в белом, тогда мы идем к Вам!..
Выяснить, как окислительно-восстановительные реакции применяются в быту. Цель работы:. Содержание. Стирка по научному Компоненты и их функции Обработка ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Незнайка в стране химия
Я – известный химик Незнайка. Я знаю все и все могу. Сейчас я взмахну волшебной палочкой и начнется извержение вулкана. Смотри! А теперь все за мной ...Органическая химия
история развития органической химии предмет органической химии особенности органических веществ Бутлеров теория строения органических соединений Бутлерова ...«Жиры» химия
жиры. Оглавление. Определение и общая формула Физические свойства Химические свойства Классификация жиров Животные жиры Растительные жиры Роль жиров ...М.В. Ломоносов и химия
- М.В. Ломоносов был создателем многих химических производств (неорганических пигментов, глазурей, стекла, фарфора). - Он разработал технологию и ...Кислород химия
Общая характеристика кислорода. Химический элемент Знак элемента – О Валентность – II Относительная атомная масса - 16. Простое вещество Неметалл ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...алюминий химия
получение алюминия. Применение алюминия. ...Зеленая химия и проблемы устойчивого развития
• Атмосфера (загрязнение, фотохимический смог, кислотные выпадения, деградация озонового слоя, глобальное изменение климата) • Гидросфера (загрязнение, ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...«Электролитическая диссоциация» химия
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...«Окислительно-восстановительные реакции» химия
СОДЕРЖАНИЕ:. 1. Какие реакции называются окислительно-восстановительными? 2. Что называют окислителем, восстановителем? 3. Окислительно-восстановительный ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Конспекты
Мы то, что мы едим
МАОУ СОШ № 67 с углубленным изучением отдельных предметов. . г. Екатеринбург. Учителя: Харина Светлана Борисовна (учитель химии), Палкина Дарья ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:7 марта 2019
Категория:Химия
Содержит:37 слайд(ов)
Поделись с друзьями:
Скачать презентацию