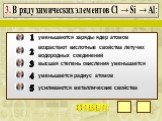
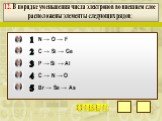
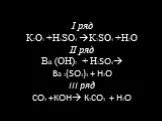Презентация "Закономерности измененияхимических свойств элементови их соединений по периодам и группам" по химии – проект, доклад
Презентацию на тему "Закономерности измененияхимических свойств элементови их соединений по периодам и группам" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 24 слайд(ов).
Слайды презентации
Список похожих презентаций
Выращивание и изучение физических свойств кристаллов медного купороса и перманганата
Гипотеза:. В домашних условиях можно вырастить кристаллы из смеси растворов, крупные кристаллы способом затравки и в лабораторных условиях изучить ...«Твердые тела и их свойства»
Твердые тела – тела, сохраняющие форму и объем в течение длительного времени. Аморфные тела. Кристаллические тела. Монокристаллы Поликристаллы. Кристаллические ...«Систематизация и обобщение знаний по теме «Типы химических реакций»»
1) Что называют химической реакцией? 2) По каким признакам можно утверждать, что произошла или происходит химическая реакция? 3) Какие условия необходимы ...«Циклоалканы, их строение. Свойства циклоалканов.»
Цель: Изучить строение, состав, физические свойства и тип гибридизации электронных облаков атома углерода в циклоалканах. Общая формула - СnH2n. Циклоалканы ...Вещества и их свойства
Физические тела – любые предметы, имеющие форму и объем. Например, физическими телами являются самые разнообразные предметы: алюминиевая ложка, гвоздь, ...Взаимосвязь между классами неорганических соединений
19.02.2019 Оськина Т.А. Даны схемы превращений. Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. ...Важнейшие классы неорганических соединений
Оксид - сложное вещество, состоящее из атомов двух элементов, один из которых - кислород. Э Ме неМе + О2 ЭО-2. Гидроксиды — соединения оксидов химических ...Генетические связи между важнейшими классами неорганических соединений
Тема. Генетические связи между важнейшими классами неорганических соединений. А. С. Макаренко: «Теория и практика неотъемлемы». . SO2 HCl H3PO4 H2O ...Важнейшие классы неорганических соединений
Цели урока:. ВОСпитывающая. Формирование интереса к умению, создание положительной атмосферы, воспитание взаимного уважения между учащимися, для раскрытия ...Жиры и их свойства
Цель занятия: создать условия для осознания и осмысления блока новой информации посредством системы вопросов и нестандартных заданий для самостоятельной ...Жиры, их строение и свойства
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Ароматические эфирные масла и их использование
Объект исследования:. Ароматические эфирные масла. Предмет исследования:. влияние ароматических масел на организм человека; эфирные масла – натуральные ...Железо, его соединения и их свойства
Задачи:. Проверить знание основных теоретических вопросов темы “Железо и его соединения”; Развивать умения составлять электронный баланс и уравнения, ...Активизация обучающихся на уроках химии как показатель развития их мыслительной деятельности.
Приёмы активизации мыслительной деятельности обучающихся:. Приём стимулирующих звеньев Приём реконструкции Приём прогнозирования. Приём стимулирующих ...Биополимеры и их структурные компоненты
«жизнь – это особая форма существования биополимерных тел (систем), характеризующихся хиральной чистотой и способностью к самоорганизации и саморепликации ...Альдегиды и их свойства
Содержание Строение молекул Изомерия и номенклатура Физические свойства Получение Химические свойства Применение Контрольные вопросы. Альдегиды – ...Алкины и их свойства
Непредельные углеводороды с тройной связью С=С в молекулах. Простейший представитель ряда – ацетилен С2Н2, общая формула СnH2n-2 (n>2). Атомы углерода ...Дисперсные системы, их классификация.
Цели урока. 1.Получить представление о дисперсных системах в природе и производственных процессах. 2.Формировать понятие о единстве мира на примере ...Алгоритм решения задач с расчётами по химическим уравнениям
Задача: Определи объём воздуха, необходимый для сжигания 24 г магния, содержащего 10 % негорючих примесей. 2Mg + O2 = 2 MgO. Составь уравнение реакции: ...Вопросы по химии
Выберите вопрос. СПИРТЫ 2 БАЛЛА. Функциональная группа, содержащаяся в спиртах:. а) -СО б) - ОН в) -СООН г) -NH 2. Вы выиграли 2 балла. Попробуйте ...Конспекты
Алканы. Гомологический ряд, изомеры, номенклатура, свойства и получение алканов Цели: Изучить алканы, как один из классов ациклических соединений
План учебного занятия №. 19. Дата Предмет. Химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . Тема. :. Алканы. Гомологический ряд, изомеры, ...Жиры, их состав и свойства. Биологическая роль жиров. Получение и применение жиров
Тема:. Жиры, их состав и свойства. Биологическая роль жиров. Получение и применение жиров. Цель:. Формировать знания учащихся о составе жиров, ...Обобщение знаний по классам неорганических соединений
Тема урока. . Обобщение знаний по классам неорганических соединений. ( урок для учащихся 8 классов по неорганической химии, изучаемый в разделе « ...Обобщение свойств основных классов неорганических соединений в свете теории электролитической диссоциации
Конспект урока химии. . 9 класс. Тема : «Обобщение свойств основных классов неорганических соединений в свете теории электролитической диссоциации». ...Валентность. Определение валентности элементов по формулам их соединений
Урок химии в 8 –м классе по теме:. «Валентность. Определение валентности элементов по формулам их соединений». Цели урока. Дидактические:. ...Валентность и степень окисления атомов. Периодичность в изменении свойств соединений элементов
План учебного занятия №4. . Дата Предмет. химия. группа. Ф.И.О. преподавателя:. Кайырбекова И.А. . І. Тема занятия:. . Валентность и степень ...Важнейшие классы неорганических соединений
МОУ Кинель – Черкасская средняя общеобразовательная школа № 1. «Образовательный центр». Конспект. . открытого урока по химии в 8 ...Важнейшие классы неорганических соединений
ГБОУ СОШ пос. Сургут муниципального района Сергиевский Самарской области . . ПЛАН-КОНСПЕКТ УРОКА. . по химии в 8 классе Важнейшие ...Важнейшие классы неорганических соединений
Урок – игра по теме: «Важнейшие классы неорганических соединений». Класс: 8. ФИО: Тимохина Алёна Владимировна. Должность: Учитель Химии. Место ...Важнейшие классы бинарных соединений – оксиды, их роль в природе и жизни человека
Урок химии в 8 классе по теме:. «Важнейшие классы бинарных соединений – оксиды, их роль в природе и жизни человека». Цели урока:. Предметные. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:21 февраля 2019
Категория:Химия
Содержит:24 слайд(ов)
Поделись с друзьями:
Скачать презентацию