Презентация "Начала термодинамики" по физике – проект, доклад
Презентацию на тему "Начала термодинамики" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 47 слайд(ов).
Слайды презентации
Список похожих презентаций
Первый закон термодинамики к изопроцессам
4. Изменение внутренней энергии системы происходит из-за: А) совершения работы Б) сообщению системе количества теплоты В) совершения работы и сообщению ...Первый закон термодинамики
Что надо выяснить:. Выполнение закона сохранения энергии в тепловых процессах. Как применить закон сохранения энергии к изопроцессам. Что такое адиабатный ...Первый закон термодинамики
Изучить закон сохранения энергии, распространённый на тепловые явления – первый закон термодинамики. Рассмотреть изопроцессы в газах с энергетической ...Первое применение начало термодинамики к экзопроцэссам
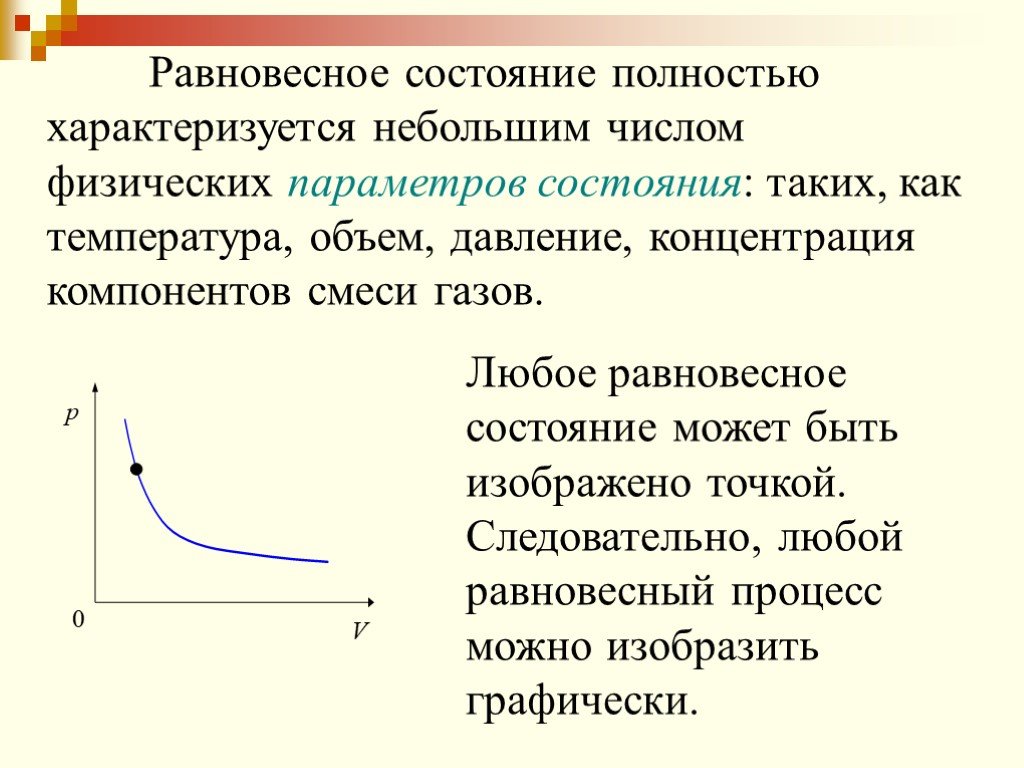
Изохорный процесс. Диаграмма этого процесса (изохора) в координатах изображается прямой, параллельной оси ординат (см. рис.), где процесс 2-1 есть ...Первый закон термодинамики
Изменение потенциальной энергии системы равно работе, совершаемой над системой при перемещении ее из одного места силового поля в другое. Внутренняя ...Основы термодинамики
Во всем мне хочется дойти До самой сути. В работе, в поисках пути, В сердечной смуте. « Основы термодинамики». Игра № 1. (Вопросы до 2 баллов.) 1. ...Основы термодинамики Решение задач
Цели урока:. Повторить основные формулы. Научиться применять полученные знания для решения задач. Провести анализ полученных результатов. Основные ...Второй закон термодинамики
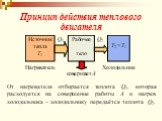
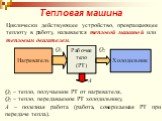
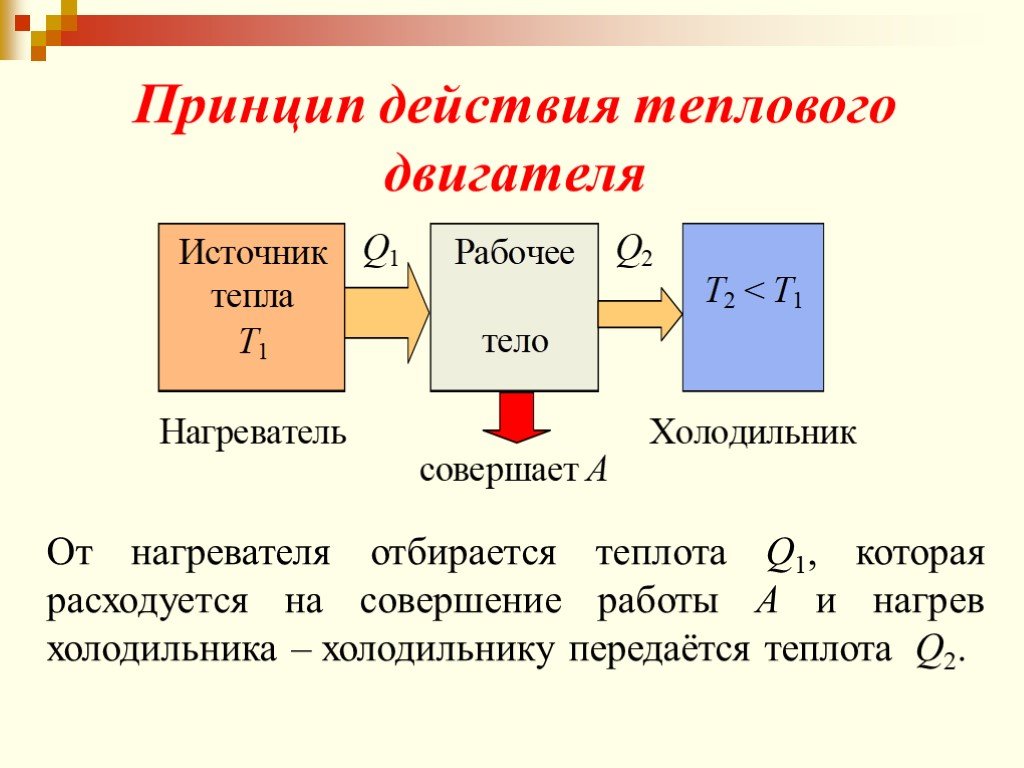
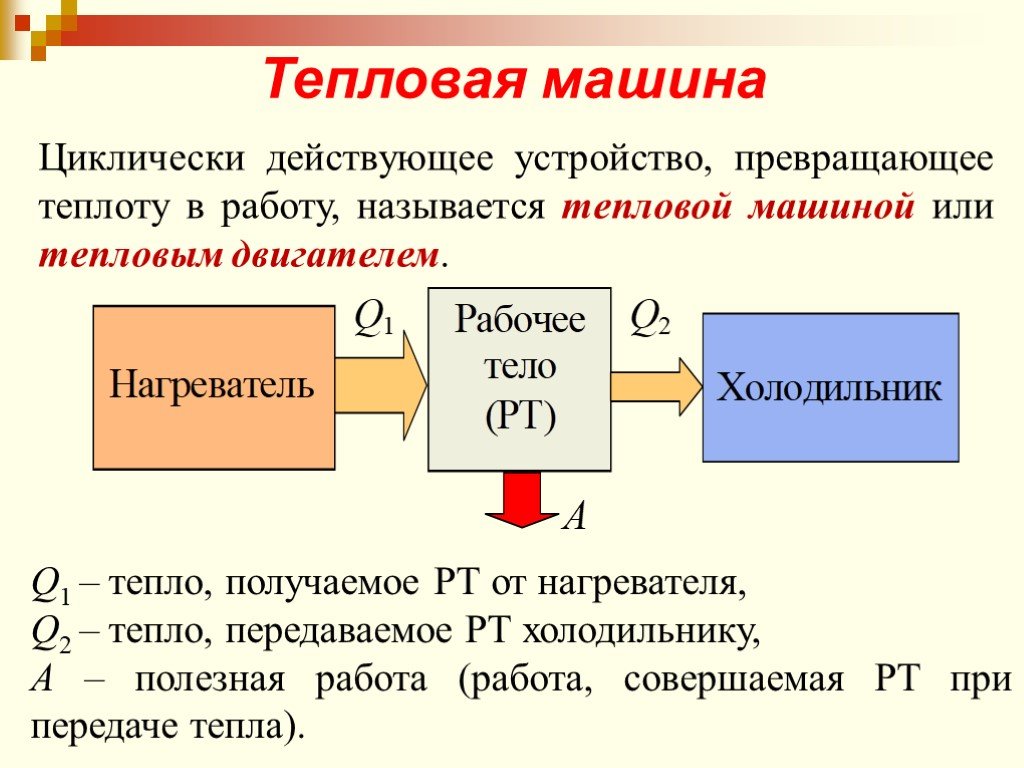
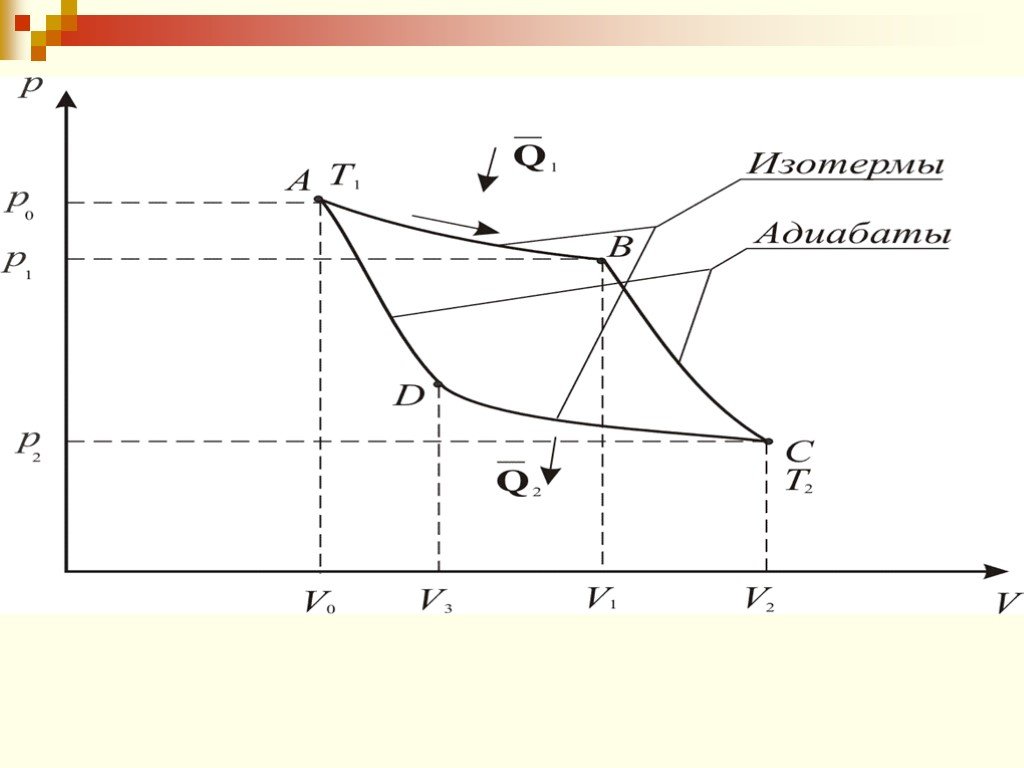
Цель занятия: знать второй закон термодинамики, принцип работы теплового двигателя. Уметь приводить примеры тепловых двигателей и определять КПД. ...Второй закон термодинамики
1. Два положения второго закона термодинамики. Различные формы передачи энергии неравноценны. Энергия теплового движения стремиться в большей степени, ...Второй закон термодинамики
Энергия и энтропия являются неотъемлемыми свойствами материи, причем энергия есть мера движения материи, а энтропия – мера рассеивания (деградации) ...Второй закон термодинамики
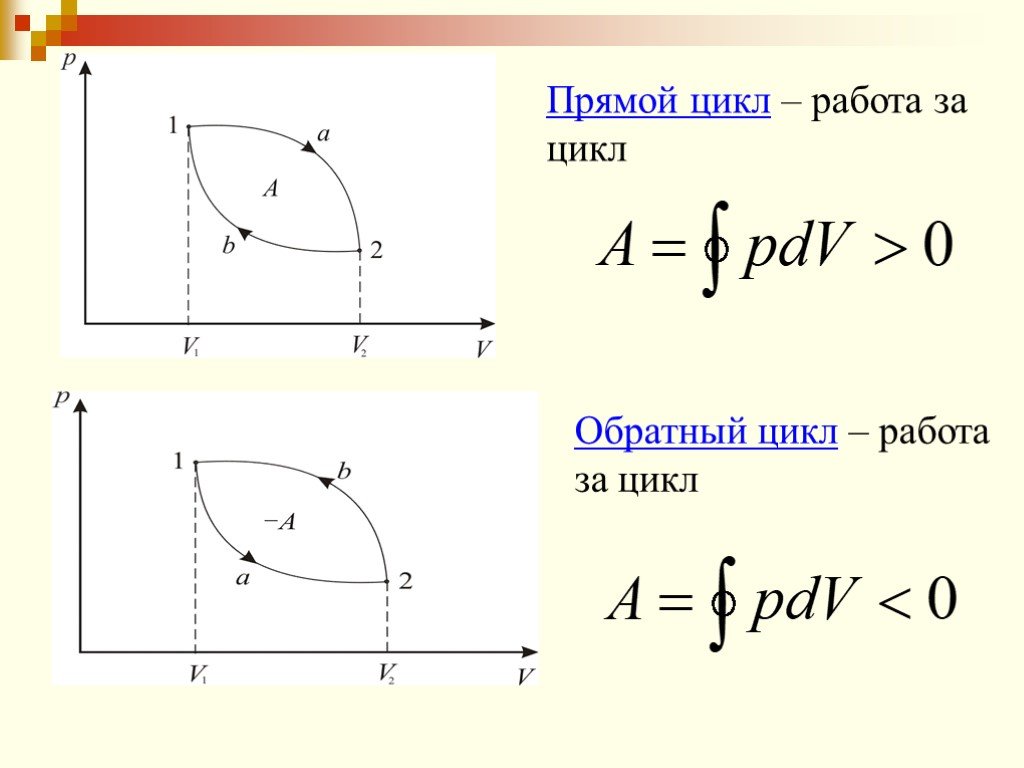
Обратимый процесс. Это процесс, который может происходить как в прямом, так и в обратном направлении Обратимый процесс – это идеализация реального ...Второе начало термодинамики
Используя понятие энтропии и неравенство Клаузиуса, второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы ...I закон термодинамики
Закон сохранения энергии. Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы ...14 2-е начало термодинамики
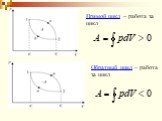
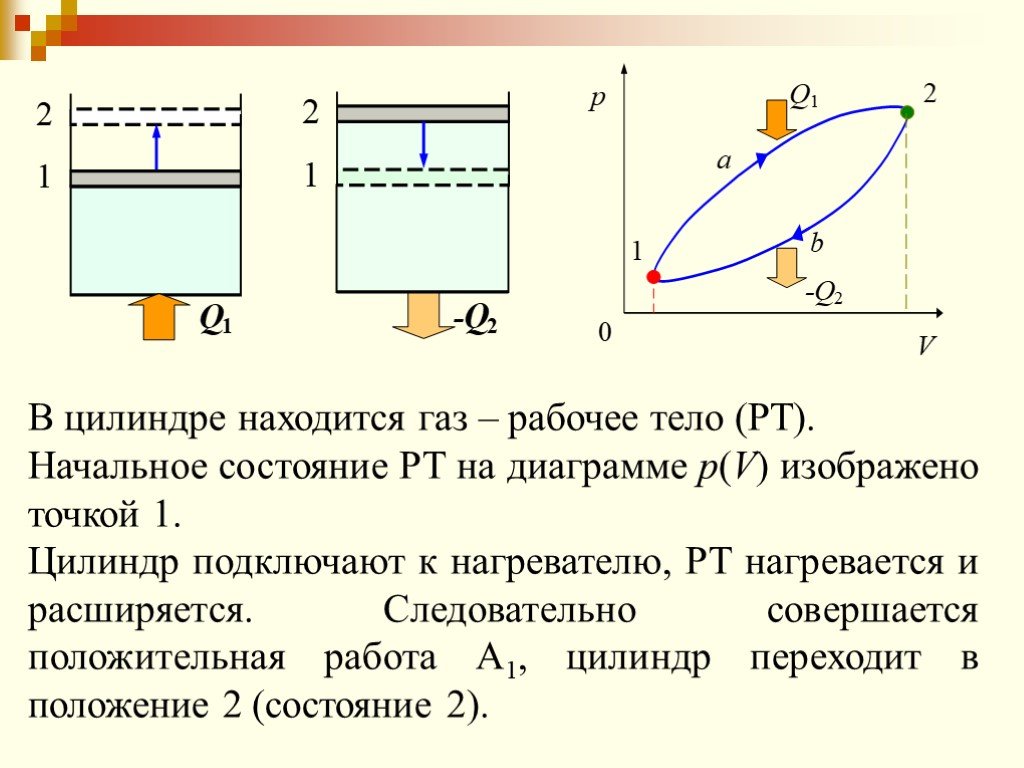
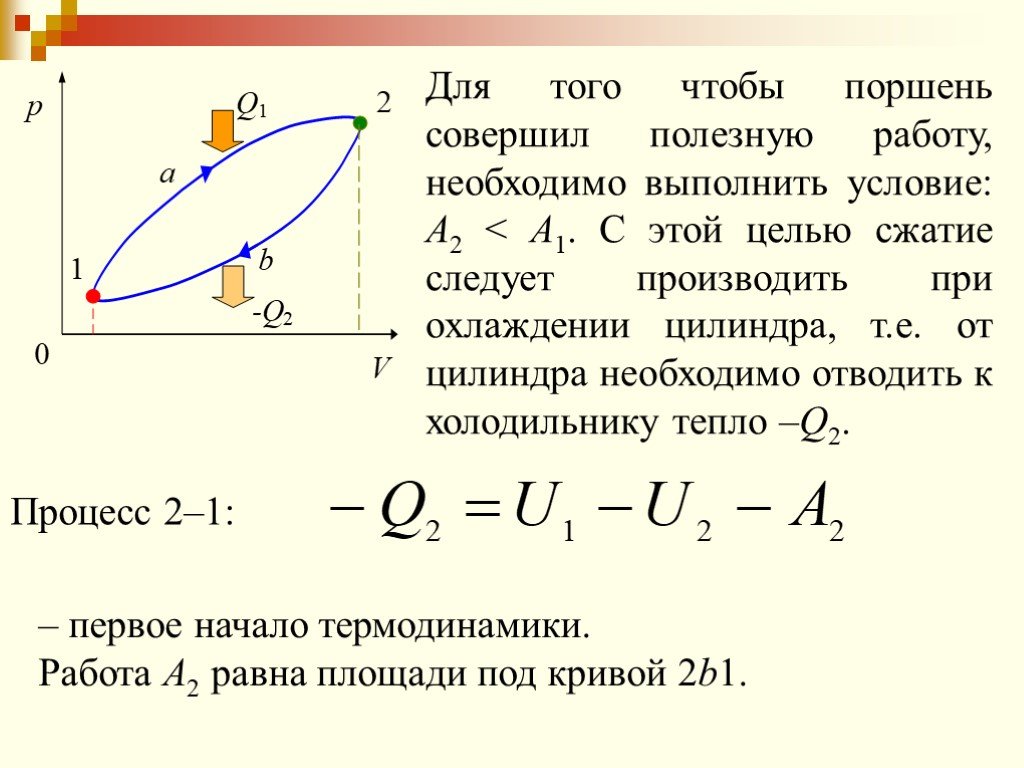
Изменение внутренней энергии рабочего тела за цикл равно нулю потому, что тело возвращается в исходное состояние. Следовательно, вся полученная теплота ...Применение первого закона термодинамики к изопроцессам
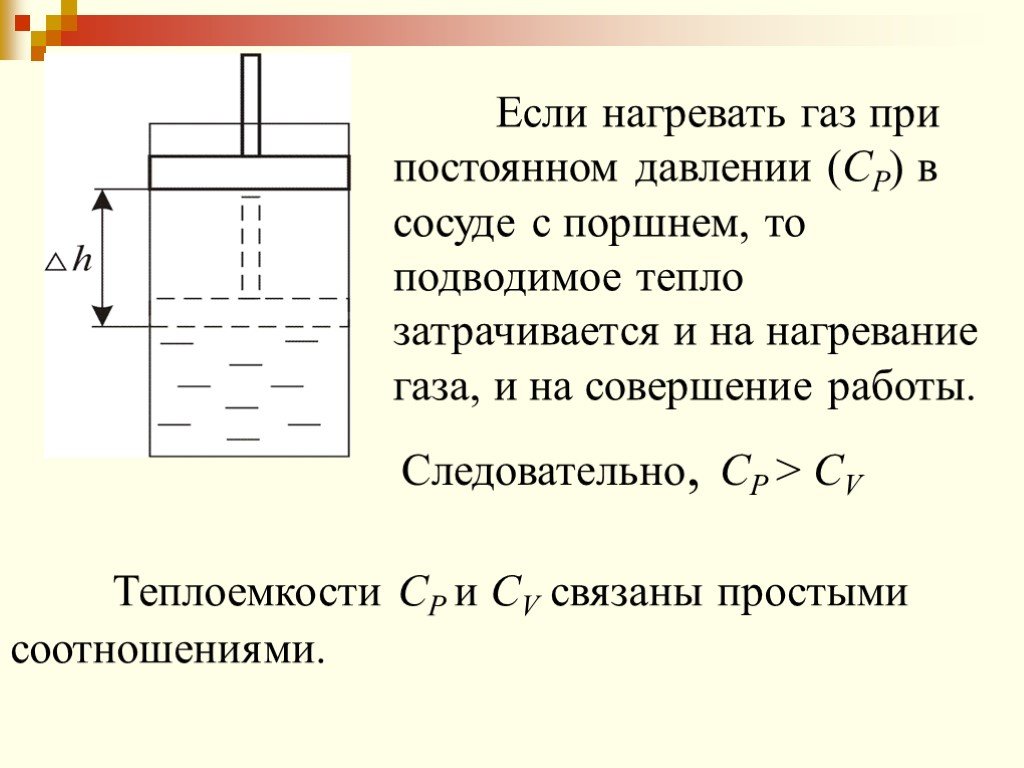
Внутренняя энергия газа зависит от температуры газа. Газ может совершать работу при любых происходящих с ним процессах. При изобарном расширении газ ...Законы термодинамики
Первый закон термодинамики постулирует существование внутренней энергии – некоторой функции состояния[1] , такой, что если к системе подводится тепло ...13 1-е начало термодинамики, теплоемкость, работа
Напомним: Функцией состояния. Так как все определяется изменением (производной) энергии, а энергия взаимодействия электронов внутренних оболочек с ...Законы термодинамики
НУЛЕВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. Нулевое начало термодинамики сформулированное всего около 50 лет назад , по существу представляет собой полученное «задним ...Основы термодинамики необратимых процессов
Основные понятия термодинамики. Термодинамическая система – совокупность тел, способных энергетически взаимодействовать между собой и с другими телами ...Законы термодинамики в геологических процессах
Внутренняя энергия. 1. Согласно первому закону термодинамики, все системы, находящиеся в одном и том же состоянии, имеют одну и ту же внутреннюю энергию, ...Конспекты
Первый закон термодинамики
Урок по теме «Первый закон термодинамики». 10 класс. Цели урока:. . образовательные:. ввести первый закон термодинамики как закон сохранения ...Исследование первого закона термодинамики к различным изопроцессам
Открытый урок по физике в 10 классе. Тема урока. «Исследование первого закона термодинамики к различным изопроцессам». Тип урока –. интегрированный, ...Первое начало термодинамики
. Урок разработала:. Свириденко Ольга Владимировна – учитель физики МОУ «СОШ р.п. Красный Текстильщик Саратовского района Саратовской области». ...Законы термодинамики
Урок рок физики по теме " Законы термодинамики". . Познавательные цели и задачи урока. Повторить и закрепить понятия: внутренняя энергия, тепловое ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 декабря 2018
Категория:Физика
Содержит:47 слайд(ов)
Поделись с друзьями:
Скачать презентацию





































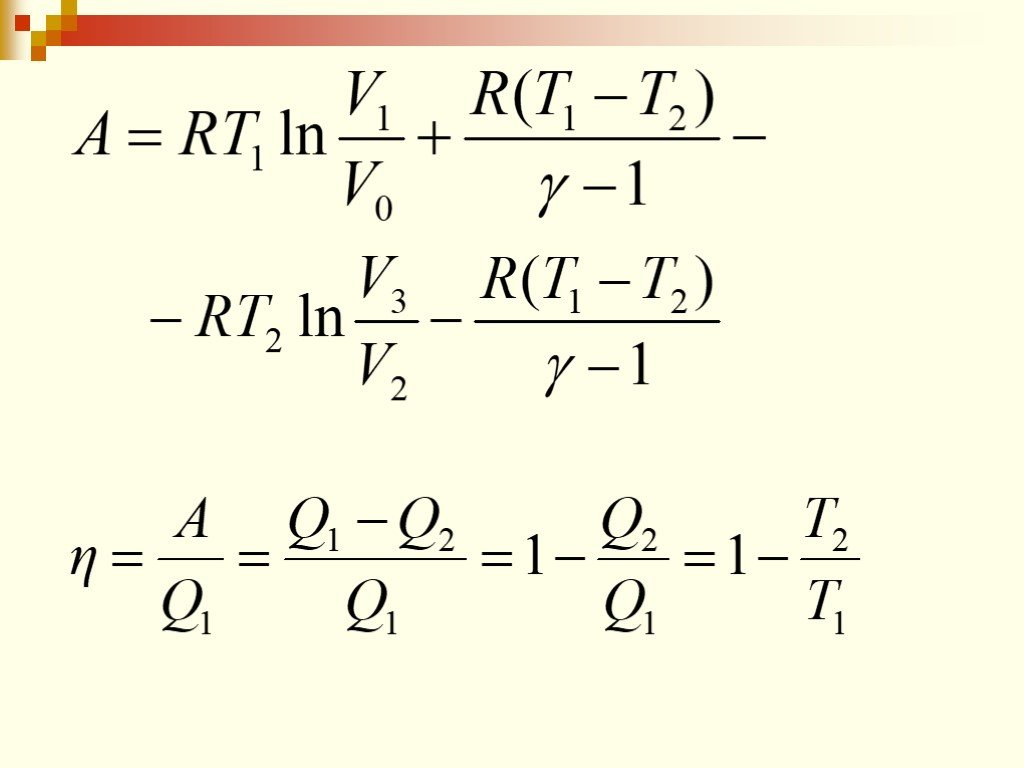










![Теплоемкость. Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус: Размерность теплоемкости: [C] = Дж/К. Удельная теплоёмкость (с) – количество теплоты, необходимое для нагревания единицы массы вещества на один градус. [с] = Дж/кг·К. Теплоемкость. Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на один градус: Размерность теплоемкости: [C] = Дж/К. Удельная теплоёмкость (с) – количество теплоты, необходимое для нагревания единицы массы вещества на один градус. [с] = Дж/кг·К.](https://prezentacii.org/upload/cloud/18/12/110902/images/thumbs/screen9.jpg)