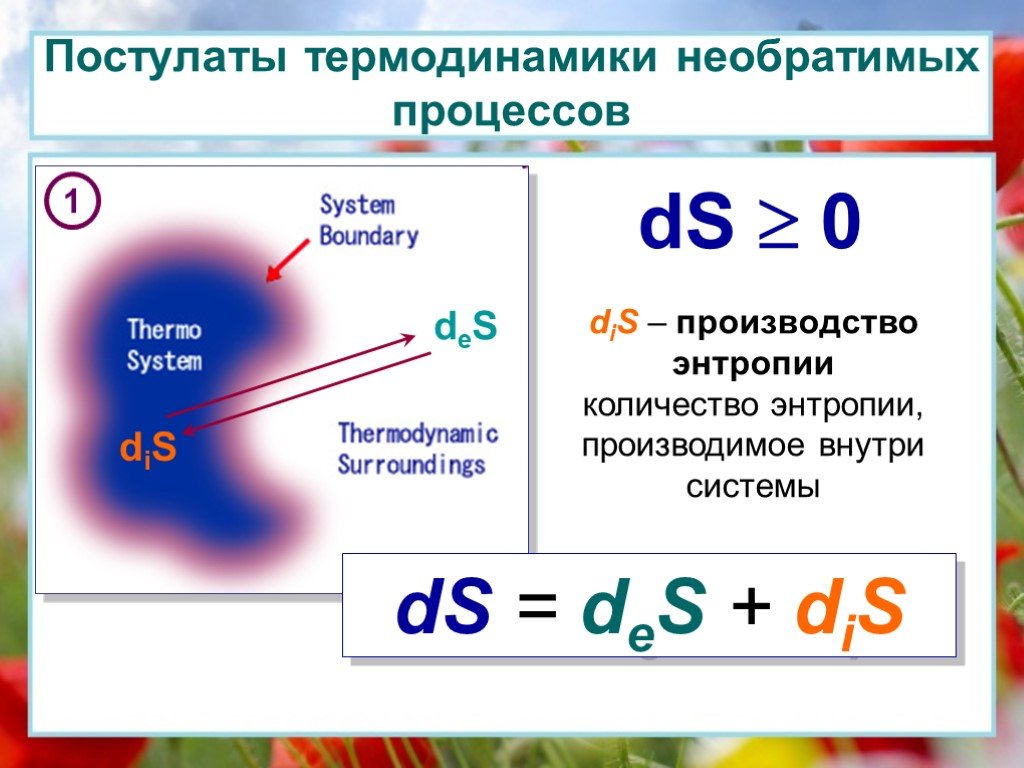
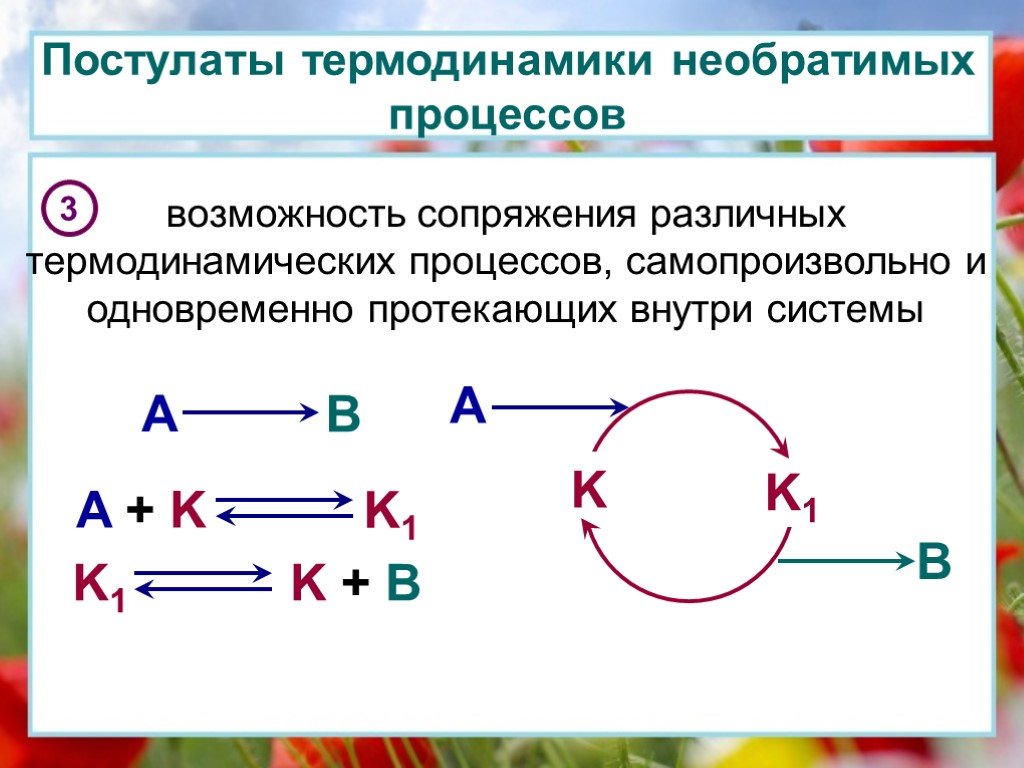
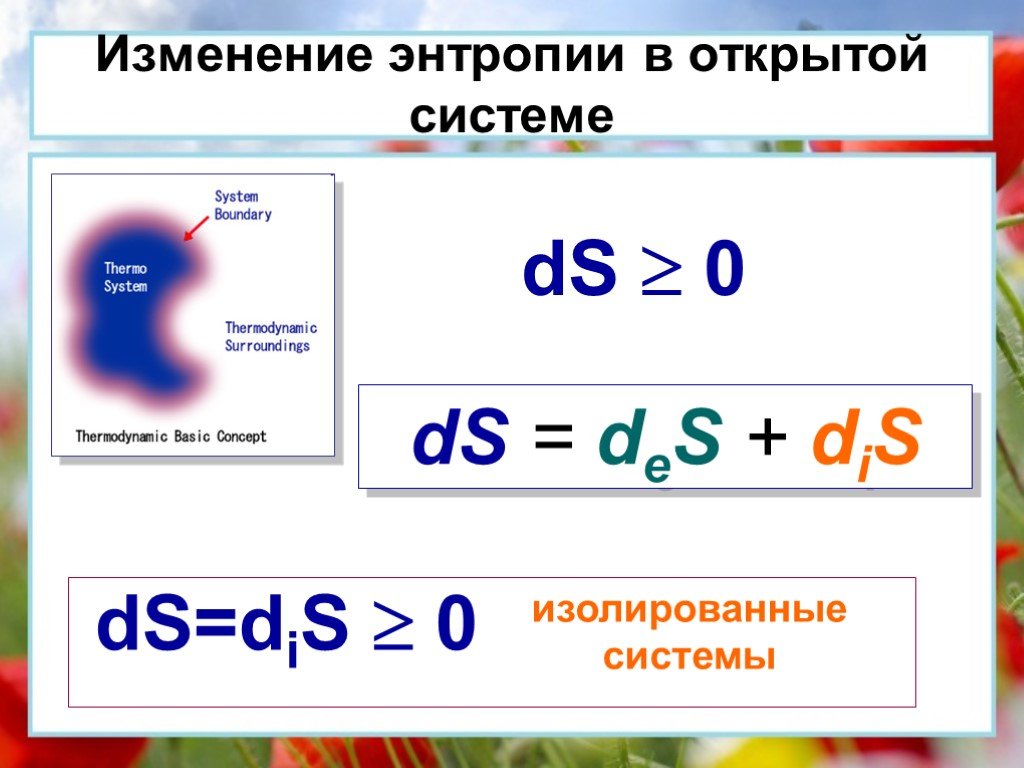
Презентация "Основы термодинамики необратимых процессов" по физике – проект, доклад
Презентацию на тему "Основы термодинамики необратимых процессов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 31 слайд(ов).
Слайды презентации
Список похожих презентаций
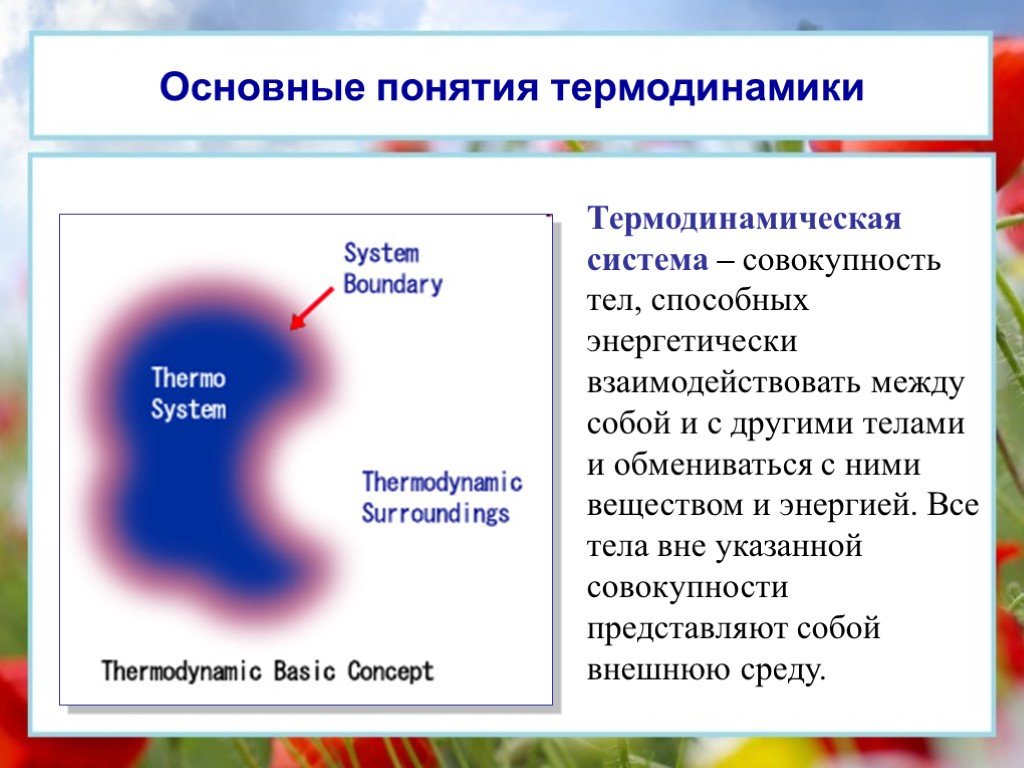
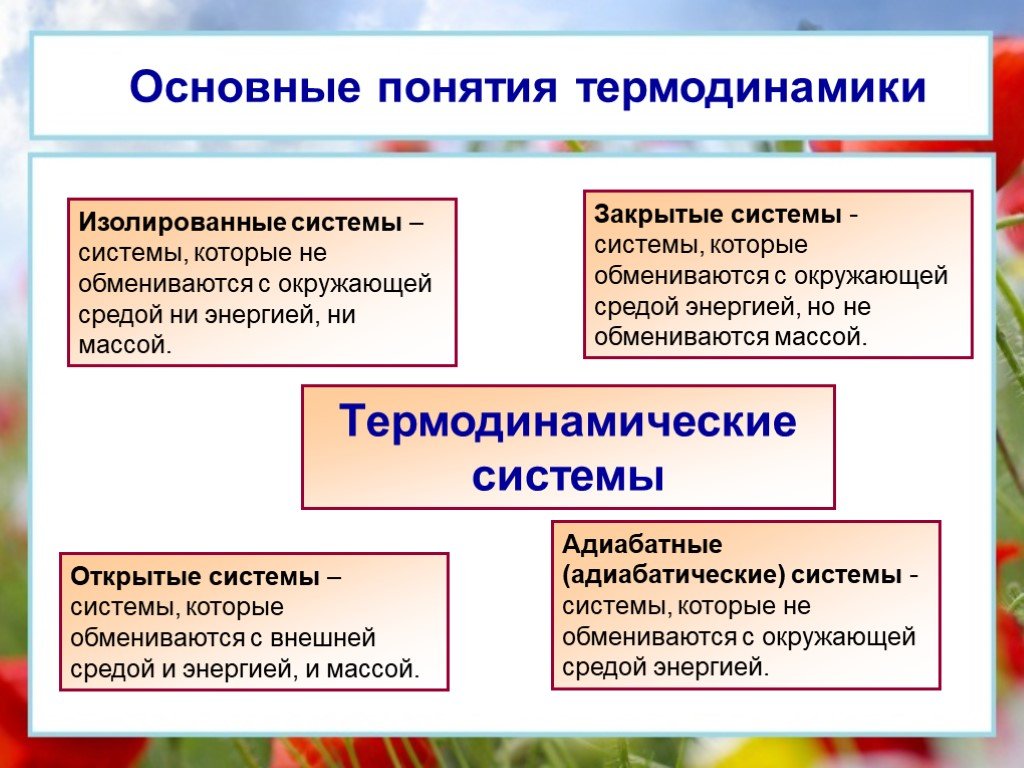
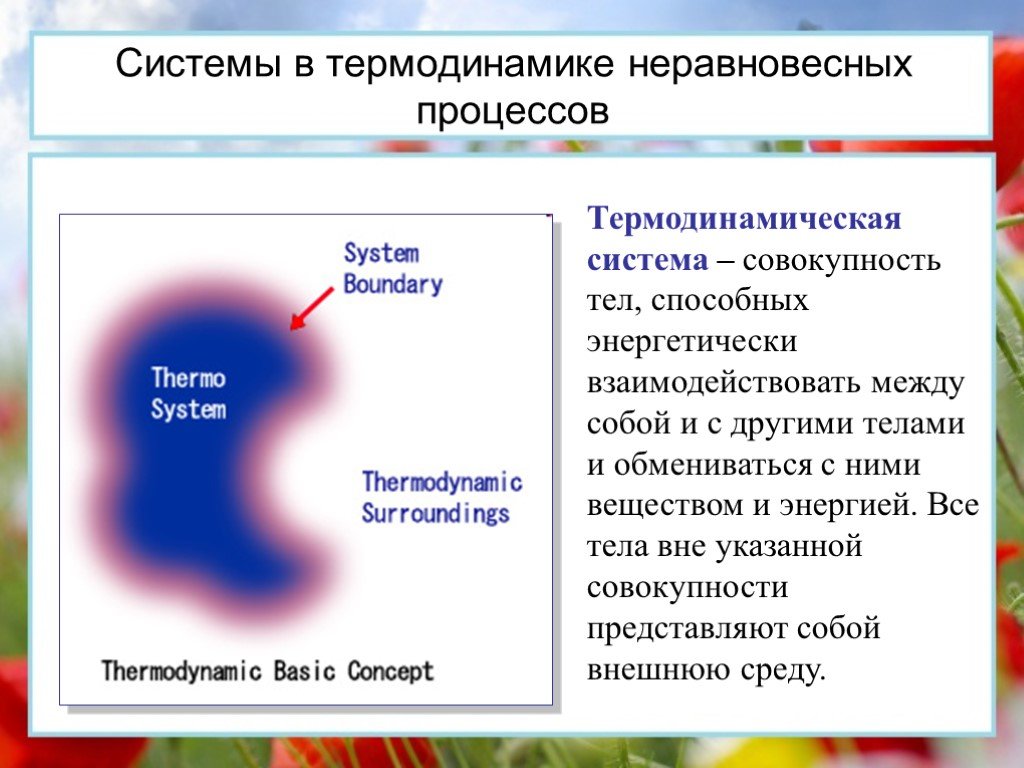
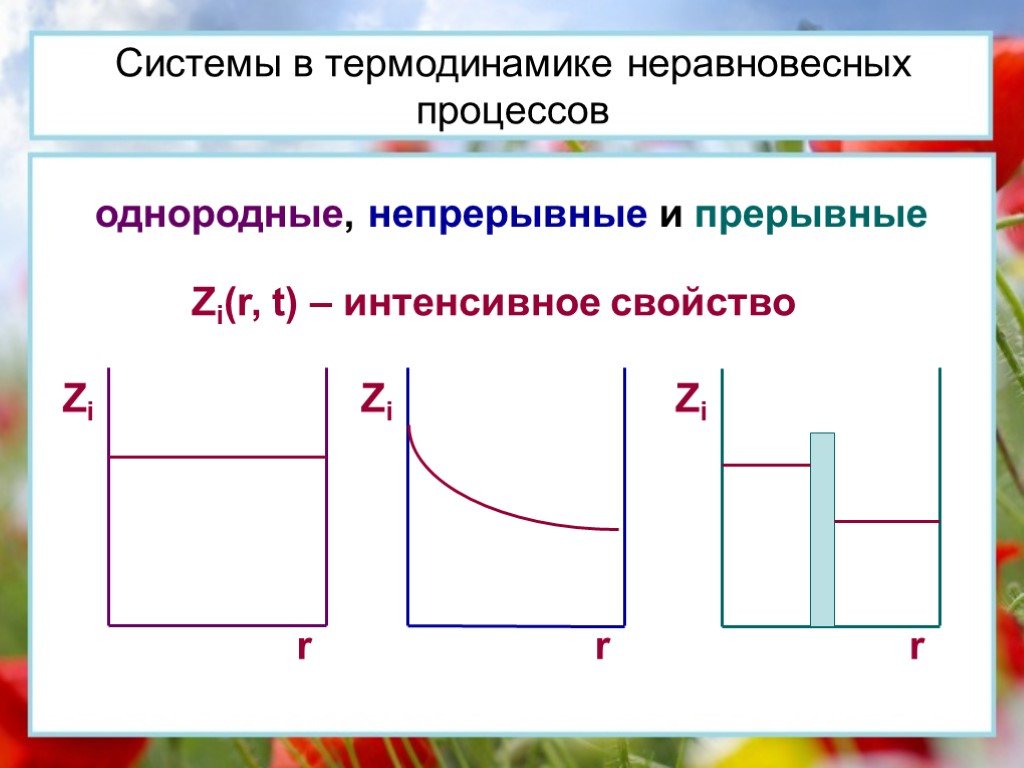
Основы термодинамики
Основы термодинамики Раздел физики, название которого происходит от греческих слов "терме" - "теплота" и "динамис" - "сила". Изучает он превращение ...Основы термодинамики
Во всем мне хочется дойти До самой сути. В работе, в поисках пути, В сердечной смуте. « Основы термодинамики». Игра № 1. (Вопросы до 2 баллов.) 1. ...Основы термодинамики
56 III ТЕРМОДИНАМИКА ТЕМА 5 Основы термодинамики. 1-ый закон ТД для изобарического процесса. 57 III ТЕРМОДИНАМИКА ТЕМА 5 Основы термодинамики. Исследование ...Основы термодинамики
Цели урока:. Сформировать основные понятия термодинамики Сформулировать первый закон термодинамики Рассмотреть принцип действия тепловых двигателей ...Основы термодинамики
Внутренняя энергия. Сумма кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул, атомов) и потенциальных ...Основы термодинамики Решение задач
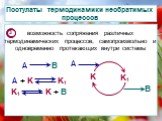
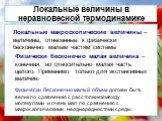
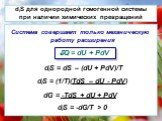
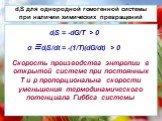
Цели урока:. Повторить основные формулы. Научиться применять полученные знания для решения задач. Провести анализ полученных результатов. Основные ...Обратимые и необратимые процессы. Необратимость тепловых процессов. Второй закон термодинамики
Закон сохранения энергии утверждает, что количество энергии при любых ее превращениях остается неизменным. Между тем многие процессы, вполне допустимые ...Основы структуры механизмов, структурный и кинематический анализ
ПЛАН ЛЕКЦИИ ТЕМА 1. Основы структуры механизмов, структурный и кинематический анализ Введение. Машина и механизм. Структура механизмов. Звено. Кинематическая ...13 1-е начало термодинамики, теплоемкость, работа
Напомним: Функцией состояния. Так как все определяется изменением (производной) энергии, а энергия взаимодействия электронов внутренних оболочек с ...Применение первого закона термодинамики к различным процессам
Науки юношей питают, Отраду старым подают, В счастливой жизни украшают, В несчастный случай берегут…. М. В. Ломоносов. ∆U=A+Q. Изменение внутренней ...Первый закон термодинамики в изопроцессах
Раскрыть физическое содержание первого закона термодинамики при рассмотрении конкретных изпроцессов , продолжить формирование умений описывать тепловые ...Первый закон термодинамики
Если в тексте не указано, то массой поршня можно пренебречь, так же как и теплоёмкостью поршня и сосуда в котором находится данный газ. Атмосферное ...Первое начало термодинамики
Вечный двигатель - воображаемое устройство, способное бесконечно совершать работу без затрат топлива или других энергетических ресурсов. Одна из древнейших ...Основы физики прочности и пластичности
Упругая и пластическая деформация монокристаллов. Теоретическое сопротивление сдвигу по Я.Френкелю. Теоретическое сопротивление сдвигу (продолжение). ...Из истории законов термодинамики
Каждый выдающийся исследователь вносит своё имя в историю науки не только собственными открытиями, но и теми открытиями, к которым он побуждает других. ...Законы термодинамики в геологических процессах
Внутренняя энергия. 1. Согласно первому закону термодинамики, все системы, находящиеся в одном и том же состоянии, имеют одну и ту же внутреннюю энергию, ...Законы термодинамики
НУЛЕВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. Нулевое начало термодинамики сформулированное всего около 50 лет назад , по существу представляет собой полученное «задним ...Законы термодинамики
Первый закон термодинамики постулирует существование внутренней энергии – некоторой функции состояния[1] , такой, что если к системе подводится тепло ...Графическое представление тепловых процессов
Задача №1. Какое количество теплоты потребуется, чтобы в алюминиевом чайнике массой 700г вскипятить 2кг воды? Начальная температура воды 200С. Алюминиевый ...Графическое представление газовых процессов
Графики газовых процессов изображают в координатах p,V; p,T; V,T. Перед построением графика следует получить аналитическое выражение функции процесса ...Конспекты
Направление процессов в природе. Хаос и порядок.2 закон Термодинамики
План карта. . Урок физики в 10 классе. Тема урока: Направление процессов в природе. Хаос и порядок.2 закон Термодинамики. Тип урока:. формирование ...Первый закон термодинамики
Урок по теме «Первый закон термодинамики». 10 класс. Цели урока:. . образовательные:. ввести первый закон термодинамики как закон сохранения ...Первое начало термодинамики
. Урок разработала:. Свириденко Ольга Владимировна – учитель физики МОУ «СОШ р.п. Красный Текстильщик Саратовского района Саратовской области». ...Основы электродинамики
Дата. 08.10.2014. класс. 11А предмет. физика. . . Тема раздела:. Основы электродинамики(продолжение). . . . . Тема. : Явление электромагнитной ...Основы молекулярно – кинетической теории
Цикл уроков физики в 10 классе. Тема: Основы молекулярно – кинетической теории (5 часов). В процессе работы над модулем вы должны изучить. :. ...Основы МКТ
Разработка открытого урока по физике в 10 классе по теме «Основы МКТ». Учитель Аверина С.Г. (2011-2012 уч.год). Цель. : проверить уровень усвоения ...Основы МКТ
Барышенская Е. Н. МОУ «Дубовская СОШ Белгородского района Белгородской области». . КОНТРОЛИРУЕМ ЗНАНИЯ УЧАЩИХСЯ. Барышенская Е. Н. Данный ...Основы механики
Игра. «Угадайка». по теме. «Основы механики». ( по принципу телевизионной игры «Угадай мелодию»). Правила игры:. 1,2 туры играются по нижеприведенным ...Основы кинематики и динамики
Основы кинематики и динамики. Вариант 1. Часть 1. В каком случае можно считать автомобиль материальной точкой? . 1)Автомобиль движется по ...Основы динамики Ньютона
Тематическая аттестация по физике, «Основы динамики Ньютона», 10 класс. . . Сколько вариантов зачётной работы используют преподаватели при тематической ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 марта 2019
Категория:Физика
Содержит:31 слайд(ов)
Поделись с друзьями:
Скачать презентацию