Слайд 1Тема: «Основные достижения иммунобиотехнологии.»
Выполнено : студенткой IV курса 6 группы медико-биологического факультета Гайдуковой К.А.
Слайд 2Введение.
В последние годы благодаря достижениям в области молекулярной и клеточной биологии удалось расшифровать многие механизмы патогенеза различных заболеваний, включая онкологические и аутоиммунные. В частности, удалось определить признаки злокачественного фенотипа: чувствительность в отношении ростовых сигналов, толерантность к рост-игибиторным сигналам, защита от программированной клеточной смерти (апоптоза), неограниченность репликативного потенциала, ангиогенез, тканевая инвазия и метастазирование. Появление этих данных явилось стимулом для поиска принципиально новых методов терапии, точечно, прицельно воздействующих на ключевые звенья патогенетической цепи патологического процесса, получивших в связи с этим общее название «таргетная терапия».

Слайд 3Иммунобиотехнология — это раздел современной биотехнологии, представленной как научными достижениями, так и динамично развивающимся технологическим производством диагностических, профилактических и лекарственных средств, с применением в качестве действующего начала разных агентов и процессов иммунной системы. Известно, что человек обладает иммунной системой для защиты от воздействия внешних неблагоприятных факторов, биологически активных агентов. В качестве таких агентов выступают клетки микроорганизмов, вирусы, белки, нуклеиновые кислоты, антибиотики, пестициды, объединенные под общим названием антигенов. Понятие «антиген» является общим, так как обозначает определенную химическую структуру, против которой могут быть получены антитела.
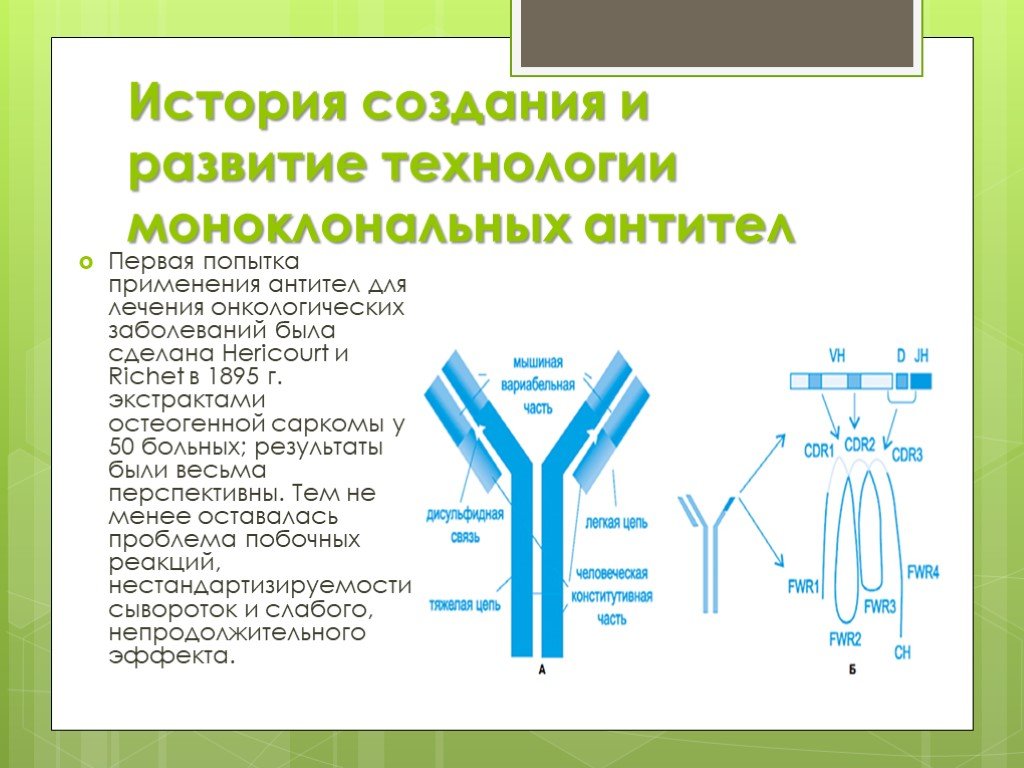
Слайд 4История создания и развитие технологии моноклональных антител
Первая попытка применения антител для лечения онкологических заболеваний была сделана Hericourt и Richet в 1895 г. экстрактами остеогенной саркомы у 50 больных; результаты были весьма перспективны. Тем не менее оставалась проблема побочных реакций, нестандартизируемости сывороток и слабого, непродолжительного эффекта.

Слайд 5Лечение антителами получило дальнейшее развитие в 70-х годах XX столетия. К этому времени уже было доказано, что образующиеся сывороточные антитоксины представляют собой иммуноглобулины; установлено, что продуцентом антител являются плазматические клетки. Исследователям Келеру и Мильштейну удалось разработать технологию получения особых клеточных линий, представляющих собой гибриды между нормальными антителопродуцирующими селезеночными клетками мыши и клетками мышиной миеломы. Разнородные клетки образуют двухъядерные гибриды, сохраняющие способность к клеточным делениям. Так возникает гибридома, структура продуцируемых ею антител абсолютно одинакова. Такие антитела называются моноклональными.

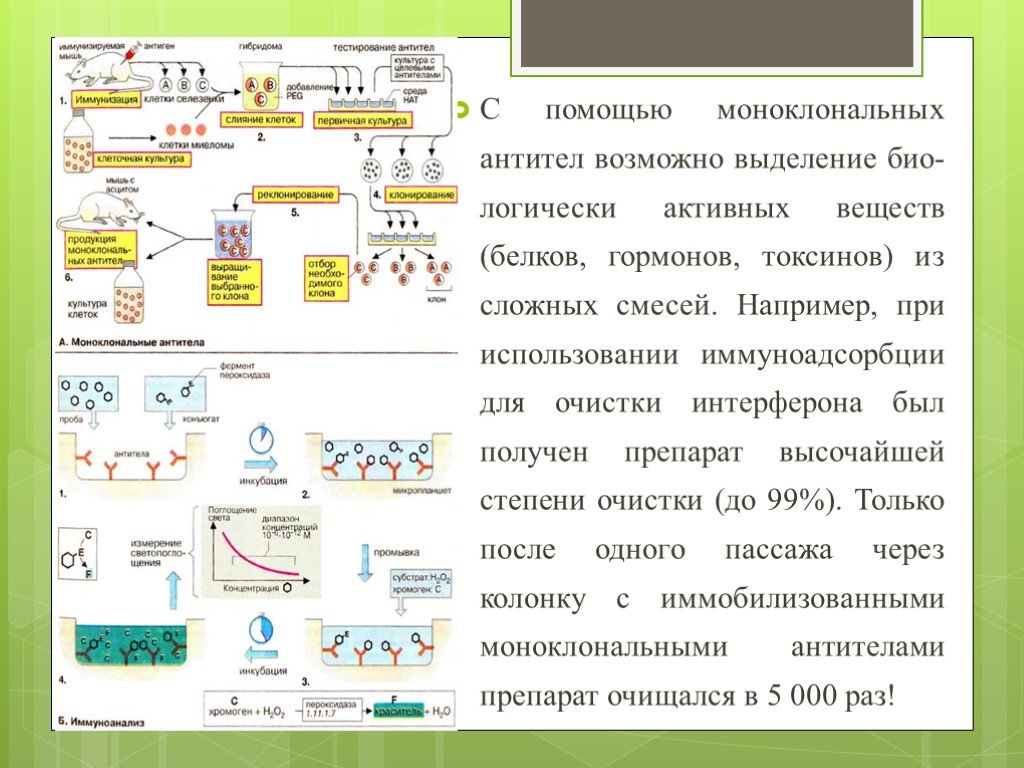
Слайд 6С помощью моноклональных антител возможно выделение био-логически активных веществ (белков, гормонов, токсинов) из сложных смесей. Например, при использовании иммуноадсорбции для очистки интерферона был получен препарат высочайшей степени очистки (до 99%). Только после одного пассажа через колонку с иммобилизованными моноклональными антителами препарат очищался в 5 000 раз!
Слайд 7Можно использовать моноклональные антитела и в качестве меток для точной идентификации специализированных клеток, например нейронов. Существует также технология использования моноклональных антител для изучения клеточных мембран, позволяющая выделять мембранные белки в чистом виде и измерять их биологическую активность. Моноклональные антитела можно использовать как в качестве стандартного реагента для обнаружения определенных молекул на клеточной мембране, так и для разделения популяции клеток, несущих на поверхности разные антигены.

Слайд 8Кроме того, с помощью моноклональных антител можно создавать высокоспецифичные вакцины, особенно против определенных вирусных штаммов и паразитов, Моноклональные антитела способны также к нейтрализации лимфоцитов, ответственных за отторжение трансплантата и аутоантител, образующихся при аутоиммунных заболеваниях (некоторые формы диабета, рассеянный склероз, ревматические болезни). В сочетании с лекарственными средствами они могут значительно усиливать эффективность действия последних на клетки-мишени, позволяя избегать серьезных побочных явлений, весьма обычных, например при химиотерапии рака.

Слайд 9Гуманизация антител
В 1980-х годах было проведено несколько исследований, показавших наличие аллергических реакций вплоть до анафилактического шока, недостаточную эффективность мышиных антител в реализации механизма уничтожения клетки-мишени. Получение человеческих антител и антител частично человеческого происхождения стало возможным после клонирования генов иммуноглобулинов и разработки генно-инженерных методов. Как в легких, так и в тяжелых цепях антител имеется константный регион и вариабельный регион, который непосредственно связывается с антигеном. Константный и вариабельный регионы независимо кодируются множеством генетических сегментов. Генно-инженерные технологии позволяют создавать гибридные антитела мышь/человек, различающиеся степенью «гуманизации». Наиболее ранней версией таких гибридных антител являются химерные антитела. В химерных антителах константные регионы имеют человеческое происхождение, а вариабельные получены от мыши. Типичный пример химерного антитела — ритуксимаб.

Слайд 10Второе поколение гибридных антител — гуманизированные антитела, в которых мышиное происхождение имеют только небольшие антигенсвязывающие участки вариабельных регионов. Гуманизированные антитела обладают слабой иммуногенностью. Типичным примером гуманизированного антитела является алемтузумаб. Как в химерных, так и в гуманизированных антителах участки, непосредственно связывающие антиген, получали от иммунизированных животных. В последнее десятилетие разработаны способы конструкции полностью человеческих антител, минуя этап иммунизации человека. Итак, сегодня, когда МАТ получают с помощью генно-инженерных способов, нередко минуя этап иммунизации, ключевым в определении термина «моноклональные антитела» является именно одинаковость антител, а не только моноклональность продуцирующих их В-клеток.

Слайд 11Моноклональные антитела в лечении онкологических заболеваний
В терапии опухолей используют два типа МАТ: простые, или неконъюгированные — МАТ, не связанные ни с какими цитотоксическими веществами; конъюгированные — МАТ, лечебный эффект которых обусловлен присоединенными к антителу веществами (радиоактивными частицами, цитостатиками или токсинами).
Слайд 12Простые моноклональные антитела
Большинство эффективно применяемых в онкологии МАТ — это простые МАТ. Они по-разному реализуют свое воздействие на злокачественную опухоль. Одни антитела, связываясь с соответствующим антигеном, запускают естественные механизмы иммунного ответа организма, которые разрушают опухолевые клетки. Другие МАТ не взаимодействуют собственно с иммунной системой человека. Их эффект реализуется через связывание с антигенами, обеспечивающими пролиферацию клеток или рост опухоли.

Слайд 13Механизм действия антител можно рассмотреть на примере алемтузумаба (Кэмпаса) — препарата для терапии хронического лимфолейкоза. Вариабельный регион алемтузумаба соединяется с антигеном CD52 на поверхности лимфоцитов, а константный регион — с Fc-рецепторами на поверхности цитотоксических клеток, которые уничтожают мишень (ADCC — антителозависимая клеточно-опосредованная цитотоксичность). Кроме того, Кэмпас активирует систему комплемента, что приводит к образованию комплекса, разрушающего мембрану злокачественной клетки (CDC — комплемент-зависимая цитотоксичность). Именно эти два механизма, а также индукция апоптоза считаются основными в действии данных антител.

Слайд 14Моноклональные антитела как носители активных веществ
В последние годы МАТ стали применяться для доставки цитотоксических веществ непосредственно к опухолевым клеткам, что позволяет избежать повреждения здоровых тканей, решает проблему, связанную со слабым противоопухолевым эффектом некоторых антител из-за невозможности проникать глубоко в ткань солидной опухоли. В зависимости от активного вещества, присоединенного к антителу, конъюгированные МАТ подразделяют на следующие группы: с радиоактивными частицами (этот вид терапии также получил название радиоиммунотерапии); с цитостатиками; с токсинами (или иммунотоксинами). В настоящее время для терапии опухолей в мире зарегистрировано только два моноклональных антитела, соединенных с радиоактивными частицами.

Слайд 15Перспективы развития технологии МАТ в лечении онкологических заболеваний
С каждым годом МАТ все более активно применяются в лечении онкологических заболеваний. Противоопухолевые антитела составляют 50% объема рынка всех продаваемых препаратов МАТ; для сравнения: 37% рынка занимают антитела для коррекции аутоиммунных/воспалительных нарушений, 11% — МАТ для лечения заболеваний органов дыхания и 2% — для сердечно-сосудистых. Этот разрыв будет возрастать и дальше, так как из 400 исследований, которые ведутся сейчас с МАТ, около 250 составляют исследования в области онкологии: у больных раком молочной железы, раком яичников, колоректальным раком, у пациентов с лимфомами и немелкоклеточным раком легкого.

Слайд 16Однако несмотря на успехи МАТ, у этой технологии есть свои ограничения. МАТ — слишком крупные молекулы, неспособные проникать внутрь клетки или глубоко в ткани. Их нельзя применять перорально. Технологии производства МАТ по-прежнему очень дороги, что сказывается на стоимости лекарственных препаратов. И все же у МАТ есть несколько важных свойств: высокая избирательность действия при низкой токсичности и способность активировать иммунную систему на борьбу с опухолевыми клетками. Целый ряд биотехнологических и фармацевтических компаний сегодня работает над созданием МАТ-технологий нового поколения, объединяющих в себе преимущества МАТ и низкомолекулярных препаратов, обладающих высокой специфичностью и низкой токсичностью, возможностью воздействовать на объекты, нераспознаваемые современными МАТ, в том числе на активные центры ферментов и рецепторов. Такие МАТ обладают более высокой стабильностью, что допускает возможность их перорального, ингаляционного или местного применения.

Слайд 17Использование моноклональных антител в качестве терапевтических агентов явилось для медицины стратегическим этапом в смене концепции лечения – от неспецифической к специфической (таргетной) терапии. Разработка моноклональных антител направлена на идентификацию и взаимодействие получаемых агентов со специфическими клеточными мишенями или сигнальными путями, что в итоге должно приводить к клеточной смерти с помощью различных механизмов. Моноклональные антитела, в отличие от традиционных препаратов, высокоспецифичны к определенным мишеням. На сегодняшний день они наиболее активно используются в онкогематологии и лечении солидных опухолей и аутоиммунных заболеваний. Ранее основное внимание уделялось цитолитическому действию моноклональных антител путем стимуляции иммунного ответа. В последнее время основное внимание сосредоточено на ключевых мишенях, участвующих в регуляции роста опухолевых клеток и направленной доставке цитотоксических агентов. В настоящее время показано, что используемые терапевтические антитела помимо прямого действия выполняют иммуноопосредованные эффекторные функции, включая антителозависимую и комплемент-зависимую цитотоксичность.

Слайд 18Химерные антитела
Химерные антитела (chimaeric antibodies) - искусственные антитела, в которых константная часть мышиных антител замещена соответствующей константной областью иммуноглобулина человека. Поскольку большая часть антигенных детерминант молекулы иммуноглобулина находится в константных доменах и с ними же связаны основные эффекторные функции (взаимодействие с Fc-рецепторами, системой комплемента и др.), становится понятным, что использование химерных иммуноглобулинов мышь/человек должно обусловить практически нормальное их взаимодействие с иммунной системой человека при сохранении специфичности и сродства к антигену мышиных моноклональных антител. В настоящее время получены тысячи линий мышиных гибридом. В условиях быстро прогрессирующих методов генной инженерии рекомбинантная "хирургия" представляется весьма перспективной. Для этого требуется ограниченный набор С-генов человека, который достаточно будет сочетать с конкретными V-генами мыши. Для экспрессии "химерных" антител приходится использовать системы, основанные на эукариотических клетках, поскольку только в них возможна правильная сборка молекулы и корректное гликозилирование, необходимое для выполнения антителами эффекторых функций.

Слайд 19Гибридома
Гибридома (hybridoma): клетка , получающаяся в результате сплавления В-клетки , продуцирующей антитела , и опухолевой клетки. Такие клетки могут быть клонированы и поддерживаться длительное время в культуре, продуцируя моноклональные антитела . Клетки гибридомы можно также инъецировать мыши, в результате чего образуются асциты , содержащие моноклональные антитела . Методика, позволяющая получать клеточные линии (гибридомы), секретирующие отдельные разновидности антител ( моноклональные антитела ) с желаемой антигенной специфичностью была описана в 1975 году. Это открытие определило бурный прогресс в использовании антител как для исследовательских, так и для практических целей, и в настоящее время "гибридомная технология" является одним из основных направлений в биотехнологии. Обычно при иммунизации в ответ на антиген происходит синтез различных антител , т.е. антисыворотка гетерогенна. Метод гибридизации соматических клеток позволил получать клоны гибридных клеток, гибридом, продуцирующих идентичные антитела к одной антигенной детерминанте, т.е. моноклональные антитела. Продуцентами антител являются лимфоциты , причем различные лимфоциты образуют разные антитела. Однако лимфоциты характеризуются ограниченным сроком жизни в культуре. С другой стороны, известны злокачественные опухоли, миеломы, вырабатывающие большие количества аномальных иммуноглобулинов. Клетки миеломы хорошо размножаются в культуре и представляют собой " бессмертные" линии . Задача заключалась в том, чтобы выделить клоны клеток, продуцирующих один тип антител и при этом способных неограниченно долго размножаться. Впервые гибридомы, образованные слиянием культивируемых клеток миеломы с клетками селезенки иммунизированной мыши, были получены Келером и Мильштейном [ Kohler, 1975 ].

Слайд 20Использование клеток миеломы, мутантных по гену ГФРТ , позволило для выделения клонов применить среду HAT . В настоящее время метод получения гибридом с различными модификациями используется для того, чтобы иметь моноклональные антитела к различным антигенам. Клоны, продуцирующие моноклональные антитела, могут быть размножены и заморожены. При введении их сингенным животным образуются асцитные опухоли, содержащие большие количества моноклональных антител. Такая возможность получения различных моноклопальных антител в настоящее время широко используется для решения многих задач практической медицины, в частности, в целях диагностики. Гибридомы являются бессмертными клеточными клонами, продуцирующие антитела одной специфичности. Полученные при слиянии нормальных лимфоцитов , продуцирующих антитела, с подходящей опухолевой линией B-клеток, гибридомы отбирают в культуральной среде, неспособной поддерживать рост родительских клеток. Путем последовательных разведений и пересевов получают одиночные клоны, которые можно выращивать в роллерных культурах или в форме асцита в брюшной полости мышей. В последнем случае удается получать особенно высокие титры моноклональных антител. При этом, естественно, все молекулы иммуноглобулинов , продуцируемые определенной гибридомой, идентичны: они относятся к одному классу и одному аллотипу , имеют одинаковые вариабельные области , структуру, идиотип , афинность и специфичность к данному эпитопу .

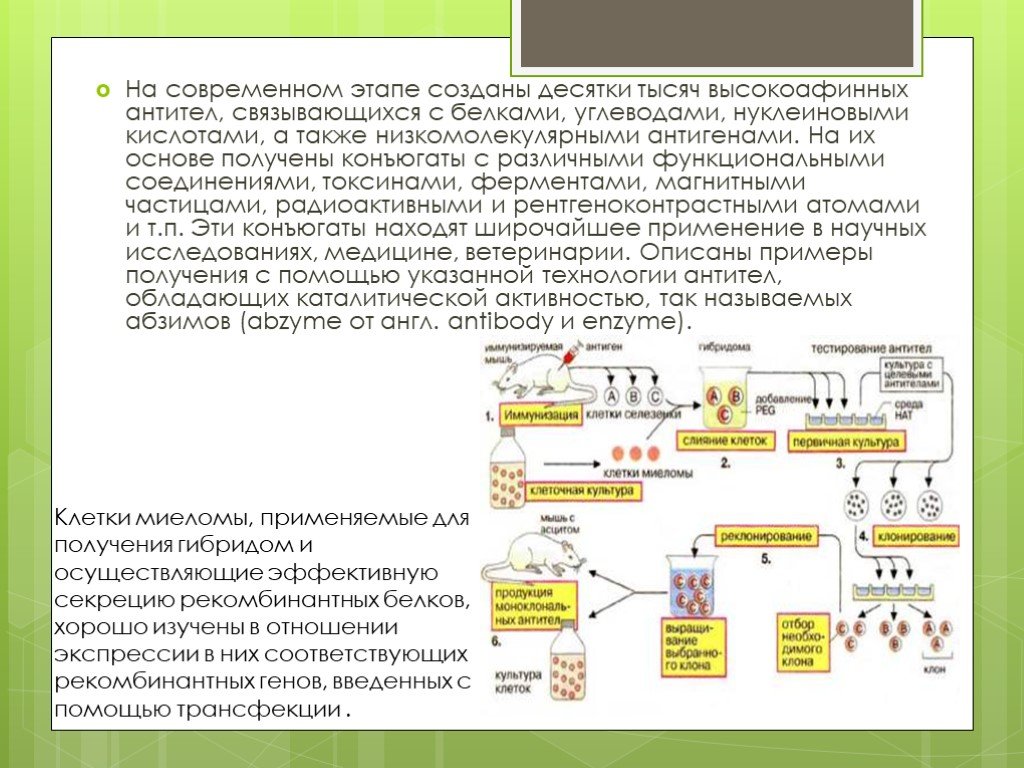
Слайд 21Клетки миеломы, применяемые для получения гибридом и осуществляющие эффективную секрецию рекомбинантных белков, хорошо изучены в отношении экспрессии в них соответствующих рекомбинантных генов, введенных с помощью трансфекции .
На современном этапе созданы десятки тысяч высокоафинных антител, связывающихся с белками, углеводами, нуклеиновыми кислотами, а также низкомолекулярными антигенами. На их основе получены конъюгаты с различными функциональными соединениями, токсинами, ферментами, магнитными частицами, радиоактивными и рентгеноконтрастными атомами и т.п. Эти конъюгаты находят широчайшее применение в научных исследованиях, медицине, ветеринарии. Описаны примеры получения с помощью указанной технологии антител, обладающих каталитической активностью, так называемых абзимов (abzyme от англ. antibody и enzyme).

Слайд 22Квадромы
Следующим этапом развития гибридомной технологии после получения гибридом стало получение " квадром " - клеточных линий, получаемых в результате слияния двух гибридом, продуцирующих антитела разной специфичности. В результате удается создать клетки, секретирующие бифункциональные иммуноглобулины, имеющие в одной молекуле два разных по специфичности центра связывания антигена и обладающие таким образом сродством к двум различным антигенам. Все упомянутые выше антитела и их производные широко используются главным образом для целей диагностики и биотехнологии. Их применение для терапии и диагностики in situ ограничивается тем, что в основном с помощью гибридомной технологии удается получить молекулы мышиных иммуноглобулинов, которые вызывают у человека иммунный ответ, что приводит к их нейтрализации. Именно это обстоятельство инициировало поиск путей снижения иммуногенности мышиных моноклональных антител путем удаления отдельных фрагментов или замены их на аналогичные участки иммуноглобулинов человека. B результате генно- инженерных манипуляций с иммуноглобулиновыми генами были получены химерные антитела и "замещенные" антитела . Другим перспективным подходом для решения проблем, обусловленных применением мышиных антител в организме человека может стать использование " минимальных антител ."

Слайд 23Замещенные антитела
"Замещенные" антитела ("reshaped" Ab) представляют собой конструкции, в которых лишь непосредственно контактирующие с антигеном участки вариабельных доменов (CDR) взяты у мышиных антител, а все остальное - включая каркасные участки V-доменов - человеческого происхождения. Они обладают еще более низкой, чем химерные антитела , иммуногенностью.

Слайд 24Минимальные антитела.
Другим перспективным подходом для решения проблем, обусловленных применением мышиных антител в организме человека может стать использование не целой молекулы антитела, а лишь ее части, отвечающей за связывание чужеродного антигена. Такие "минимальные антитела", или Fv- фрагменты, из-за малого размера легче проникают в опухолевую ткань и в то же время обладают пониженной иммуногенностью. В отличие от "химерных", для наработки "минимальных" антител используются дешевые и биотехнологичные бактериальные продуценты. Среди этой группы молекул выделяют: одноцепочечные антитела (single chain Ab. sc Fv-fragments), которые получают в результате экспрессии V(H) и V(L)-участков, соединенных олигонуклеотидом, кодирующим гибкий гидрофильный пептид (наиболее часто (Gly4Ser)3-4); Fv-фрагменты - нековалентно ассоциированные гетеродимеры V(H) и V(L) -доменов. Они менее стабильны, чем sc-Fv-фрагменты. Промежуточное положение между первыми и вторыми занимают конструкции, имеющие специально введенные в область контакта доменов дисульфидные связи. V -домены (domain antibody, dAb) - вариабельные домены тяжелых цепей. Применение основано на часто встречающемся свойстве отдельного вариабельного домена тяжелой цепи сохранять специфичность и высокое сродство (10% и выше от сродства исходного полноразмерного антитела) к антигену. минимальные узнающие пептиды (minimal recognition units, m.r.u.) - наименьшие молекулы, сохраняющие способность связывать антиген, а именно аналоги CDR-участков вариабельных доменов.

Слайд 25Рекомбинантные иммунотоксины и иммуноферменты
Рекомбинантные иммунотоксины и иммуноферменты получают в результате экспрессии иммуноглобулиновых генов, соединенных с генами токсинов или ферментов. В зависимости от размера фрагмента иммуноглобулинового гена различают, например, sc-Fv-токсин или Fab- токсин. Основные достоинства - воспроизводимость и биотехнологичность препаратов (в отличие от традиционных коньюгатов), а также значительно меньший размер получаемых молекул, что является принципиальным для использования в случае ряда заболеваний.

Слайд 26Иммуноадгезины
Иммуноадгезины (immunoadhesins) обычно состоят из Fc-фрагмента молекулы антитела и лиганда, специфичного к определенному рецептору, например CD4 . Такая молекула за счет CD4-фрагмента будет связываться с белком gp120 на поверхности клеток, инфицированных вирусом иммунодефицита человека , и за счет Fc-фрагмента вызывать их уничтожение посредством антителозависимой клеточной цитотоксичности или действия системы комплемента.

Слайд 27Абзимы
Абзимы (англ. abzyme, antibody enzyme) — каталитически активные антитела. В широком смысле термином «абзимы» обычно называют моноклональные каталитически активные антитела, обладающие свойствами ферментов — то есть катализирующие определенные химические реакции. Природные и искусственные каталитически активные антитела Абзимы, как правило, представляют собой искусственные моноклональные антитела. Природные каталитически активные антитела выделены из крови пациентов с различными аутоиммунными (системная красная волчанка, аутоиммунный тиреоидит, рассеянный склероз, астма, СПИД) инфекционными (вирусными, бактериальными) заболеваниями, а также из крови и молока здоровых по медицинским показанями рожениц. Показаны два основных механизма происхождения каталитических активностей антител. Согласно первому механизму, активные центры антител могут имитировать переходные состояния соответствующих химических реакций. По второму механизму, называемому Антиидиотипической сетью Эрне, активные центры антител представляют собой антиидиотипы активных центров других антител (которые в таком случае являются антигенами). Показано образование антиидиотипических антител до седьмого порядка.

Слайд 28Список литературы.
1. Биотехнология: Принципы и применение / под редакцией И. Хиггинса, Д. Беста, Дж. Джойса; пер. с англ.- М.: Мир, 1998, стр.45-82. 2. Биотехнология: Учебное пособие для вузов / Под ред. Егорова. – М.: 1987. 3. Михайлов И.Б. Клиническая фармакология / И.Б. Михайлов. – СПб., 1998. – 473с. 4. Основы фармацевтической биотехнологии: Учебное пособие / Т.П. Прищеп, В.С. Чучалин, К.Л. Зайков, Л.К. Михалева. – Ростов-на-Дону.: Феникс; Томск: Издательство НТЛ, 2006. 5. Промышленная технология лекарств: в 2-х томах / Под ред. В.И. Чуешова. - Харьков: НФАУ, МТК – книга, 2002. 6. Сазыкин Ю. О. Биотехнология: учебное пособие для студентов высш. учеб. заведений / Ю.О. Сазыкин, С. Н. Орехов, И.И. Чакалева; под ред. А.В. Катлинского. – 3-е изд., стер. – М.: Издательский центр «Акаде-мия», 2008. 7. Северин С.Е. Биохимия и медицина – новые подходы и достижения / С. Е. Северин. – М: Русский врач, 1998. – 94с 8. Современная микробиология: в 2-х томах / Под ред. Г. Шлегеля: Пер. с англ. – М.: Мир, 2002.