Презентация "Неорганические полимеры" по химии – проект, доклад
Презентацию на тему "Неорганические полимеры" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 48 слайд(ов).
Слайды презентации
Список похожих презентаций
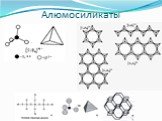
Неорганические полимеры
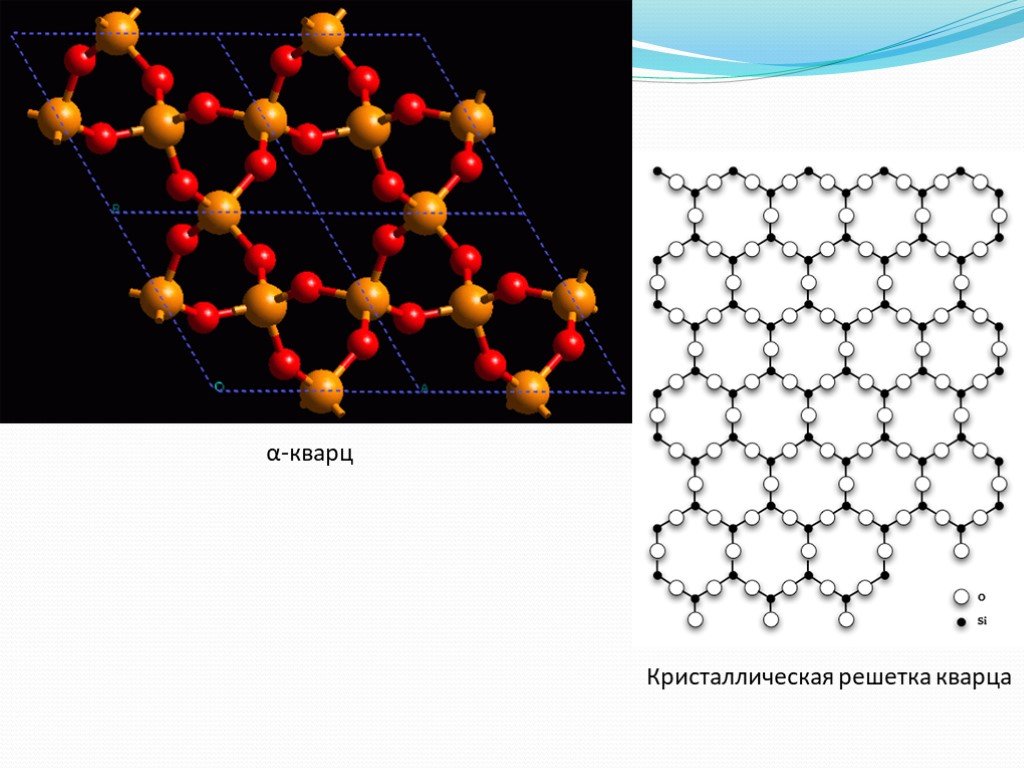
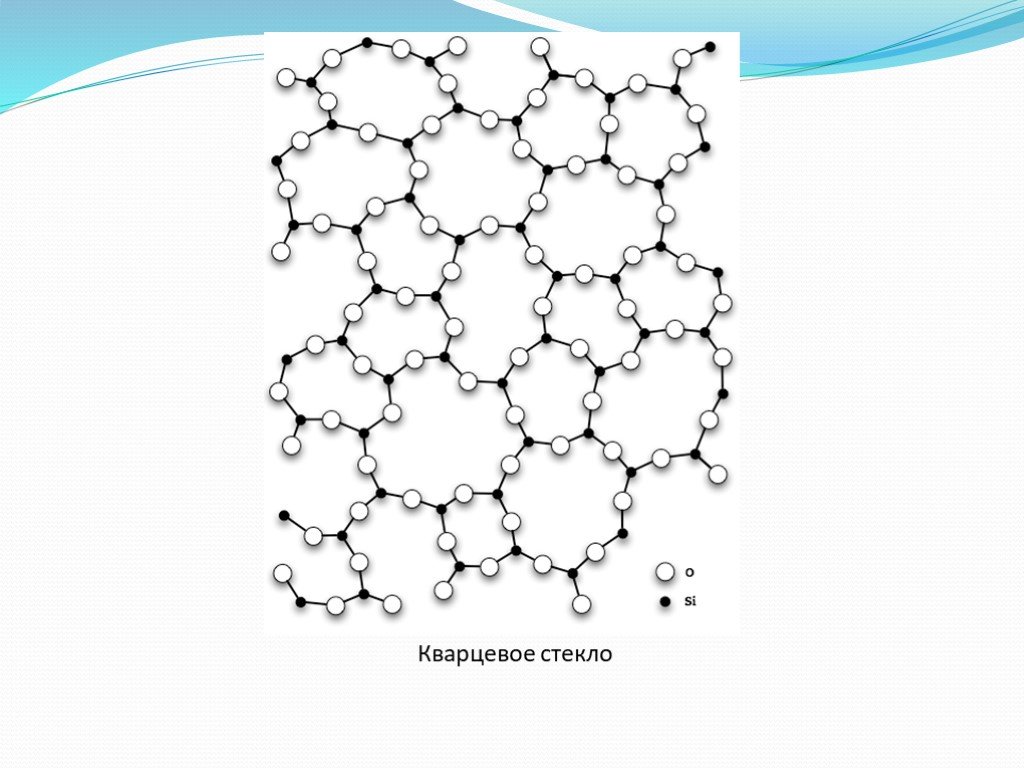
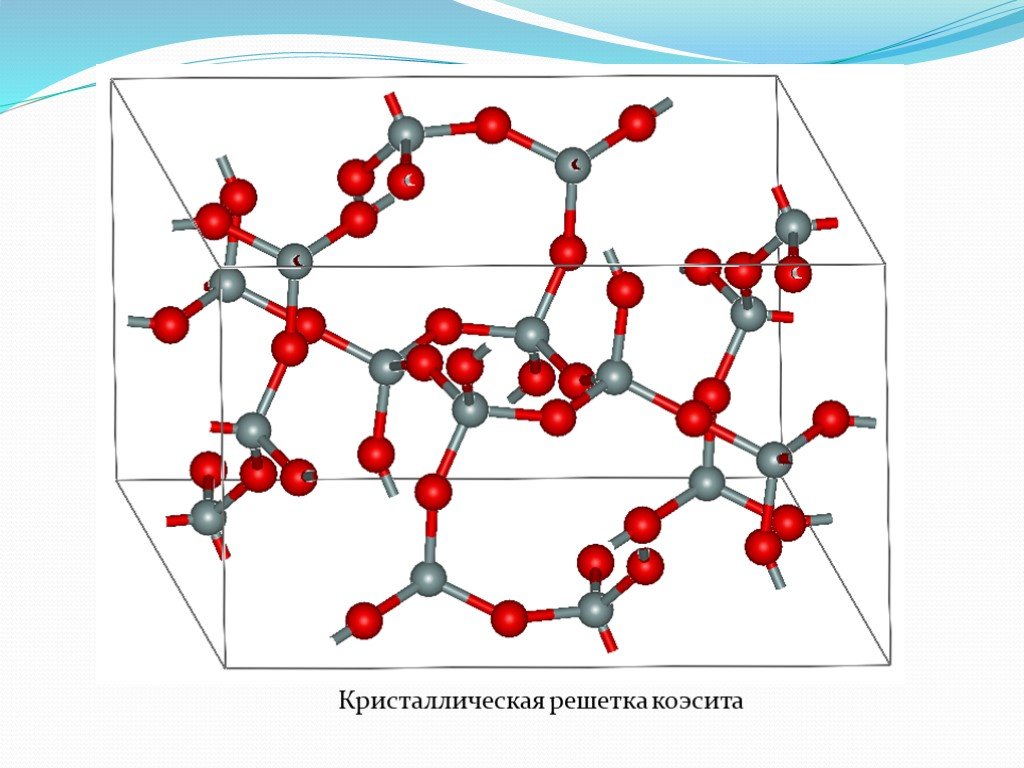
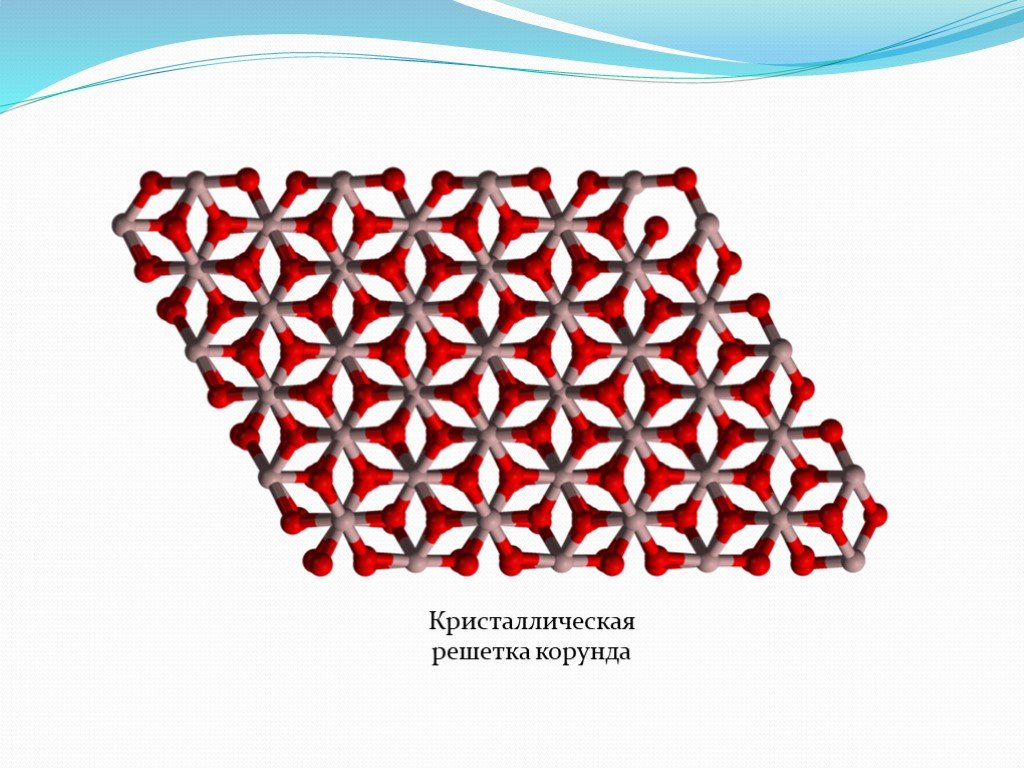
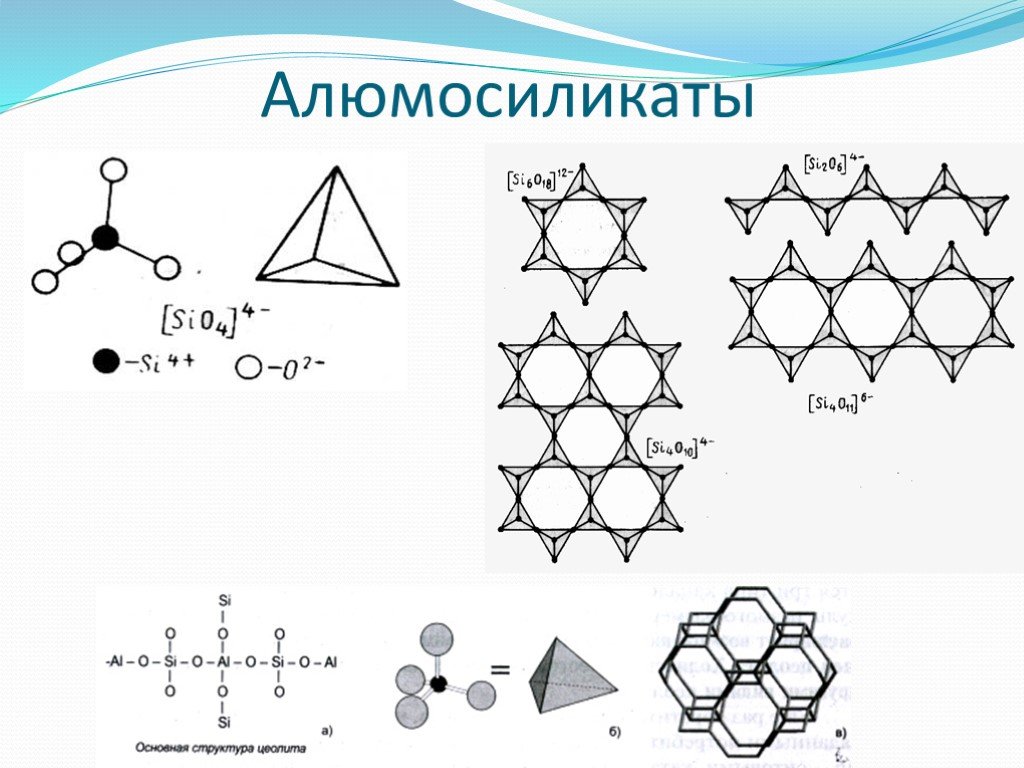
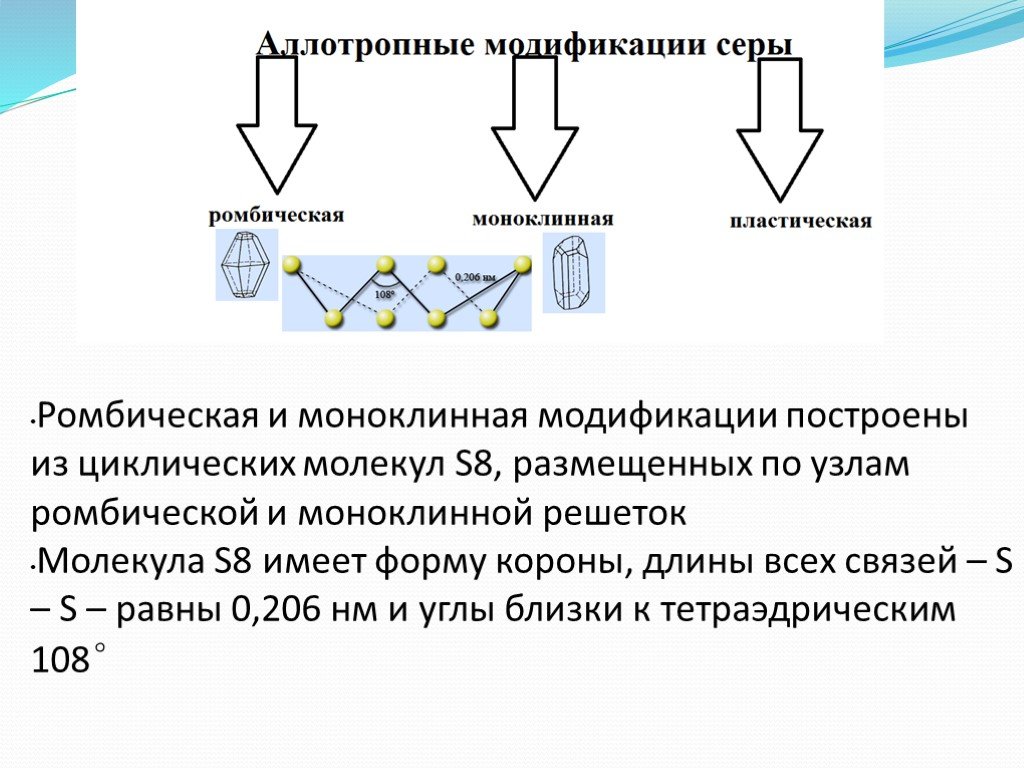
НЕОРГАНИЧЕСКИЕ полимеры - полимеры, молекулы которых имеют неорганические главные цепи и не содержат органических боковых радикалов (обрамляющих групп). ...Неорганические и элементоорганические полимеры
Неорганические полимеры. Неорганические полимеры – полимеры, которые имеют неорганические главные цепи и не содержат органических боковых радикалов. ...Синтетические высокомолекулярные соединения и полимеры на их основе
Сегодня на уроке…. Общая характеристика синтетических высокомолекулярных соединений(ВМС). Полимеры. Происхождение полимеров. Способ получения полимеров. ...Неорганические соединения. Периодическая таблица Д.И.Менделеева
Урок-конкурс по теме: «Неорганические соединения. Периодическая таблица Д.И.Менделеева». Цель: Закрепить полученные знания по основным классам неорганической ...Неорганические соединения - формулы и реакции
Цели урока. В игровой форме обобщить и закрепить знания о химических свойствах основных классов неорганических соединений и их взаимопревращениях. ...Неорганические соединения
Цель: Повторить и обобщить знания, умения и навыки по данной теме. Фронтальный опрос. Что такое степень окисления? Какие соединения называются бинарными? ...Неорганические кислоты
Кислотный остаток. Задание классу. Прослушайте аудиозапись определения кислот. Ответьте на вопросы:. 1.В данном ряду найдите формулу кислоты. Поясните. ...Неорганические и органические основания
Цель урока: обобщение, систематизация и углубление знаний о составе, классификации и свойствах оснований. Основания - это…. Основания —это сложные ...Неорганические вещества
Цели урока:. Дать понятие о генетической связи неорганических соединений Изучить понятие генетических рядов металлов и неметаллов Повторить основные ...Искусственные полимеры
Полимеры (от греч. поли — много и мерос — часть) — это высокомолекулярные, главным образом органические вещества (впрочем, известны и неорганические ...Искусственные и синтетические полимеры
Ответьте на вопросы. 1. Высокомолекулярные вещества, которые получают на основе природных полимеров путем их химической модификации называют…. Ответ. ...Химическая организация клетки. Неорганические вещества
Вещества клетки Неорганические Органические Вода Минеральные соли белки жиры углеводы. Элементы клетки микроэлементы биоэлементы макроэлементы H, ...Химический состав клетки. Неорганические соединения
Что же до первоначал, то они еще больше имеют Средств для того, чтоб из них возникали различные вещи, Нет ни одной из вещей, доступных для нашего ...Белки - природные полимеры
Основные определения. Белки – это природные полимеры, обладающие высокими значениями молекулярной массы, молекулы которых построены из остатков аминокислот, ...Высшие природные полимеры - Белки и Нуклеиновые кислоты
Цель урока: Закрепить и углубить представления учащихся о природных полимерах на примере белков и нуклеиновых кислот. Систематизировать знания о составе, ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Конспекты
Химический состав клеток. Неорганические соединения клетки
Урок на тему. «Химический состав клеток. Неорганические соединения клетки». Цели урока:. Расширение и углубление знаний учащихся о роли металлов ...Химическая организация клетки. Неорганические вещества
Тема: «Химическая организация клетки. Неорганические вещества». Цели урока:. Образовательные. : сформировать знания о роли химических элементов, ...Глюкоза, сахароза — важнейшие представители углеводов. Крахмал и целлюлоза — природные полимеры
Дата_____________ Класс_______________. Тема:. . Глюкоза, сахароза — важнейшие представители углеводов. Крахмал и целлюлоза — природные полимеры. ...Галогены. Общая характристика неметаллов. Элементы VII А группы. Неорганические вещества и охрана окружающей среды
План учебного занятия № 16. Дата Предмет. химия. группа. Ф.И.О. преподавателя:. Кайырбекова И.А. . І. Тема занятия:. Галогены. Общая характристика ...Белки- природные полимеры
Муниципальное общеобразовательное бюджетное учреждение. «Средняя общеобразовательная школа №7г.Соль-Илецка». Оренбургской области. Конспект ...Белки - органические полимеры
Интегрированный урок химия- биология. . 9 класс. «Белки - органические полимеры». Мыслящий ум. . не чувствует себя счастливым,. . пока ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 октября 2018
Категория:Химия
Содержит:48 слайд(ов)
Поделись с друзьями:
Скачать презентацию
















































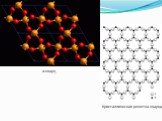
8 2Na2O*6(Fe,Mg)O*2Fe2O3*17SiO2*3Н2О. Волокна асбеста Химический состав. По химическому составу асбесты представляют собой водные силикаты магния, железа, отчасти кальция и натрия. К классу хризотил-асбестов относятся следующие вещества: Mg6[Si4O10](OH)8 2Na2O*6(Fe,Mg)O*2Fe2O3*17SiO2*3Н2О. Волокна асбеста](https://prezentacii.org/upload/cloud/18/10/84648/images/thumbs/screen6.jpg)