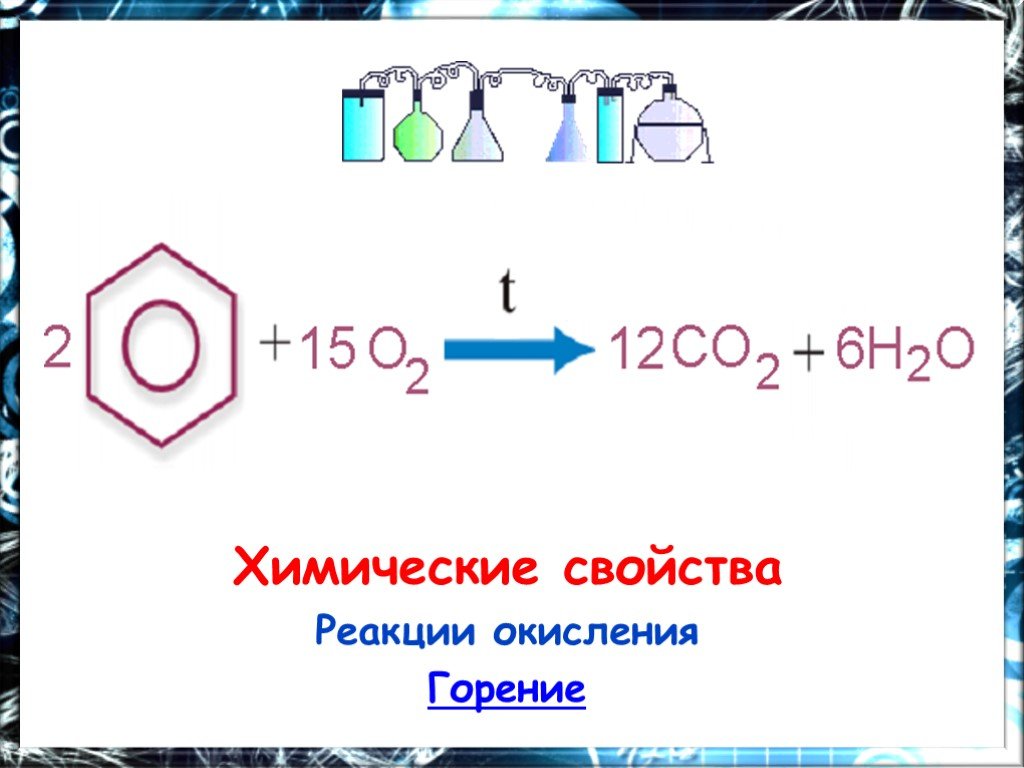
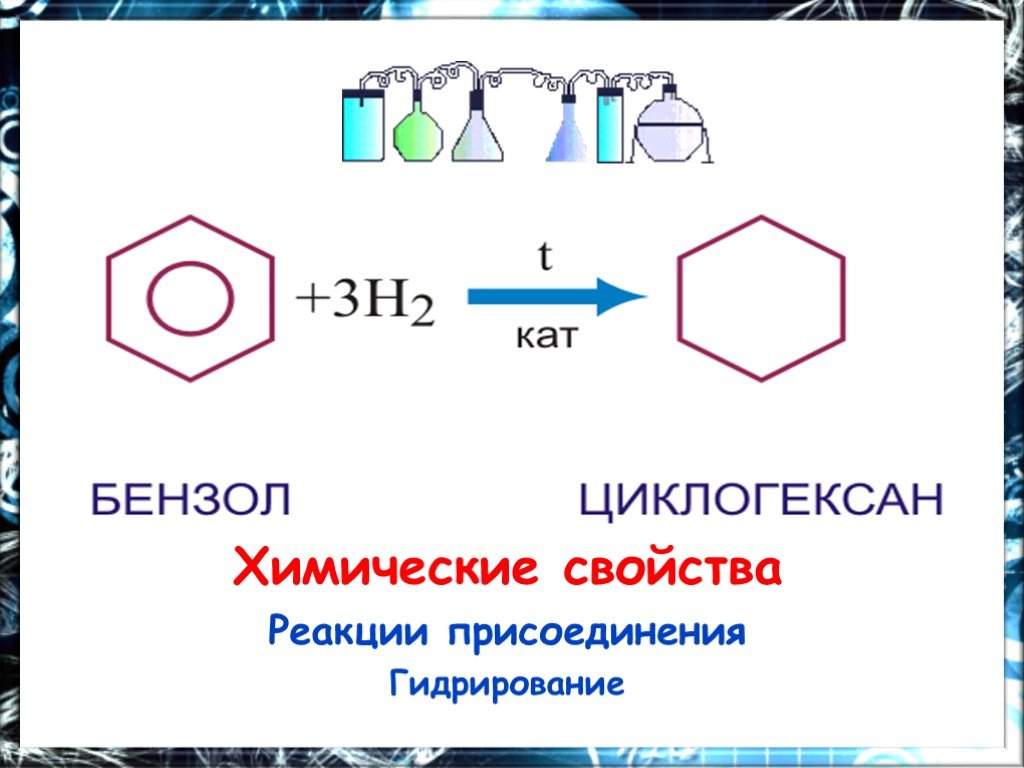
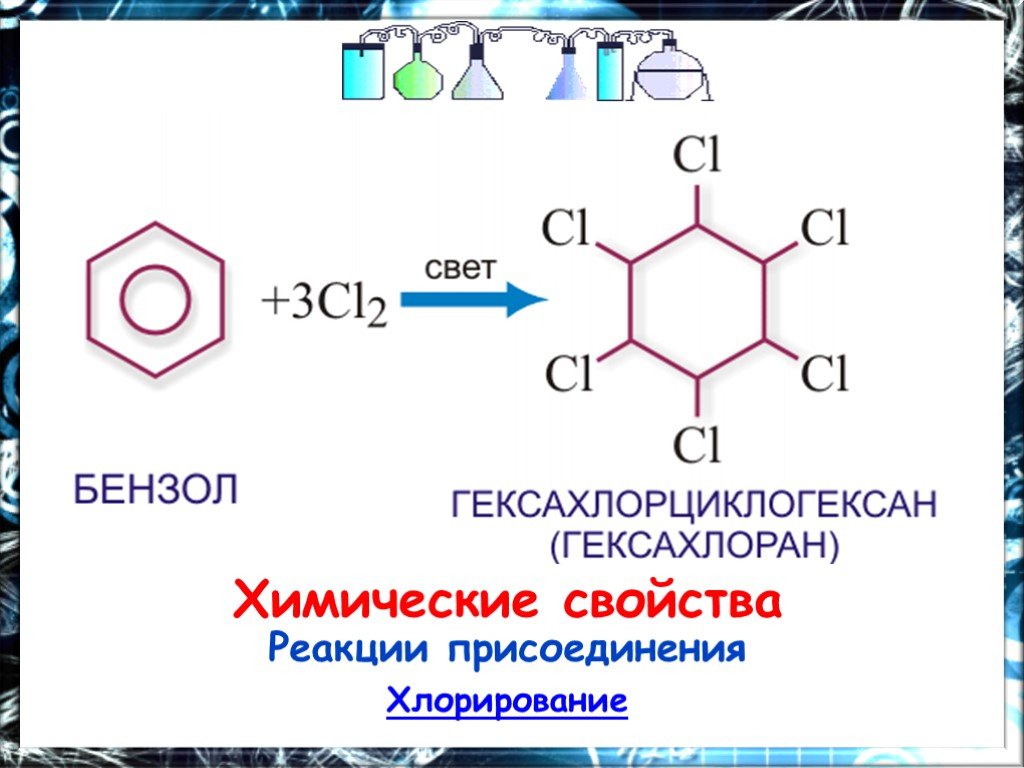
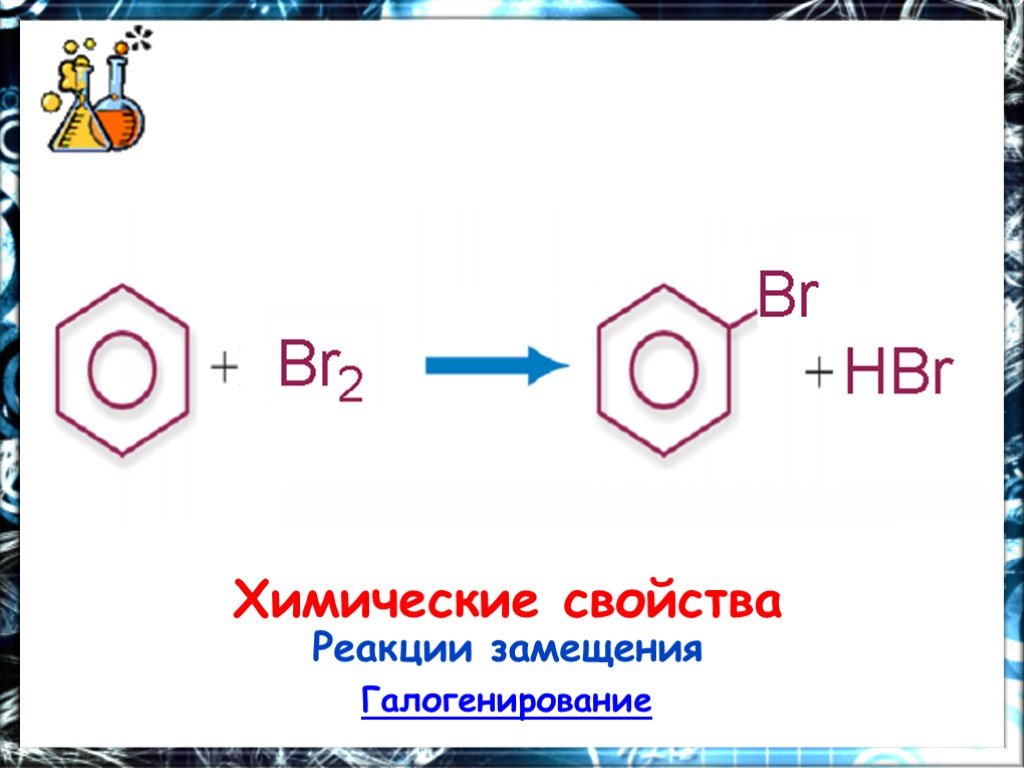
Презентация "Арены. Бензол" (11 класс) по химии – проект, доклад
Презентацию на тему "Арены. Бензол" (11 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 18 слайд(ов).
Слайды презентации
Список похожих презентаций
Арены. Бензол
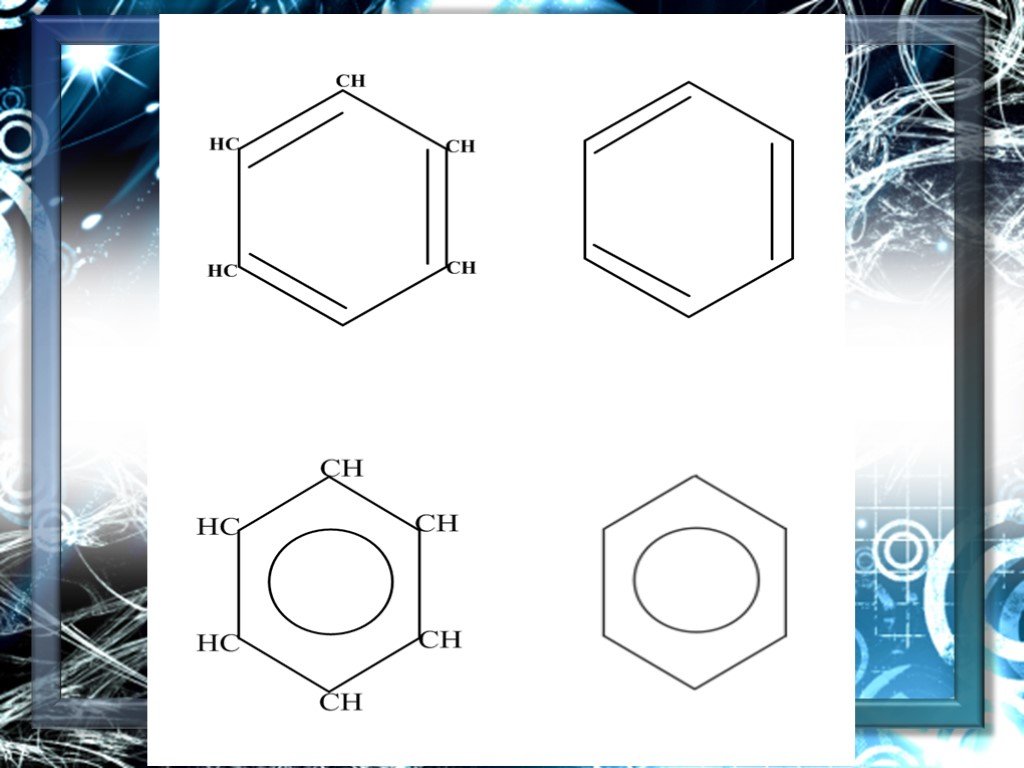
История открытия бензола. Иоганн Глаубер Майкл Фарадей. Эйльгард Митчерлих. Юстус Либих. Структура молекулы бензола. Фридрих Август Кекуле. Формула ...Ароматические углеводороды – арены. Бензол как представитель ароматических углеводородов
Бензол как представитель ароматических углеводородов. Задачи урока:. на примере бензола познакомиться с углеводородами, которые имеют замкнутые цепи ...Арены. Ароматические углеводороды. Бензол
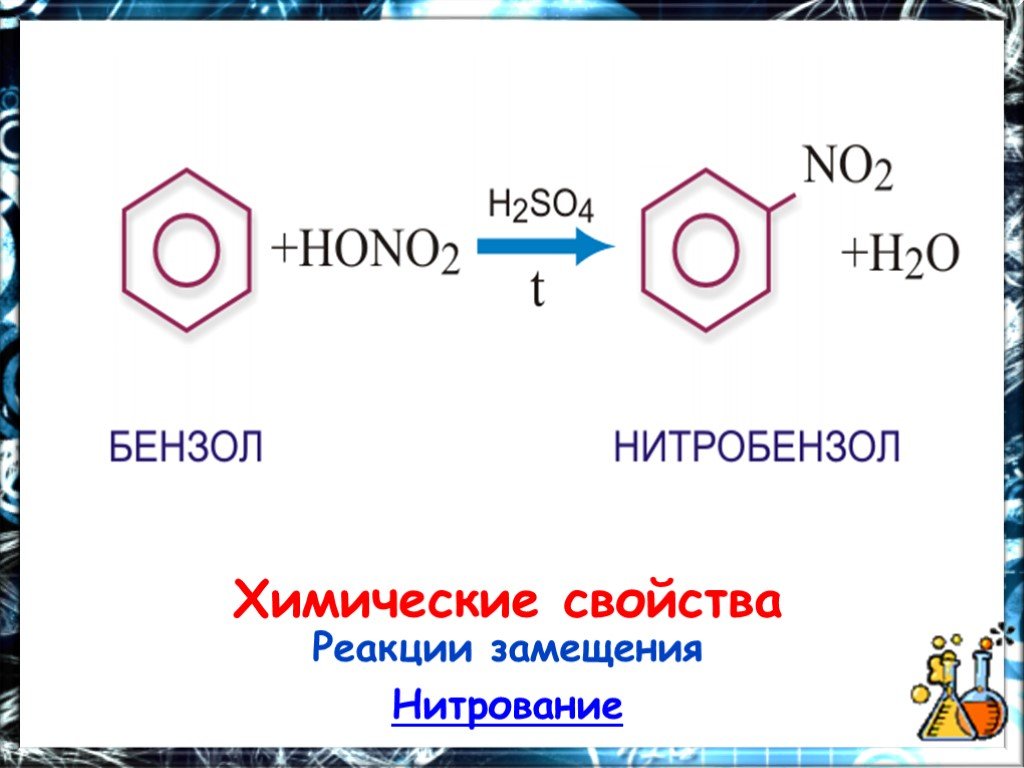
Запишите уравнения реакций:. 1 вариант бутанбутен бутадиен 1,3 1,4-дибромбутен-2. Получение этина . 2 вариант 1.Пропенпропинхлор-пропендихлорпропан. ...Арены
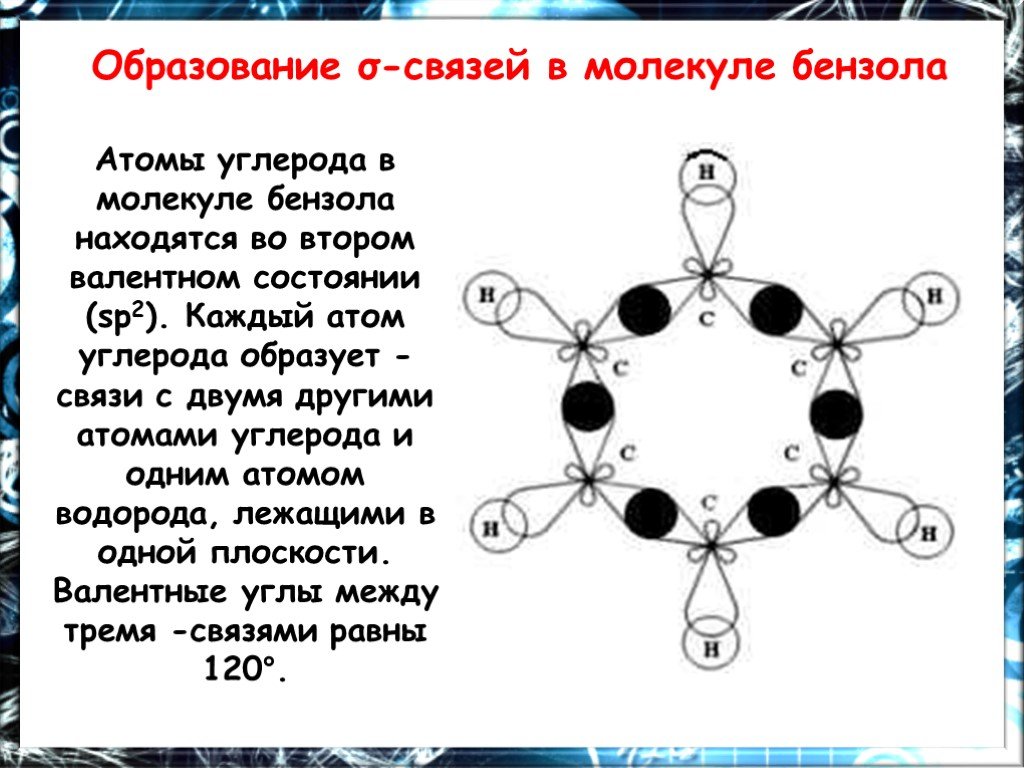
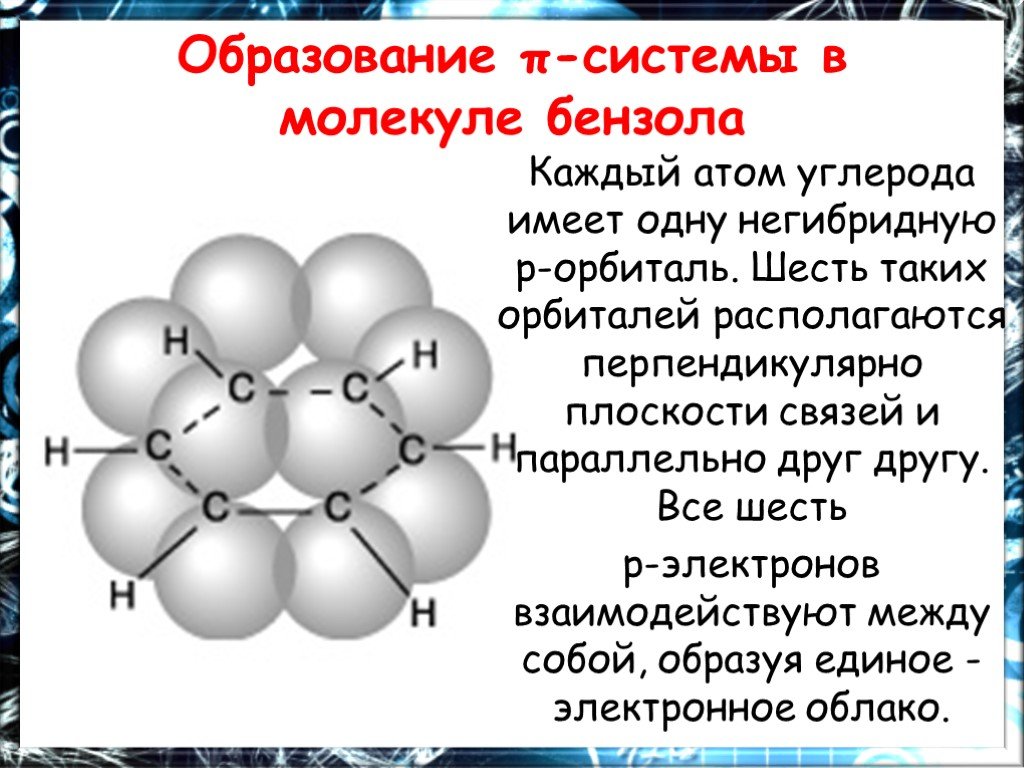
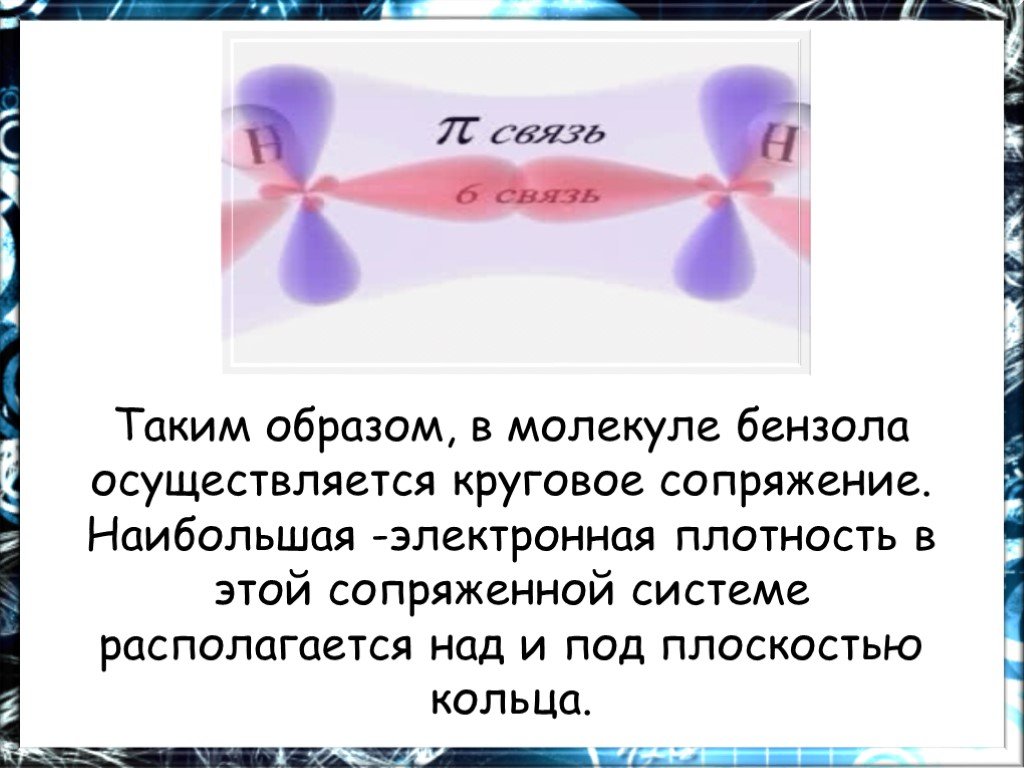
Цель работы. Дать понятие о химическом и электронном строении бензола. Ознакомиться с химическими свойствами бензола, обусловленными его строением. ...Химия Бензол
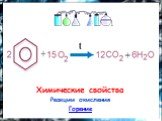
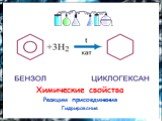
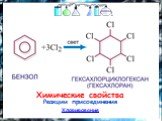
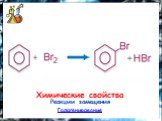
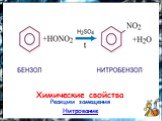
План. 1. Бензол – представитель аренов. 2. Строение аренов. Ароматическая связь. 3. Свойства бензола: а) сходство с алканами б) сходство с алкенами. ...Бензол и его свойства
История открытия бензола Второе рождение Новое получение Строение бензола Схема перекрывания облаков в молекуле Физические свойства Химические свойства ...Бензол
История открытия. Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменно-угольной ...Ароматические углеводороды. Бензол
Строение молекулы. УВ. Химические свойства. Изомерия. Физические свойства. Проверка знаний Получение Номенклатура Применение. История открытия бензола. ...Ароматические углеводороды. Бензол
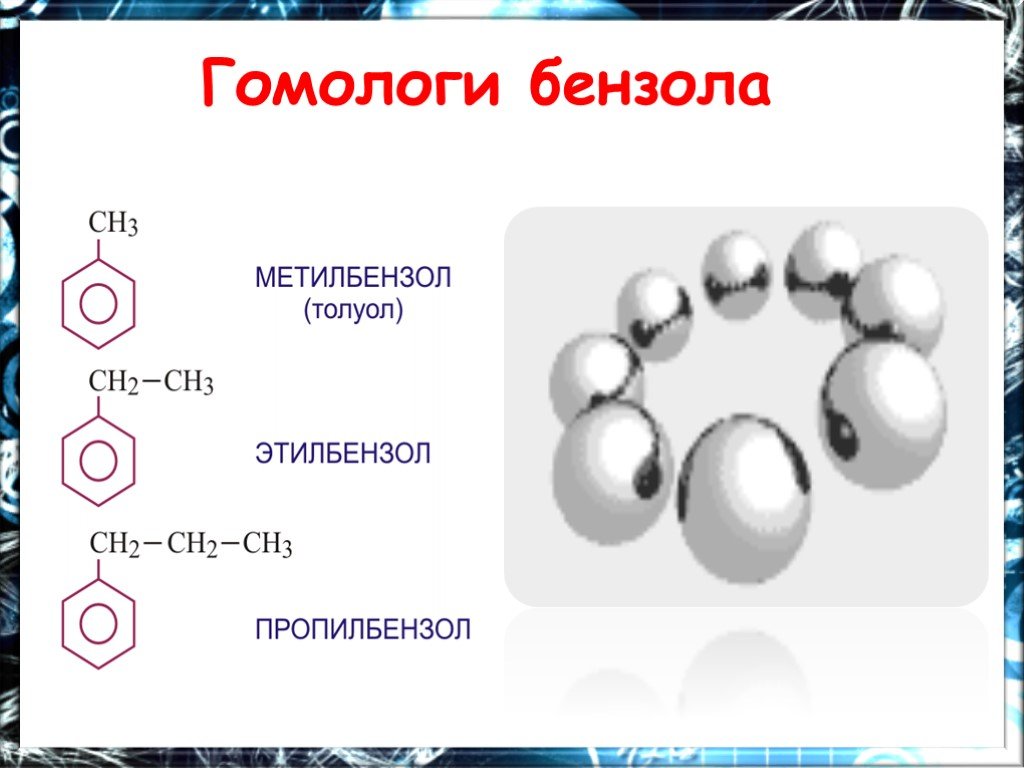
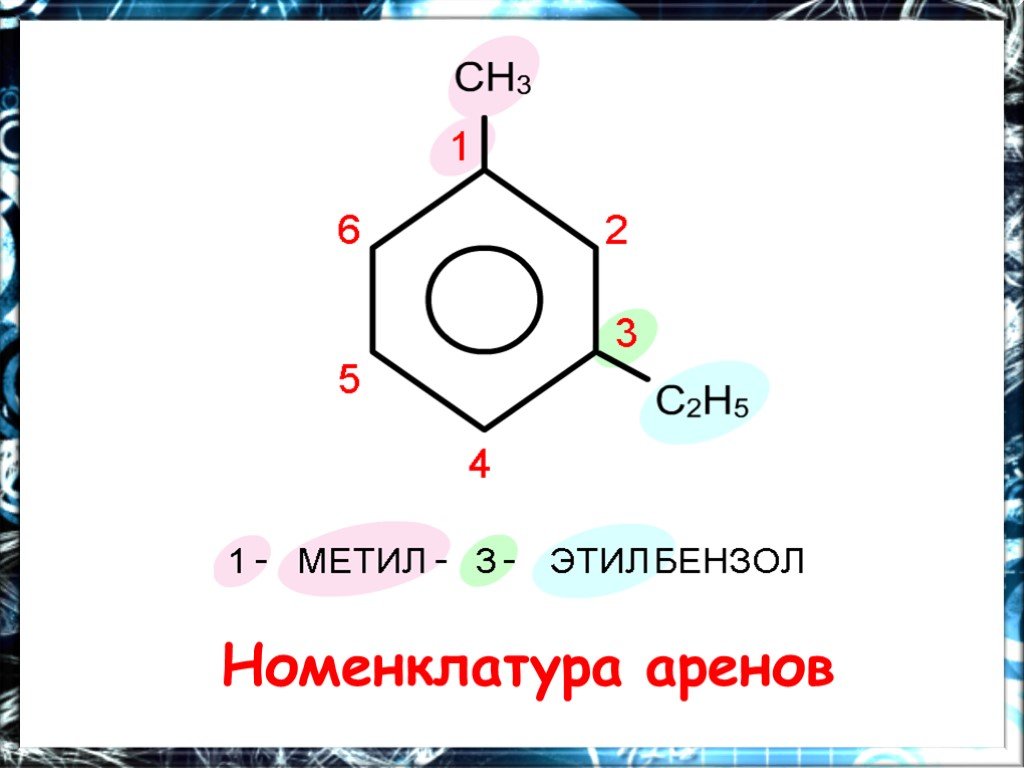
Ароматические углеводороды Название эти углеводороды получили от первых известных представителей этого класса, имевших приятный запах…. По международной ...Арены
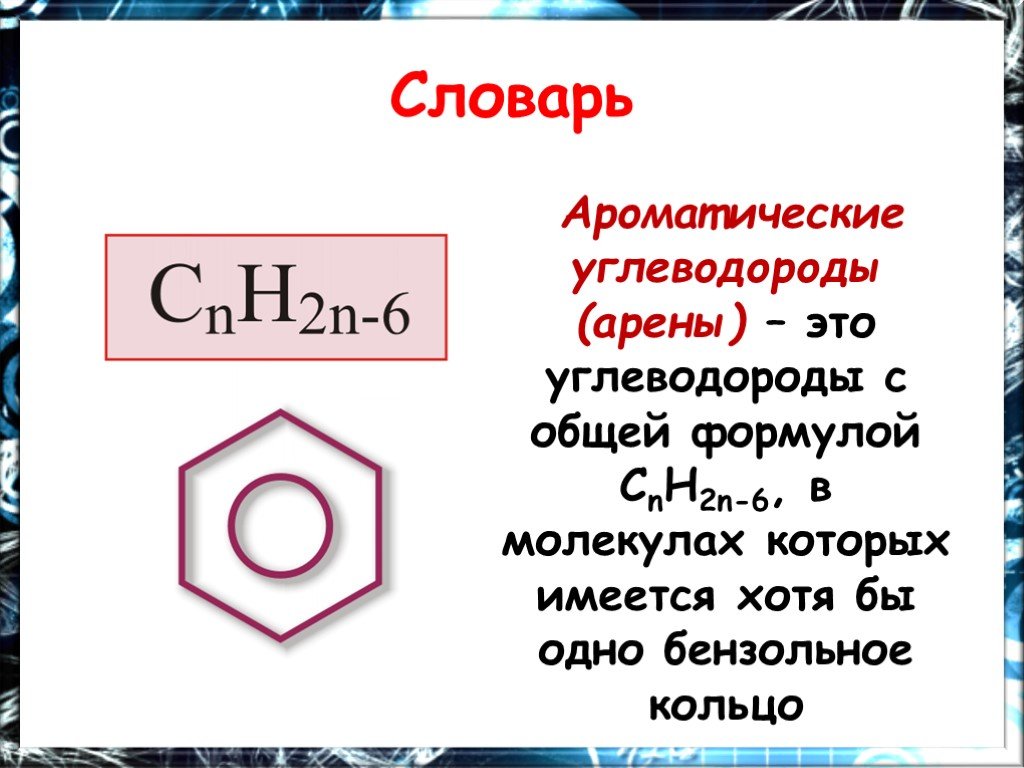
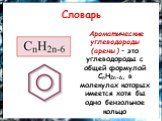
общая формула. и название класса веществ. CnH2n-6. Важнейшее ароматическое соединение- бензол, оно открыто в 1825 Майклом Фарадеем, он установил молекулярную ...Интерактивная игра "Химия в ребусах: Химические элементы"
НИКЕЛЬ. ИОД. АЗОТ. БОР. МАГНИЙ Й. МАРГАНЕЦ. КРЕМНИЙ Л=й. МЫШЬЯК. УГЛЕРОД О. ЦИРКОНИЙ. АРГОН. МЕДЬ ДВЕ. КРИПТОН. ЗОЛОТО. СЕРА П=А. ВОДОРОД А=О Т=Д. ..."Химические элементы и вещества"
Цель урока:. Повторить основные вопросы по изученному разделу “Вещества и химические явления”, закрепить полученные знания. Физические свойства веществ. ...Неорганические вещества
Цели урока:. Дать понятие о генетической связи неорганических соединений Изучить понятие генетических рядов металлов и неметаллов Повторить основные ...«Химические вещества в повседневной жизни человека»
Цель урока. Обобщить знания о химических веществах, применяемых в повседневной жизни человека; Акцентировать внимание на экологических проблемах чистой ...Жиры – биологически важные органические соединения
Содержание. Нахождение жиров в природе. История изучения жиров. Строение и разнообразие жиров. Физические свойства жиров. Химические свойства жиров. ...Ароматические углеводороды, арены, бензол
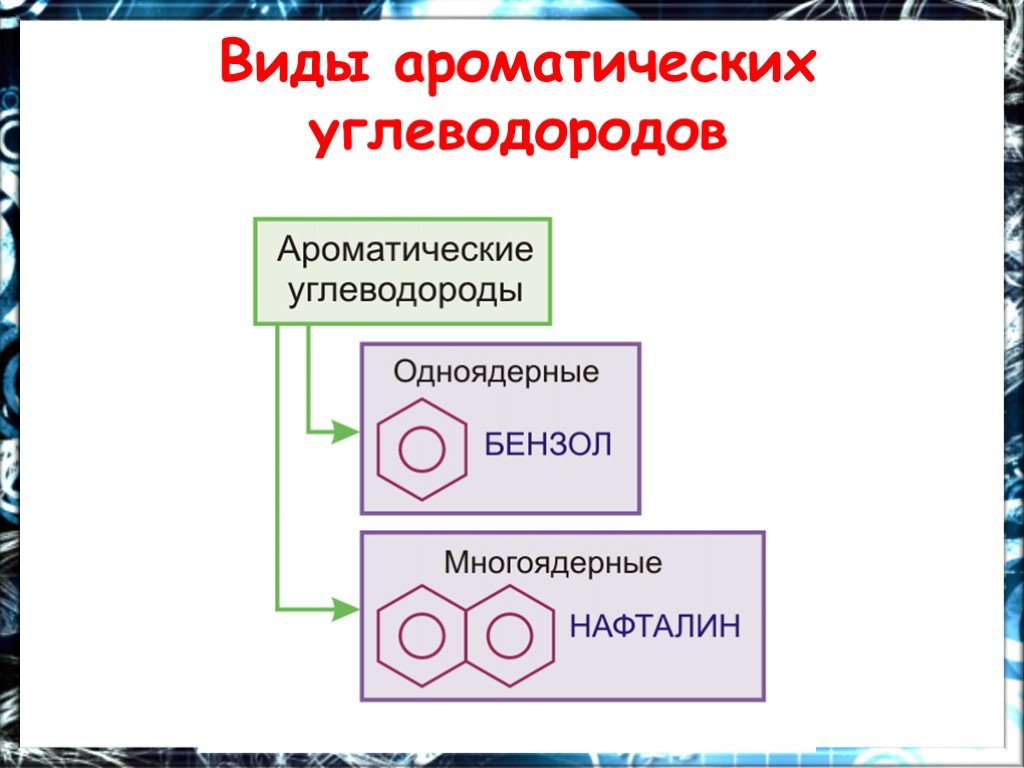
Общая характеристика класса:. Ароматическими углеводородами называются соединения, молекулы которых содержат устойчивые циклические структуры- бензольные ...Керамики - неорганические соединения
Еще Глейтером в 1981 году был введен термин «нанокристаллические» материалы, позже стали использоваться такие термины как «наноструктурные», «нанофазные», ...Кислородсодержащие органические соединения
КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. Кафедра ЭПП, к.х.н., доцент Саверченко А.Н. Студент должен: знать строение, номенклатуру, свойства, способы ...Металлоорганические соединения непереходных металлов
Лекция 2 Характерные типы и энергетика связей металл-углерод Основные синтетические подходы к металлоорганическим соединениям. Характерные типы связей ...Неорганические соединения - формулы и реакции
Цели урока. В игровой форме обобщить и закрепить знания о химических свойствах основных классов неорганических соединений и их взаимопревращениях. ...Конспекты
Арены. Бензол
Урок в 10 классе. Тема: Арены. Бензол. МБОУ РСОШ «10. Учитель: Григоренко Е.В. Цели урока. ...Арены. Бензол
Арены. Бензол. . . Цель: . сформировать представление обучающихся о строении бензола, познакомить с его физическими и химическими свойствами, ...Ароматические углеводороды – арены. Бензол как представитель ароматических углеводородов
ФОРМА УРОКА:. презентация с музыкальным сопровождением. ТИП УРОКА:. изучение нового материала. ТЕМА УРОКА. «Ароматические углеводороды – арены. ...Бензол как представитель ароматических углеводородов
Методическая разработка. . УРОК : «Бензол как представитель ароматических углеводородов» . . (Модульный урок). Немытькова А.В учитель химии МБОУ ...Арены
Тема урока:. Арены. . Тип урока:. изучение нового материала. Цель урока:. Сформировать у учащихся систему знаний об аренах, как об одном из ...Арены
Иванова Ольга Борисовна учитель химии МОУ СОШ №1 гор. Неи Костромской области. . Урок хими. Тема урока. : «Арены». Цель урока. : обобщить и ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:5 сентября 2018
Категория:Химия
Содержит:18 слайд(ов)
Поделись с друзьями:
Скачать презентацию