Презентация "Использование ИКТ на уроках химии" () – проект, доклад
Презентацию на тему "Использование ИКТ на уроках химии" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Викторина «Своя игра» по химии
Вопрос. Отечественный ученый, назвавший человека – «мощной геологической силой, способной изменить лик Земли»? Как называется нарушение природной ...Викторина по химии
1.Газ, который применили во время первой мировой войны в качестве химического оружия. 2. Единственный жидкий металл. 3.Русский учёный - энциклопедист. ...Викторина по химии "Что это?"
РЕБЯТА!!! ЗА МНОЙ!!! К ВИКТОРИНЕ «ЧТО ЭТО?». ОПРЕДЕЛЯЕМ, О КАКИХ ВЕЩЕСТВАХ ИДЕТ РЕЧЬ??? 1 2 4 5 6 7 8 9 10 11 12 ВЫБИРАЙ!! Трудно представить, что ...Гипертекст как средство развития познавательной активности учащихся на уроках химии
Анонимное тестирование учащихся 8-11 классов. Выполняете ли вы домашнее задание? Читаете ли вы параграф, заданный на дом? Вы пользуетесь компьютером ...Активизация обучающихся на уроках химии как показатель развития их мыслительной деятельности.
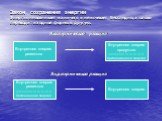
Приёмы активизации мыслительной деятельности обучающихся:. Приём стимулирующих звеньев Приём реконструкции Приём прогнозирования. Приём стимулирующих ...Значение химии в жизни современного человека
Цель и задачи работы. Цель: Раскрыть степень влияния химии на повседневную жизнь современного человека. Задачи: Раскрыть тему; Изложить проблему; ...Значение химии в жизни человека
Значение химии. Агропромышленность Машино – и ракетостроение Текстиль Архитектура Фармацевтика Предметы быта Пищевая промышленность Металлургия. Химия ...Значение органической химии
Значение органической химии чрезвычайно велико. Оно обусловлено той исключительной ролью , какую играют в жизни человека органические вещества. Белки, ...Значение химии
Введение. Повсюду нас окружают предметы и изделия, изготовленные из веществ и материалов, которые получены на химических заводах и фабриках. Кроме ...Анализ результатов ЕГЭ по химии 2010 (окружной семинар учителей химии)
Результаты ЕГЭ 2010. Граница минимального балла -33 тестовых балла (12 первичных баллов). Уровни оценивания: неудовлетворительный – 0–32 / 0–11; удовлетворительный ...Безопасность на уроке химии
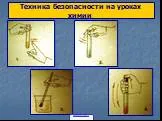
Пробовать вещества на вкус, есть и пить в химическом кабинете. Осторожно направляйте к себе газ рукой. ЗАПРЕЩАЕТСЯ. . . . . ЗАПРЕЩАЮЩИЕ ЗНАКИ. Запрещается ...Анализ ЕГЭ по химии 2011
Уровни выполнения экзаменационной работы. неудовлетворительный – 0–31 / 0–12, удовлетворительный –32–56 / 13–35, хороший – 57–77 / 36–56, отличный ...Значение химии
У 1897 Джозеф Джон Томсон (1856 - 1940) відкрив електрон, заряд якого з високою точністю виміряв в 1909 Роберт Міллікен (1868 - 1953). У 1911 Ернст ...Значение химии
Джерелами енергії найчастіше є традиційні невідновні природні ресурси — вугілля, нафта, природний газ, торф, сланці. Останнім часом вони дуже швидко ...Знатоки химии
Тур 1. Химические элементы. 1.He 2.Co 3.Po 4.Ru 5.Np 6.Am 1. Химический элемент, названный в честь планеты Солнечной системы, которая в свою очередь ...Азотная кислота по химии
Тема: «Азотная кислота» Цель урока: Рассмотреть свойства азотной кислоты и области ее применения. План урока: 1. Проверка Д/З (письменная работа); ...Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам курса неорганической химии
Х И М И Ч Е С К А Я В И К Т О Р И Н А «Знаешь ли ты это? 11 класс. ТЕМА: «Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам ...Значение химии в жизни человека
Значение химии в жизни человека трудно переоценить. Приведём фундаментальные области, в которых химия оказывает своё созидательное воздействие на ...Великие учёные, внёсшие значительный вклад в развитие химии
Дмитрий Иванович Менделеев. Родился в Тобольске в семье директора гимназии. После окончания гимназии он поступил в Главный педагогический институт ...ЕГЭ по химии
Количество участников и итоги 2011 г. В СПб Зарегистрировано - 3703 Явились - 2671 (72,1%) Неудовлетворительно – 156 чел. (5,84%) Средний балл – 54,43 ...Конспекты
Использование опорных схем на уроках химии
Муниципальное образовательное автономное учреждение средняя общеобразовательная школа с углубленным изучением отдельных предметов №1 г. Белогорск, ...Развитие познавательной самостоятельности на уроках химии через составление химических задач
Развитие познавательной самостоятельности на уроках химии через составление химических задач. «Не мыслям надо учить, а мыслить…». . И.Кант. ...Металлы – простые вещества с использованием ИКТ на уроке
Конспект урока химии (по программе О.С. Габриеляна) в 8 классе на тему «Металлы – простые вещества с использованием ИКТ на уроке». Автор: Карачева ...Игра как средство развития школьников на уроках химии
Игра как средство развития школьников на уроках химии. . Мы прекрасно знаем, что играть любят не только дети, но и взрослые. Главная задача моей ...Развитие интеллекта и творческих способностей учащихся на уроках химии
Перед современной школой стоит задача воспитания грамотного, продуктивно мыслящего человека, адаптированного к условиям жизни в обществе. Проблема ...Развитие речи учащихся на уроках химии
Развитие речи учащихся на уроках химии. . «Изучая средства выражения,. . мы изучаем выражаемое.». Л.В.Щербы. Опыт работы в школе ...Использование метана
Муниципальное бюджетное образовательное учреждение. «Вечерняя (сменная) общеобразовательная школа №1». Рузаевского муниципального района. ...Вода в природе. Потребление воды в быту и на производстве. Жесткость воды и способы его устранения. Минеральные воды, их использование столовых и лечебных целях
Тема:. . Вода в природе. Потребление воды в быту и на производстве. Жесткость воды и способы его устранения. Минеральные воды, их использование ...Белки. На перекрестках химии и биологии
Урок в 10 классе «Белки. На перекрестках химии и биологии». Цель урока:. систематизация и углубление знаний учащихся по теме «Белки». Образовательные ...Знатоки химии III
Разработка игры «Знатоки химии III. ». Цель игры:. . Раскрытие роли химии в познании природы и обеспечении жизни общества;. . Развитие ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 апреля 2018
Категория:Химия
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию