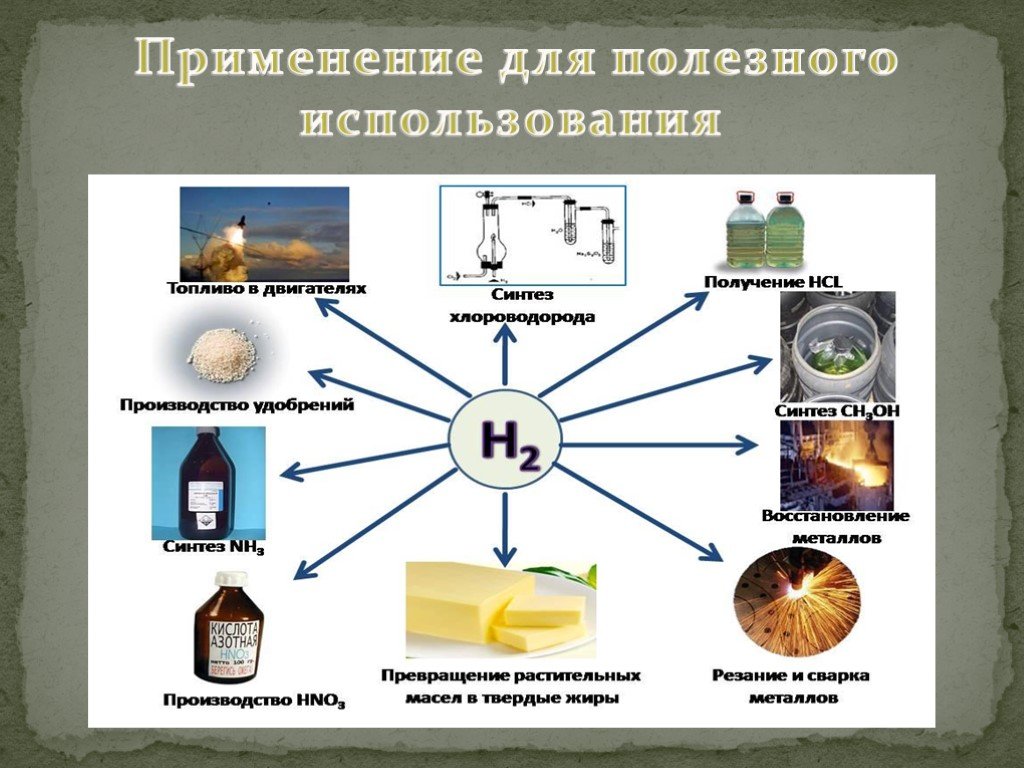
Презентация "Водород" по химии – проект, доклад
Презентацию на тему "Водород" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 14 слайд(ов).
Слайды презентации
Список похожих презентаций
Водород
В О Д О Р О Д.«Вода… Ты не имеешь ни вкуса ни цвета ни запаха,тебя невозможно описать тобой наслаждаешься. Ты не просто необходима для жизни, ты ...
Водород, его общая характеристика, нахождение в природе и его свойства
Цели. сформировать знания учащихся о водороде как о атоме и простом веществе, его способах получении, свойствах и применении научить учащихся работать ...Водород
Химический диктант. Выбрать свойства, характерные для: I вариант – металлов II вариант – неметаллов. Начало всех начал – водород! Водород в космосе. ...Водород
Газ Первый в таблице Менделеева и самый распространенный во Вселенной элемент большинству знаком из школьной химии. Газ, состоящий из молекул H2, ...Водород
Водород самый распространенный элемент во вселенной. История открытия. Впервые этот газ в чистом виде выделил 240 лет назад английский химик Генри ...Водород
План: Введение. Водород. Положение элемента в периодической системе Д.И. Менделеева. Водород в природе. Получение водорода. Так кто же виноват в нашей ...Водород
ВОДОРОД (лат. Hydrogenium), H, химический элемент с атомным номером 1, атомная масса 1.00794. Химический символ водорода Н читается в нашей стране ...Предельные углеводороды химия
Органическая химия – это раздел химической науки, в котором изучаются соединения углерода и их превращения. В наши дни к органическим веществам относятся ...Химический элемент водород
Цели и задачи урока. повторить и закрепить знания, умения и навыки по теме «Свойства водорода и кислот. Формулы солей»; продолжить формирование познавательных ...Химический элемент - водород
Краткая характеристика элемента. H 1 1,00794 1s1 Водород. Водоро́д — первый элемент периодической системы элементов. Широко распространён в природе. ...Кислород и водород
повторить физические и химические свойства водорода и кислорода, распространение их в природе вспомнить уравнения горения простых и сложных веществ ...Органическая химия
Цель: уяснить знания о предмете изучения и особенностях органической химии. Широко распростирает химия руки свои в дела человеческие … куда ни посмотрим, ...Опасная химия
Выводы по теме «Осторожно, ртуть!»:. Ртуть- очень ядовитый материал, который попадает в организм человека при вдыхании ядовитых паров или употреблении ...Органическая химия
ФЕНОЛЫ. 2. Классификация и изомерия Как и спирты, фенолы бывают одноатомные (одна -OH) и многоатомными (несколько -OH). Для фенолов характерна изомерия ...Токсикологическая химия
Токсикологическая химия. Токсикологическая химия – это наука о химических превращениях токсических веществ и их метаболитов в организме, методах их ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...Периодическая система химия
Предпосылки. И. Дёберейнер, Ж. Дюма, французский химик А. Шанкуртуа, англ. химики У. Одлинг, Дж. Ньюлендс - существование групп элементов, сходных ...Сера химия
Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное практическое применение. ...Бытовая химия
Цель исследования, изучить влияние препаратов бытовой химии на здоровье человека. Задачи исследования: 1. Изучить опасности современной бытовой химии; ...Бытовая химия
История Товары бытовой химии имеют очень древнюю историю. Освоенные в древности процессы солеварения, окраски тканей, приготовления рисовальных красок ...Конспекты
Водород – химический элемент и простое вещество
Тема урока «Водород – химический элемент и простое вещество». Тип урока: урок обобщения и систематизации знаний по теме «Водород». Форма урока: ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 декабря 2018
Категория:Химия
Содержит:14 слайд(ов)
Поделись с друзьями:
Скачать презентацию