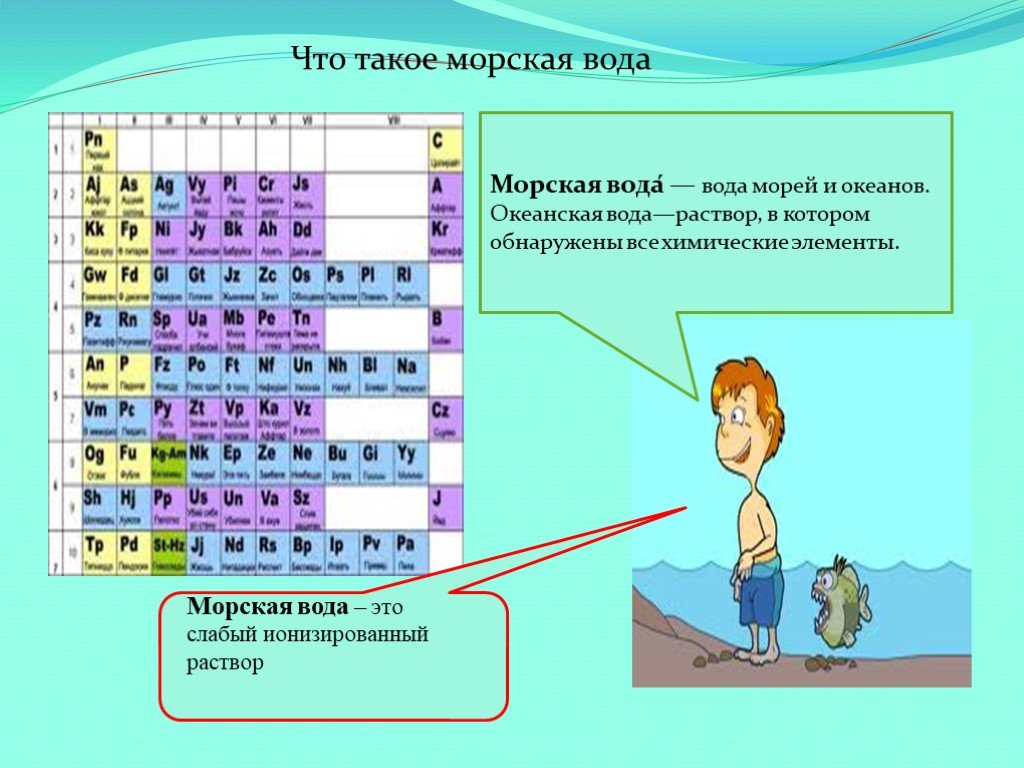
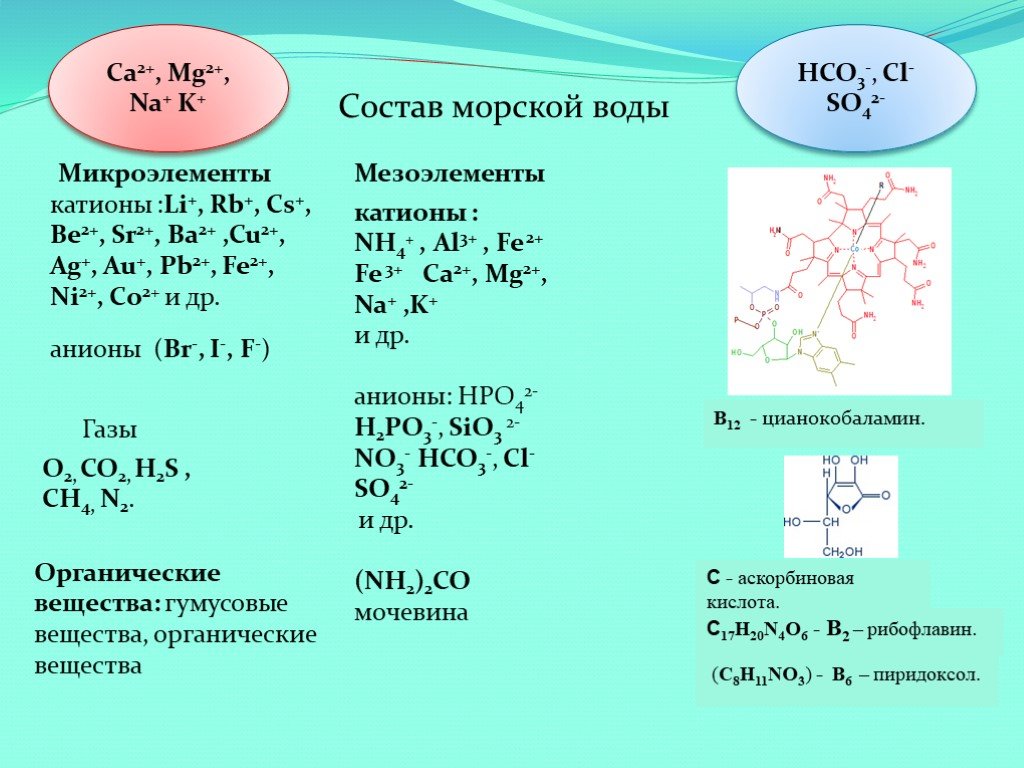
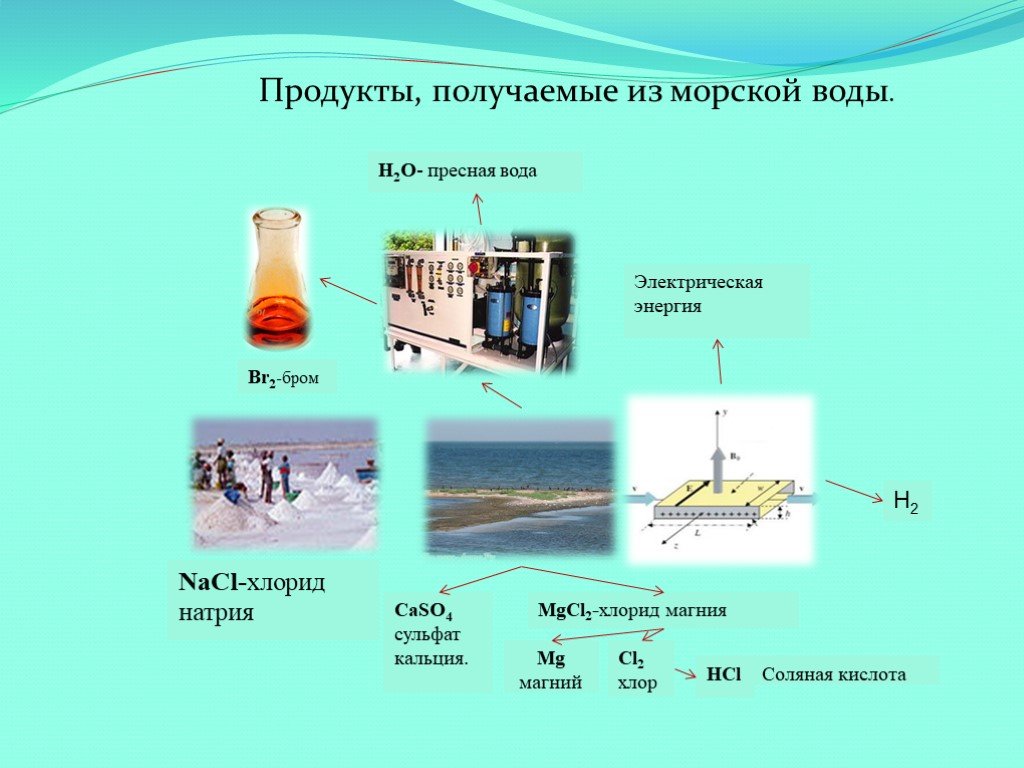
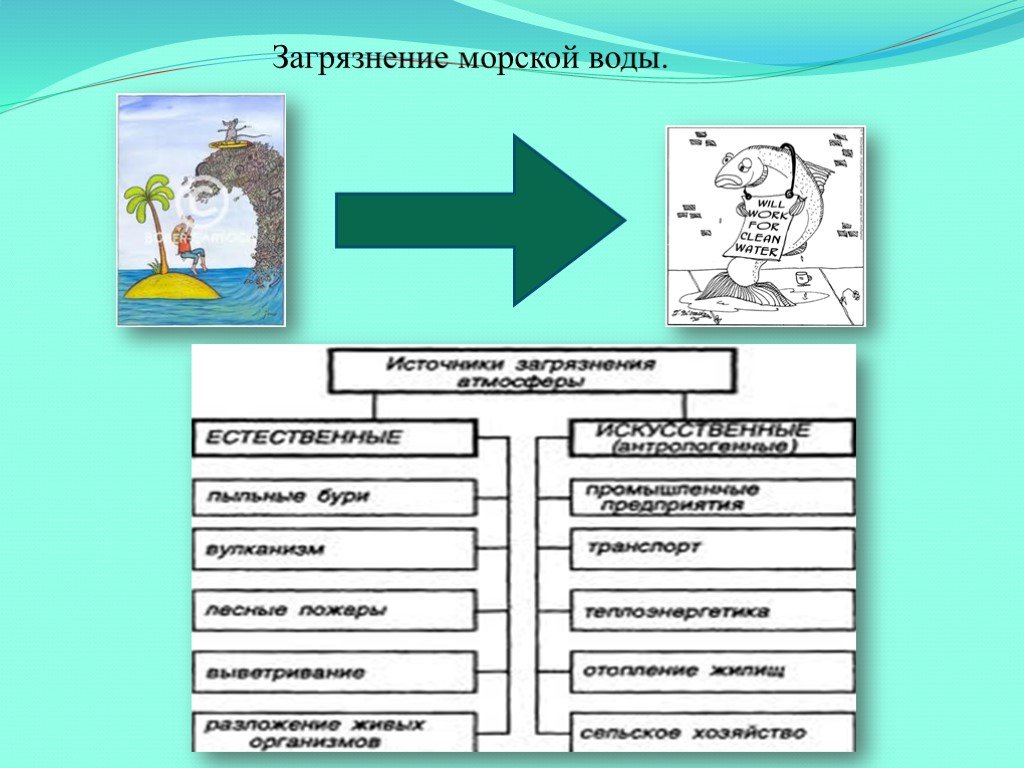
Презентация "Морская вода как универсальный природный раствор" (11 класс) по химии – проект, доклад
Презентацию на тему "Морская вода как универсальный природный раствор" (11 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 41 слайд(ов).
Слайды презентации
Список похожих презентаций
Вода как растворитель
Проверка домашнего задания. Решение задач. 1. Если в чайник или кастрюлю налить воду до краев и начать нагревать, то через некоторое время вода начнет ...Вода как вещество
Содержание. Состав и строение молекулы. Методы определения состава веществ. Вода в природе. Методы очистки воды. Физические свойства. Химические свойства. ...Ферменты как биологически активные соединения
Ферменты (энзимы) – это органические катализаторы белковой природы, которые ускоряют реакции, необходимые для функционирования живых организмов. Типы ...Система заданий как средство формирования приемов умственной деятельности при изучении темы «Химический элемент»
Третий лишний. Вычеркните символ элемента, выпадающего из общего ряда. Возможен не один вариант правильного ответа Ключ: названия, написание знаков, ...Сера как химический элемент и простое вещество
Основные вопросы. 1.Истрия открытия и изучения серы. 2. Распространение серы в природе. 3. Аллотропия и физические свойства серы. 4.Химические свойства ...Проблемное обучение как средство реализации компетентностого подхода на уроках химии
Проблемное обучение - это комплекс технологий, способствующих развитию прямого (исследовательского) опыта получения новых знаний, и , как следствие, ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Алюминий как химический элемент и как простое вещество
AL. Элемент III(A) группы таблицы Д.И.Менделеева. Элемент с порядковым № 13. Элемент 3 -его периода. Третий по распространенности в земной коре. Впервые ...Чистая вода
Цель урока: Изучить состав и строение молекулы воды, физические и химические свойства, рассмотреть экологические проблемы, связанные с загрязнением ...вода
ВОДА. Единственное вещество в природе, которое существует в нормальных условиях в трех агрегатных состояниях:. Твердом, жидком и газообразном! Физические ...Внимание: вода!
Цели. 1)Изучить историю возникновения воды. 2) Изучить химический состав воды. 3) Узнать новую информацию для себя. 4) Рассмотреть макеты молекулы ...Вещество вода
Любая ли вода полезна? Работа в группах Вода! Вода? Вода… (группа теоретиков) Вода - источник жизни (группа экологов) Где искать воду? (группа историков ...Биохимия как наука
Биохимия может быть определена как химия живых объектов (клеток и организмов). Структуры живых объектов обычно образуются из простых неорганических ...Белки как основа всего живого
Жизнь – это переплетение сложнейших химических процессов взаимодействия белков между собой и другими веществами. Ф. Энгельс. Продукты, содержащие ...Ароматические углеводороды – арены. Бензол как представитель ароматических углеводородов
Бензол как представитель ароматических углеводородов. Задачи урока:. на примере бензола познакомиться с углеводородами, которые имеют замкнутые цепи ...Характеристика азота как химического элемента и простого вещества
Вслед за Резерфордом такие же опыты провели Шееле, Пристли и Кавендиш, которые называли исследуемое вещество «удушливым воздухом», «дурным воздухом». ...Цветные качественные реакции, как способ химического кодирования документов
Тайнопись и защита информации. Защита информации и документов от подделки актуальна с древности. Наибольшую популярность в прошлом имели химические ...Газированная вода
Газированная вода – популярный безалкогольный прохладительный напиток. Она представляет собой питьевую природную минеральную воду, обогащённую диоксидом ...Явления, как изменения, происходящие с веществами
Свойства веществ. Агрегатное состояние (при обычных условиях) Цвет Блеск Запах Растворимость в воде Другие свойства. Описать свойства веществ. Вода ...Гипертекст как средство развития познавательной активности учащихся на уроках химии
Анонимное тестирование учащихся 8-11 классов. Выполняете ли вы домашнее задание? Читаете ли вы параграф, заданный на дом? Вы пользуетесь компьютером ...Конспекты
Вода, как растворитель веществ
Тема урока: «Вода, как растворитель веществ». Цели урока:. . формирование учебно-познавательного интереса к новому способу действия через работу ...Вода - универсальный растворитель
Дереглазова О.П. - учитель химии,. высшая квал. кат. Интегрированный урок по физике и химии. 8 класс. Тема:. «Вода - универсальный растворитель». ...Свойства кислот как электролитов
Тема урока " Свойства кислот как электролитов". . Тип урока:. урок открытия новых знаний. Цель: создать условия для полноценного восприятия ...Самое удивительное вещество – вода
Петрова Галина Анатольевна. МОУ Мирновская сош. Торжокский район. Тверская область. Учитель химии. Тема «Самое удивительное вещество – вода». ...Природные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязненияПриродные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязнения
Дата_____________ Класс_______________. Тема:. Природные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха ...Подгруппа углерода. Углерод как простое вещество
Тема: «Подгруппа углерода. Углерод как простое вещество». Цель урока. :. Дать общую характеристику элементам. VI. А группы, показать аллотропные ...Ароматические углеводороды – арены. Бензол как представитель ароматических углеводородов
ФОРМА УРОКА:. презентация с музыкальным сопровождением. ТИП УРОКА:. изучение нового материала. ТЕМА УРОКА. «Ароматические углеводороды – арены. ...Химия как часть естествознания
7 класс. Естествознание. . Урок 1 Химия как часть естествознания. Предмет химии. Цель:. знакомство с понятиями тело, вещество, свойства веществ; ...Фосфор как химический элемент и вещество
Муниципальное бюджетное общеобразовательное учреждение. «Новотимошкинская основная общеобразовательная школа». Аксубаевского муниципального района ...Кислород в природе как химический элемент. Оксиды
МОУ Бендерская гимназия №2. . Урок химии 8 класс. По теме:«Кислород в природе как химический элемент. Оксиды». . ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 декабря 2018
Категория:Химия
Содержит:41 слайд(ов)
Поделись с друзьями:
Скачать презентацию