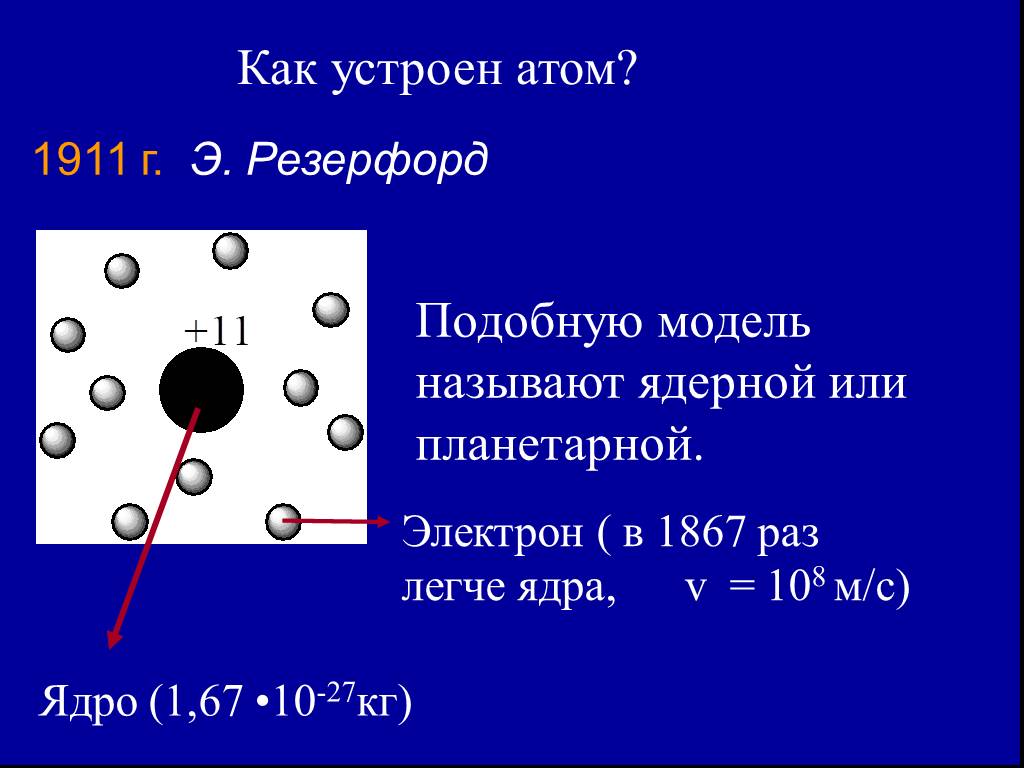
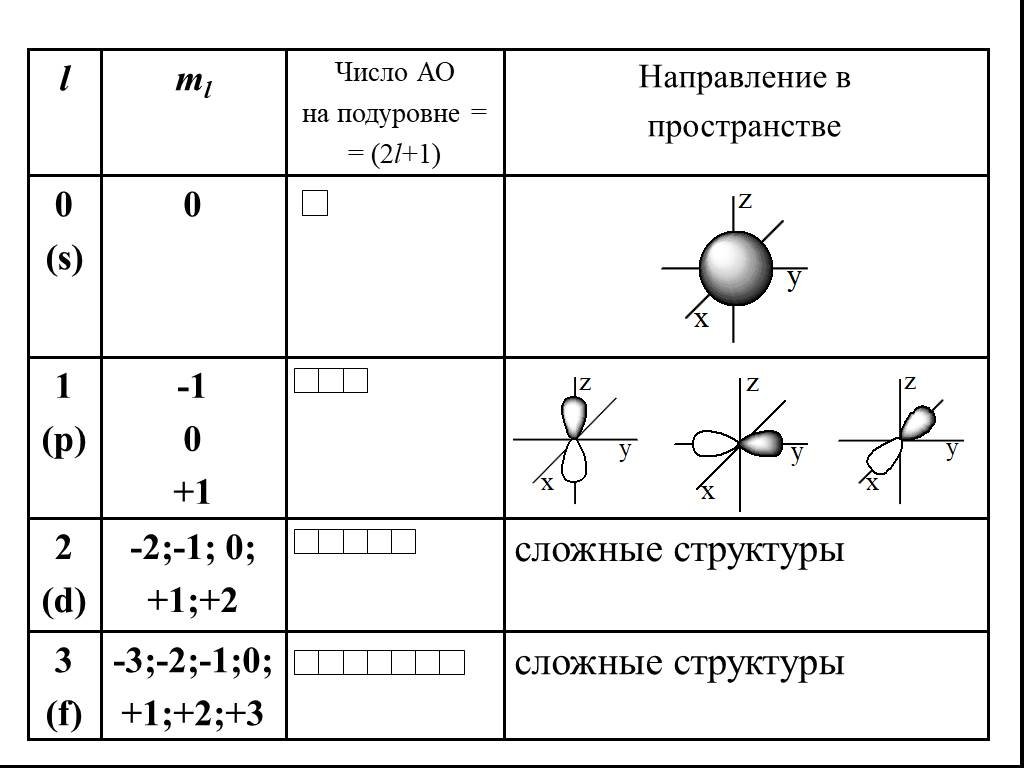
Презентация "Электрон" по химии – проект, доклад
Презентацию на тему "Электрон" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 41 слайд(ов).
Слайды презентации
Список похожих презентаций
Незнайка в стране химия
Я – известный химик Незнайка. Я знаю все и все могу. Сейчас я взмахну волшебной палочкой и начнется извержение вулкана. Смотри! А теперь все за мной ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...М.В. Ломоносов и химия
- М.В. Ломоносов был создателем многих химических производств (неорганических пигментов, глазурей, стекла, фарфора). - Он разработал технологию и ...Своя игра. Физика и химия
Интегрированный урок ФИЗИКА+ХИМИЯ. Авторы: Орлова И.В., Шувалова Л.В. Муниципальное образовательное учреждение Фоминская средняя общеобразовательная ...Строение вещества химия
СТРОЕНИЕ ВЕЩЕСТВА. Основополагающий вопрос КАК УСТРОЕН МИР? Проблемные вопросы Из чего сделано все на Земле? Почему все устроено так, а не иначе? ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Аналитическая химия
Определение. Аналити́ческая хи́мия — раздел химии, изучающий химический состав и структуру веществ; имеет целью определение элементов или групп элементов, ...Аналитическая химия
План доклада. Аналитическая химия (определение) Гармонизация терминологии по аналитической химии Роль терминологии Источники терминологии Цели и задачи ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...алюминий химия
получение алюминия. Применение алюминия. ...«Электролитическая диссоциация» химия
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...«Окислительно-восстановительные реакции» химия
СОДЕРЖАНИЕ:. 1. Какие реакции называются окислительно-восстановительными? 2. Что называют окислителем, восстановителем? 3. Окислительно-восстановительный ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...Органическая химия
история развития органической химии предмет органической химии особенности органических веществ Бутлеров теория строения органических соединений Бутлерова ...Аналитическая химия
Цель программы:. Фундаментальная подготовка магистрантов в области аналитической химии со знанием современных физико-химических методов анализа (хроматографических, ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Белки химия
Содержание. Определение Функции белков Источники аминокислот Строение полипептидной цепи Структура белка Химические свойства Превращения белков в ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Бытовая химия
Цель исследования, изучить влияние препаратов бытовой химии на здоровье человека. Задачи исследования: 1. Изучить опасности современной бытовой химии; ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 ноября 2018
Категория:Химия
Содержит:41 слайд(ов)
Поделись с друзьями:
Скачать презентацию

















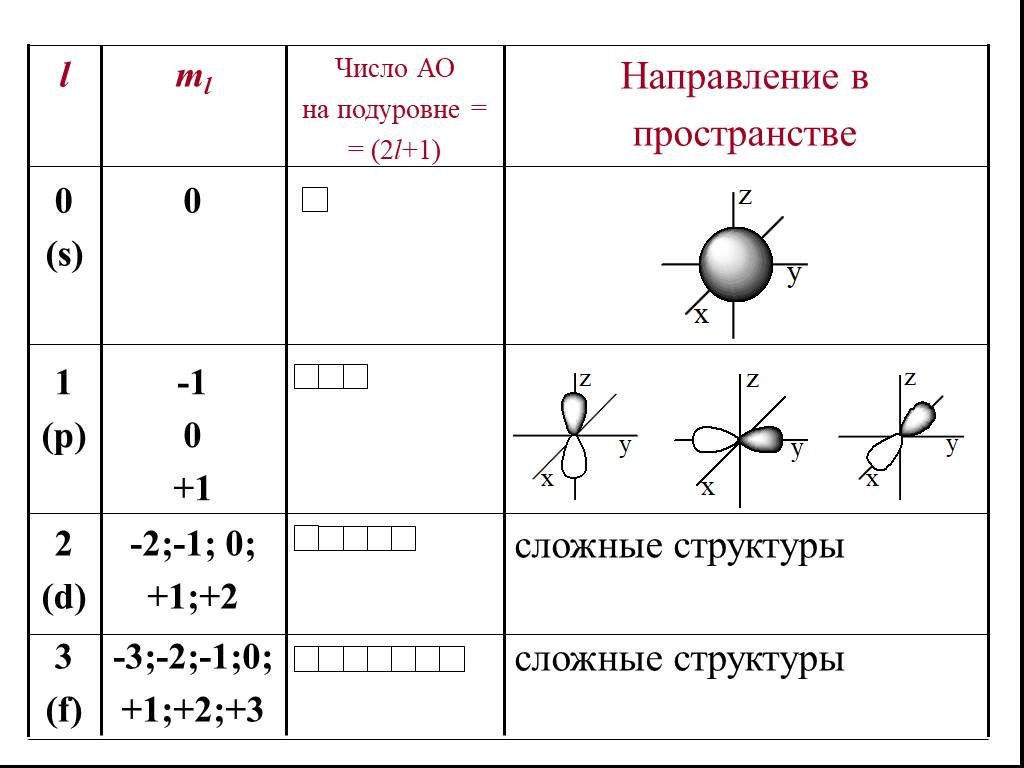











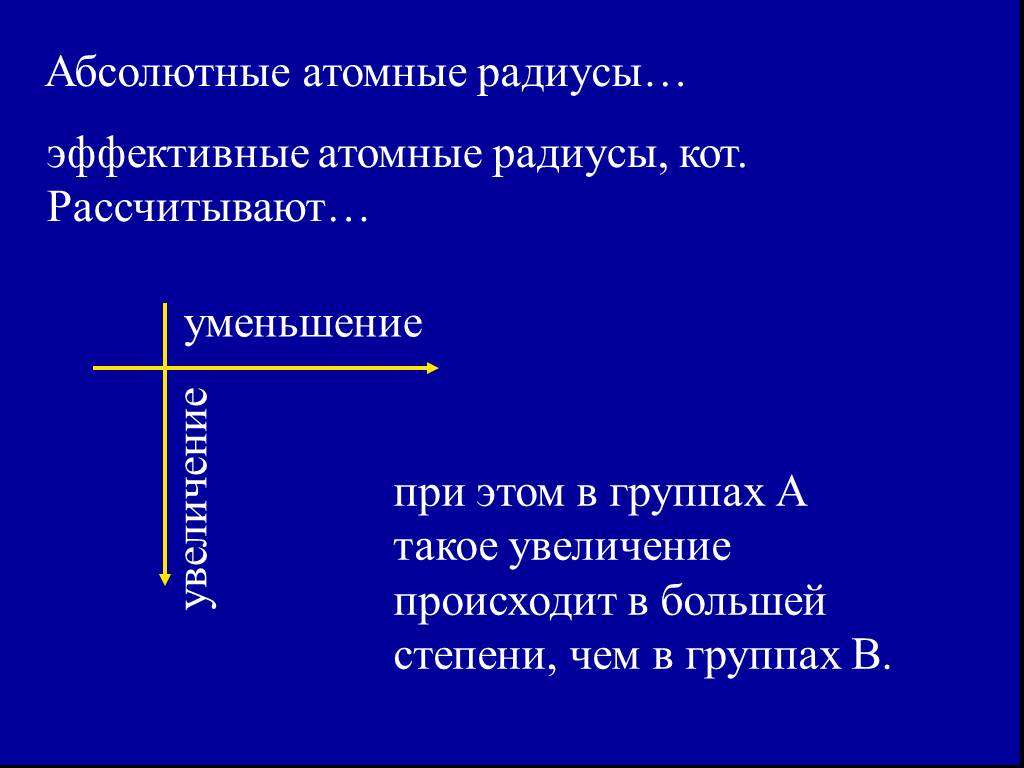

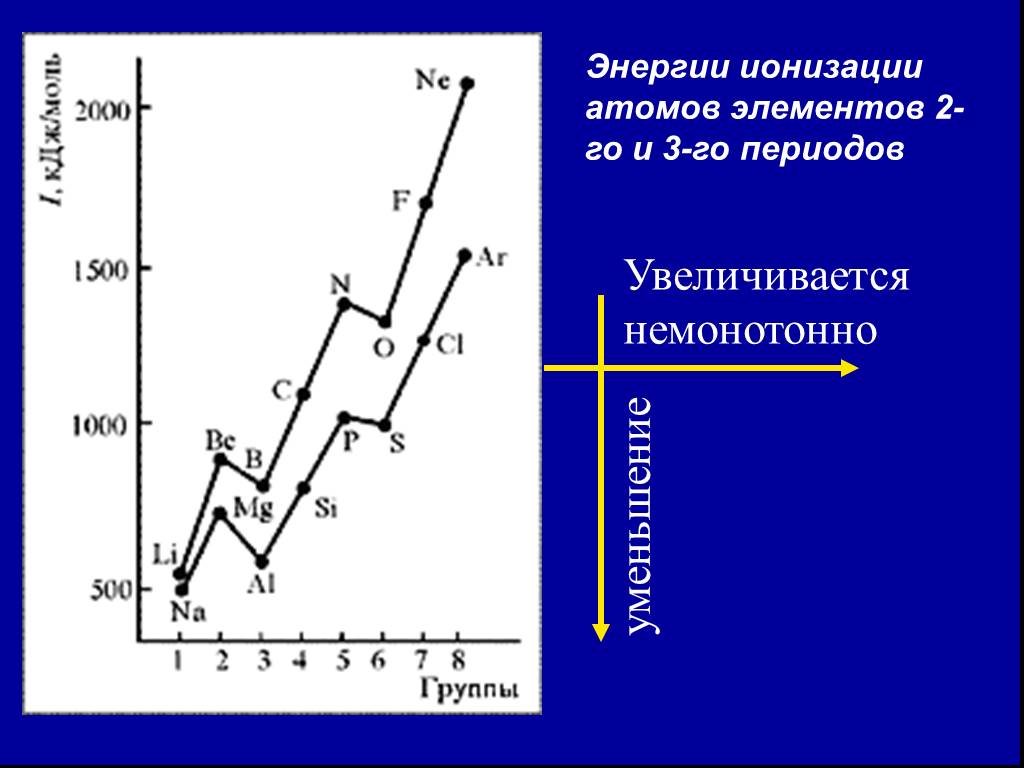
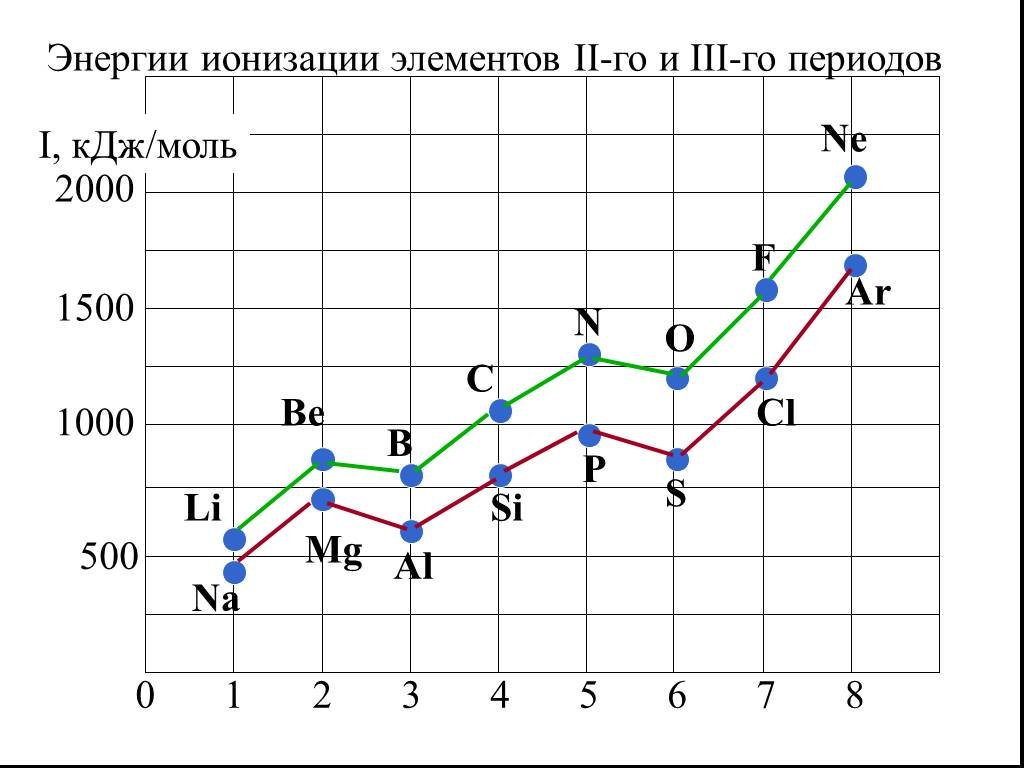


























![2. Энергия ионизации (Еион) [кДж/моль] или [эВ/атом] (1эВ/атом= 100 кДж/моль. ). – это …. Характер изменения в периодах одинаков: 2. Энергия ионизации (Еион) [кДж/моль] или [эВ/атом] (1эВ/атом= 100 кДж/моль. ). – это …. Характер изменения в периодах одинаков:](https://prezentacii.org/upload/cloud/18/11/101293/images/thumbs/screen32.jpg)


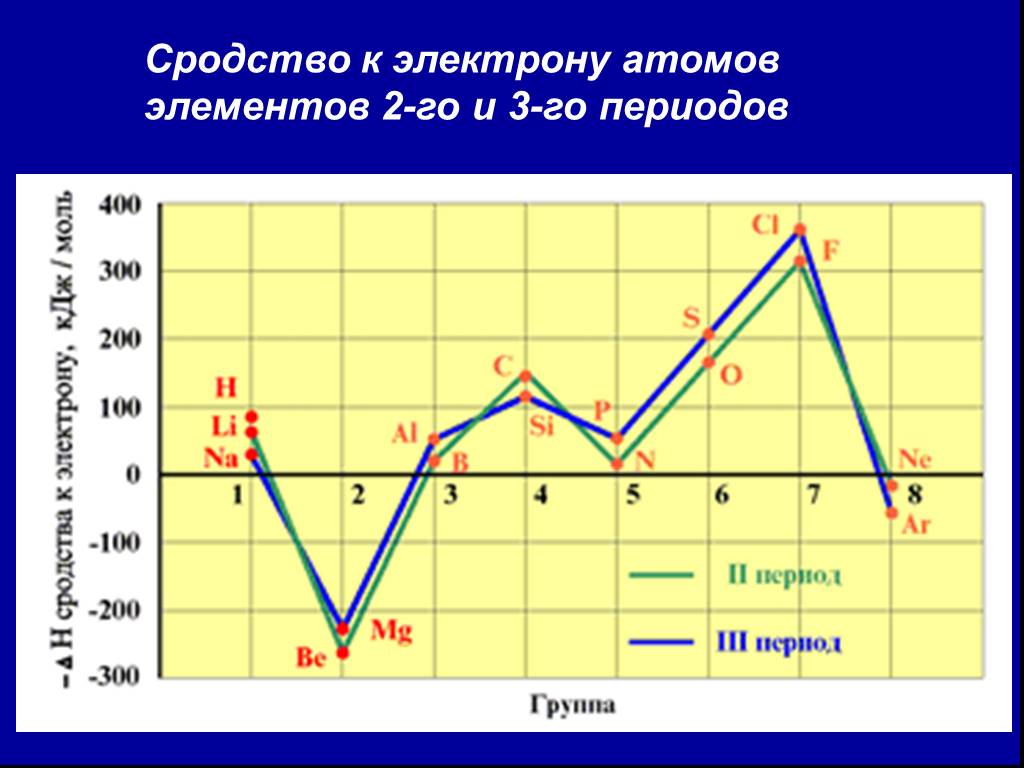
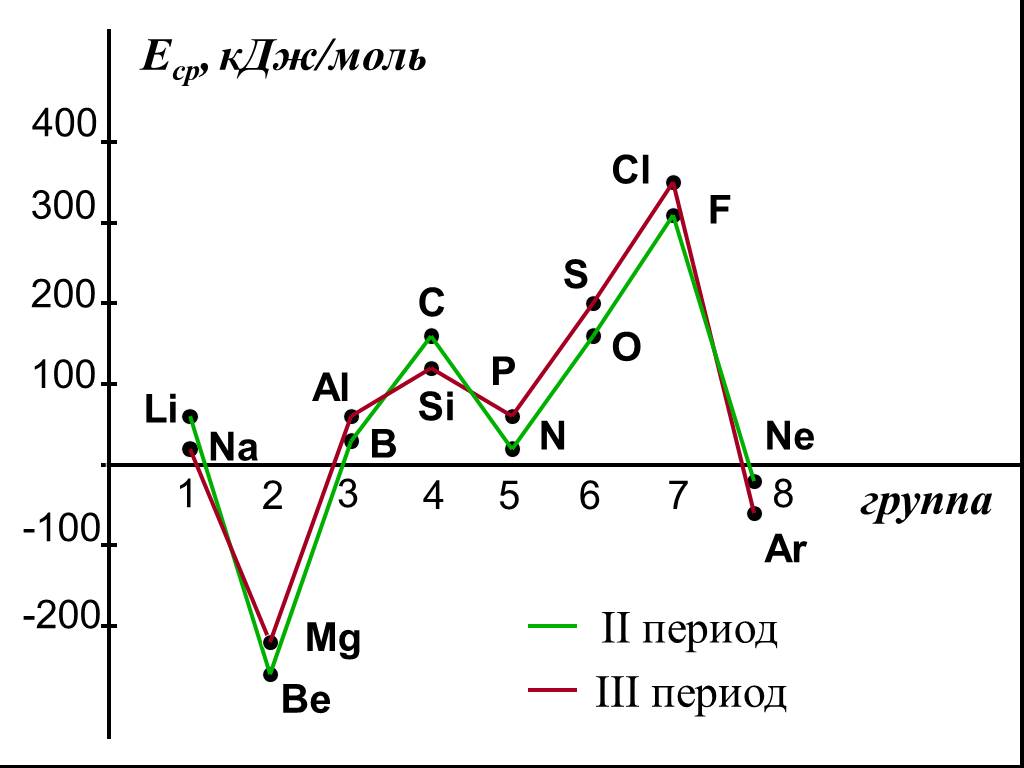
![2. Сродство к электрону (Еср.) [кДж/моль] или [эВ/атом] - это … 2. Сродство к электрону (Еср.) [кДж/моль] или [эВ/атом] - это …](https://prezentacii.org/upload/cloud/18/11/101293/images/thumbs/screen36.jpg)
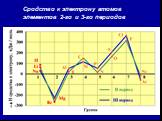

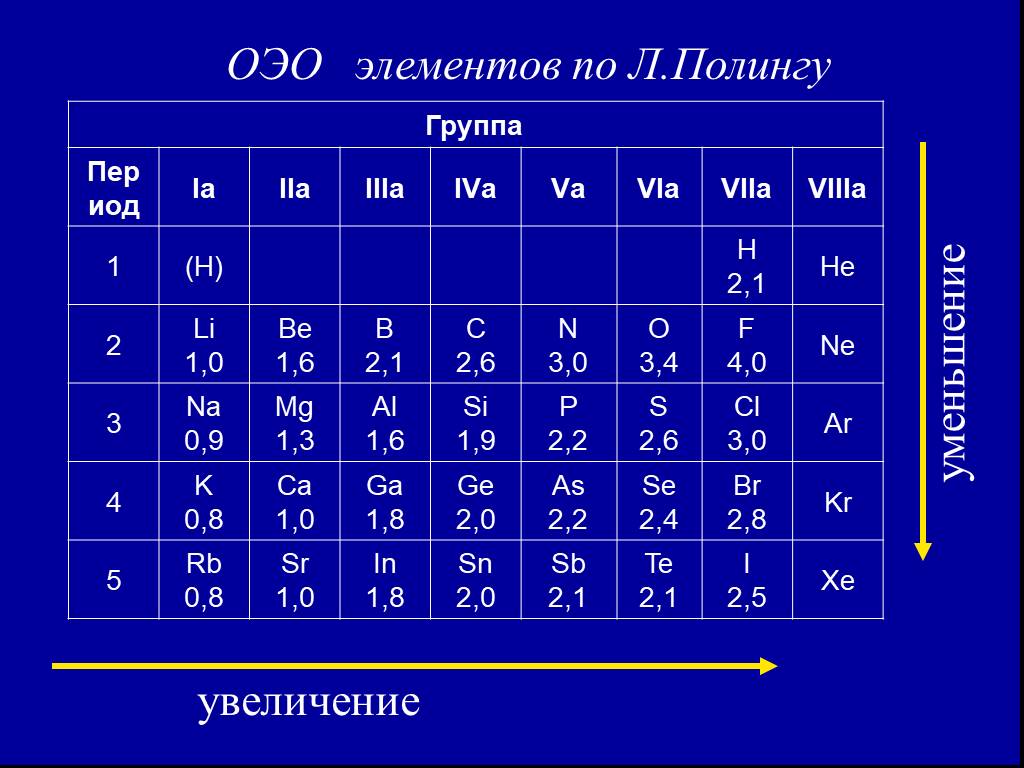
![3. Электроотрицательность () [кДж/моль] или [эВ/атом] – характеризует …. χ Li = ½ (500+60) = 280 кДж/моль. χ F = ½ (1700+310) = 1005 кДж/моль. По Полингу χ Li условно принята за 1, тогда χ F = 1005 /280 = 3,6 . Т.о. получается безразмерная величина - относительная электроотрицательность (ОЭО). 3. Электроотрицательность () [кДж/моль] или [эВ/атом] – характеризует …. χ Li = ½ (500+60) = 280 кДж/моль. χ F = ½ (1700+310) = 1005 кДж/моль. По Полингу χ Li условно принята за 1, тогда χ F = 1005 /280 = 3,6 . Т.о. получается безразмерная величина - относительная электроотрицательность (ОЭО).](https://prezentacii.org/upload/cloud/18/11/101293/images/thumbs/screen40.jpg)