Конспект урока «Ионное произведение воды. Водородный показатель» по химии для 11 класса
Урок химии в 11 классе
«Ионное произведение воды. Водородный показатель»
(химико-биологический класс)
Тип урока: приобретение новых знаний
Девиз урока:
Просто знать - еще не все,
знания нужно уметь использовать.
Гете
Цель урока: научить учащихся грамотному применению знаний, полученных на уроке, в повседневной жизни.
Образовательные задачи: познакомить учащихся с понятиями «ионное произведение воды», «водородный показатель»; показать значение знаний о концентрации ионов водорода в многочисленных химико-технологических процессах, разнообразных отраслях производства, сельском хозяйстве, медицине и биологии.
Воспитательные задачи: продолжить формирование основных мировоззренческих идей о материальности мира, причинно-следственных связей.
Развивающие задачи: продолжить развитие познавательного интереса школьников, умений выделять главное, сравнивать, обобщать.
Методы и методические приемы: фронтальный опрос, беседа, объяснение, рассказ учителя, дидактические игры, демонстрация средств наглядности, демонстрация электронной презентации учителя, демонстрация видеофрагмента, демонстрация фрагмента мультимедийного пособия, лабораторный эксперимент, компьютерное тестирование.
Оборудование: компьютер, мультимедийный проектор, телевизор, электронная презентация учителя, видеофрагмент рекламы жевательной резинки «Орбит», таблица «Индикаторы»различные парфюмерные и гигиенические средства, на этикетках которых указана кислотность среды, жевательные резинки, штативы с пробирками .
Реактивы: на демонстрационном столе - растворы индикаторов, водный раствор кислоты, водный раствор щелочи, свекольный сок, водный раствор мыла, универсальная индикаторная бумага; на столах учащихся - растворы индикаторов, водный раствор кислоты, водный раствор щелочи, универсальная индикаторная бумага
Ход урока.
-
Организационный момент.
-
Повторение ранее изученного материала (по теме «Электролитическая диссоциация»)
-
Работа ученика у доски с индивидуальным заданием (задача)
К 100 мл раствора хлорида кальция с массовой долей соли 10,6% (пл. 1,05 г/мл) добавлено 30 мл раствора карбоната натрия с массовой долей 38,55% (пл. 1,1 г/мл). Определите массовые доли соединений, содержащихся в растворе после отделения осадка.
-
Работа ученика у доски с индивидуальным заданием (составление уравнений реакций ионного обмена)
Составьте молекулярные и ионные уравнения практически осуществимых реакций:
оксид меди (II) и азотная кислота; нитрат калия и сульфат меди (II); гидроксид железа (II) и оксид углерода (IV); гидроксид алюминия и соляная кислота; сульфат натрия и нитрат бария; карбонат кальция и соляная кислота; нитрат серебра и хлорид бария.
-
Экспериментальная задача на распознавание веществ (индивидуальная работа)
Используя выданные реактивы, распознайте растворы хлорида натрия, сульфата натрия, карбоната натрия. Составьте уравнения проведенных реакций в молекулярном и ионном виде.
-
Компьютерное тестирование (индивидуальная работа)
-
Фронтальная беседа с классом
-
(Слайд №1 из электронной презентации учителя) Изучая свойства растворов солей, кислот и оснований шведский ученый С. Аррениус пришел к заключению, что все вещества можно разделить на две группы по их способности проводить электрический ток. Назовите эти группы, дайте им определения.
-
Игра «Химический цветок»: на лепестках «химического цветка» указаны формулы веществ. Распределите лепестки цветка по группам: «электролиты» и «неэлектролиты»
-
Электролиты
Неэлектролиты
-
(Слайд №2 из электронной презентации учителя) Какой процесс называется электролитической диссоциацией?
-
Сформулируйте положения теории электролитической диссоциации
-
В чем заключается сходство и различие механизмов диссоциации веществ с ионным типом связи от веществ с ковалентным полярным типом связи? (демонстрация фрагмента «Механизм электролитической диссоциации» из мультимедийного пособия «Химия 8-11. Виртуальная лаборатория»)
-
Какие частицы называются гидратированными ионами?
-
Как называется гидратированный ион водорода? Каков механизм его образования?
-
Что является количественной характеристикой электролитической диссоциации электролита? (слайд №3 из электронной презентации учителя)
-
Какая из кислот уксусная или хлоруксусная будет иметь большее значение степени электролитической диссоциации? Почему?
-
Проверка индивидуальных работ
-
Изучение нового материала
-
Вывод формулы ионного произведения воды
Прежде, чем мы перейдем к изучению новой темы, я прошу вас вспомнить, что называется кислотой и основанием с точки зрения теории электролитической диссоциации?
Из определений понятий «кислота» и «основание» следует, что кислотные или щелочные свойства растворов зависят от присутствия в них ионов Н+ или ОН-. Следовательно, кислотность или щелочность растворов может характеризоваться количественно. Цель нашего урока – выяснить, в чем заключается количественная характеристика кислотности растворов.
- В чем заключаются особенности поведения молекулы воды? Верно, в том, что молекула воды является одновременно и донором протонов и донором гидроксид-ионов (слайд №4 из электронной презентации учителя):
Н2О +Н2О Н3О++ ОН-
С целью упрощения в химических уравнениях чаще пишут просто символ катиона водорода, подразумевая под ним катион гидроксония: Н2О Н++ ОН-
Диссоциация – процесс обратимый. Наряду с распадом молекул на ионы происходит процесс ассоциации. Известно, что состояние равновесия любого обратимого процесса, в том числе и электролитической диссоциации, можно охарактеризовать с помощью константы равновесия, которую в данном случае называют константой диссоциации Кд. Прошу вас составить выражение константы диссоциации воды:
Н+О Н–
Кд= -----------------
Н2О
Константа диссоциации каждого индивидуального вещества – величина постоянная. Измерения показывают, что вода диссоциирует в очень малой степени и ее константа диссоциации составляет 1,8 · 10-16, а концентрация недиссоциированных молекул воды практически постоянна и равна общему числу молекул воды в 1 литре, т.е. 1000г : 18 г/моль = 55,56 моль. Если эту постоянную величину перенести в левую часть равенства, то мы получим новую константу – ионное произведение воды Кв.
Кв = Кд Н2О = Н+О Н-
Кв = 1,8 .10-16. 55,56 = 100 .10-16 = 10-14
Из уравнения диссоциации воды видно, что концентрация ионов водорода равна концентрации гидроксидид-ионов, поэтому можно записать, что
Н+О Н- = 10-14 = 10-7 моль/л
Из этого соотношения следует, что равновесные концентрации ионов водорода и гидроксид-ионов в водном растворе взаимосвязаны. Если к воде добавить кислоту, то концентрация ионов водорода в растворе увеличится, и поэтому она не будет равна концентрации гидроксид- ионов, а будет выше:
Кв
О Н- =-------
Н+
Кв
Н+ = ----------
О Н-
Таким образом, увеличение концентрации ионов водорода (добавление кислоты) обусловливает появление кислотных свойств раствора, а увеличение концентрации гидроксид-ионов (добавление щелочи) - появление основных свойств раствора. Если концентрация одного из ионов увеличивается, то концентрация другого должна уменьшаться, но их произведение всегда должно быть равно 10-14. Поэтому, зная концентрацию одного из ионов, легко рассчитать концентрацию другого. Для удобства вместо истинных значений концентраций ионов водорода и гидроксид- ионов используют их отрицательные логарифмы.
В 1909 году датский химик Серенсен предложил величину, называемую водородным показателем рН. (р – начальная буква слова «potens» - математическая степень; Н – символ водорода)
Водородный показатель – отрицательный десятичный логарифм концентрации ионов водорода:
рН = - lg Н+ или Н+ = 10-рН
Для чистой воды рН = - lg(10-7),т.е. рН = 7.
При увеличении концентрации ионов водорода рН уменьшается, при уменьшении концентрации ионов водорода рН увеличивается. Например, Н+ = 10-5 рН=5, среда кислая. Если Н+ = 10-9 рН=9, среда щелочная.
Демонстрация зависимости между концентрацией ионов водорода, значением рН и реакцией среды (демонстрация таблицы и слайда №5 из электронной презентации учителя):
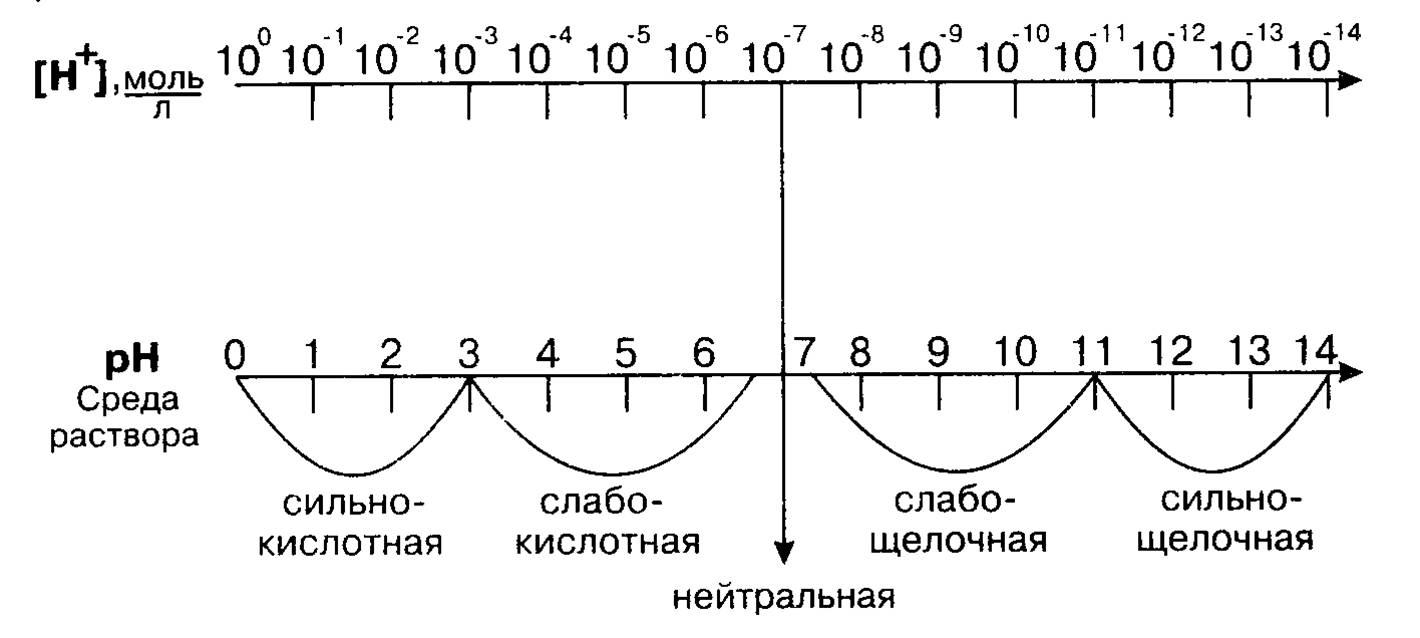
(Слайд №6 из электронной презентации учителя) Для определения показателя кислотности используют различные рН-метры, в частности дорогостоящие электронные приборы. Простым способом определения характера среды является применение индикаторов - химических веществ, окраска которых изменяется в зависимости от рН среды.
-
Работа с индикаторами
-
Какие индикаторы вам известны? Как они изменяют свою окраску в различных средах?
Демонстрация эксперимента по определению среды растворов с использованием метилового оранжевого, лакмуса, фенолфталеина.
В качестве индикаторов можно использовать и некоторые растения. Например, розовые лепестки герани станут голубыми в щелочной среде, а сок смородины или вишни станет синим в кислоте. Красящее вещество бетаин, содержащееся в свекле, в щелочной среде обесцвечивается, а в кислоте краснеет.
Демонстрация эксперимента по изменению окраски свекольного сока при добавлении кислоты и щелочи.
3. Значение рН в природе, технике, сельском хозяйстве
(Слайды № 7,8 из электронной презентации учителя) Исключительно велика роль рН в самых различных явлениях и процессах: и в природе, и в технике, т.к. в зависимости от реакции среды эти процессы могут протекать с различными скоростями и в разных направлениях. Поэтому определение кислотности среды растворов очень важно в медицине, технике, сельском хозяйстве. значение рН или показатель кислотно-щелочного равновесия является одним из важнейших параметров биохимических процессов, которые постоянно происходят в биохимических жидкостях нащего организма: слюне, моче, крови. Отклонения рН от нормальных величин даже на 0,01 единицы свидетельствуют о патологических процессах в организме (слайд №9 из электронной презентации учителя). Для поддержания кислотно-щелочного равновесия в организме существуют эффективные системы, способные обеспечить выведение или нейтрализацию водородных ионов при избытке или задержку ионов водорода в организме при их дефиците. К таким системам относятся буферные системы крови, дыхательная система, выделительная система (слайд №10 из электронной презентации учителя). Наиболее важная буферная система крови – бикарбонатная система (слайд №11 из электронной презентации учителя): Н2СО3 – NaНСО3. Общим ионом в этой системе является бикарбонат – ион НСО3 -. Большая часть гидрокарбонат-ионов образуется при диссоциации гидрокарбоната натрия:
NaHCO3 Na+ + HCO3-
Бикарбонат- ионы, освобождающиеся при диссоциации соли, подавляют диссоциацию слабой угольной кислоты, которая образуется в результате метаболических превращений веществ.
Механизм действия бикарбонатной системы крови:
при поступлении в кровь большого количества кислых эквивалентов ионы Н+ связываются ионами НСО3- и образуют слабо диссоциирующую угольную кислоту до тех пор, пока концентрация ионов водорода снова не придет к норме.
Н+ + HCO3- H2CO3
Если реакция крови сдвигается в щелочную сторону и в крови появляется избыток гидроксид-ионов, то угольная кислота соединяется с ними и образует воду и гидрокарбонат-ионы ОН- + H2CO3 Н2О +HCO3- до тех пор, пока реакция среды не вернется к физиологической норме. Таким образом, поступление в кровь избыточного количества ионов водорода или гидроксид-ионов не приводит к заметным сдвигам в концентрации ионов водорода в крови.
Такой же механизм действия и другой буферной системы крови – фосфатной (слайд №12 из электронной презентации учителя), роль кислоты в которой играет дигидрофосфат натрия NaH2PO4, а роль соли гидрофосфат натрия Na2HPO4. Общим ионом этой системе является гидрофосфат-ион НРО42-
НРО42- + Н+ H2PO4–
В тех случаях, когда кислотно-щелочное равновесие нарушается, развиваются два патологических состояния, противоположных по своей направленности: ацидоз (рН крови выше нормы – повышение кислотности) и алкадоз – (рН крови ниже нормы – понижение кислотности). Состояния, при которых рН 6,8 и рН 8,0 не совместимы с жизнью.
Таким образом, постоянство концентраций ионов водорода является одной из важных констант внутренней среды живых организмов.
Знания о рН необходимы и для работников сельского хозяйства. Нормальное развитие разных сельскохозяйственных культур возможно лишь в определенных интервалах значений рН почвенного раствора. Для снижения кислотности почв применяют известкование (вносят в почву карбонат кальция и карбонат магния), а для снижения щелочности – гипсование( вносят в почву молотый гипс).
А теперь – рекламная пауза: на экране телевизора демонстрируется фрагмент рекламы жевательной резинки, сюжет которой заканчивается изображением синусоиды, показывающей изменение рН среды в ротовой полости.
Объясните, что обозначает данная кривая в этом фрагменте? (изменение рН среды в ротовой полости до приема пищи и после использования жевательной резинки)
Каждый раз, когда вы едите, нарушается кислотно-щелочной баланс в полости рта. Эта реклама призывает нас к употреблению жевательной резинки с целью восстановления кислотно-щелочного баланса в ротовой полости после приема пищи. Попробуйте оценить с позиций химика, насколько справедлива эта реклама, насколько эффективна жевательная резинка в восстановлении рН среды в ротовой полости после приема пищи. (Учащиеся ведут дискуссию по поставленной проблеме, после чего учитель дает пояснения)
Далеко не каждый раз после приема пищи во рту нарушается кислотно-щелочное равновесие. Например, оно не нарушается при приеме белковой пищи. При употреблении углеводов под действием бактерий, содержащихся в полости рта, происходит брожение с образованием молочной кислоты, которая снижает значение рН во рту и способствует разрушению зубной эмали. Как может помочь жевательная резинка? В составе жевательной резинки содержатся различные заменители сахара: ксилит, сорбит. Они являются многоатомными спиртами и обеспечивают приятный сладкий вкус, не поставляя углеводы. При жевании происходит лишь частичная механическая очистка зубов от остатков пищи, не влияющая на изменение кислотности в ротовой полости. Если же жевательная резинка содержит карбамид (NH2)2CO, то такая резинка способна нейтрализовать некоторую часть молочной кислоты. При гидролизе карбамида происходит образование гидроксида аммония, который и нейтрализует молочную кислоту:
СН3СН(ОН)СООН + NH4OH СН3СН(ОН)СООNH4 + Н2O
А почему реклама жевательных резинок, содержащих карбамид, обещает защиту зубов с утра до вечера? Несмотря на преувеличение, которое присутствует в любой рекламе, это утверждение не лишено смысла с точки зрения химика. Карбамид гидролизуется очень медленно, поэтому гидроксид аммония образуется в ротовой полости рта постепенно (слайд №13 из электронной презентации учителя).
Какова среда раствора в косметических и парфюмерных средствах?
Проведение эксперимента по определению рН водного раствора шампуня.
Почему на многих этикетках указано, что рН=5,5?
Демонстрация парфюмерных, косметических средств, средств санитарной гигиены (гели для душа, лосьоны, жидкие и твердые мыла, шампуни и т.д.)
Значение рН=5,5 наиболее соответствует естественной реакции кожи. Физиологи доказали, что роговой слой кожи имеет рН = 5,5 за счет находящихся в нем водорастворимых веществ.
Какова кислотность водного раствора мыла?
Проведение эксперимента по определению рН водного раствора мыла.
Воздействие сильнощелочных моющих средств может изменить нормальное значение рН кожи. Что такое мыла?
Мыла – это натриевые и калиевые соли высших карбоновых кислот. Жирную кожу, склонную к воспалительным процессам, не рекомендуется слишком часто мыть водой с мылом. Почему?
-
Закрепление
1. Познакомьтесь с таблицей значений рН некоторых объектов о ответьте, почему чистая дождевая вода имеет слабокислую реакцию (рН=5,6) (слайд №14 из электронной презентации учителя)?
| Значение рН | |
| Желудочный сок | 1 |
| Кислотные туманы | 2 |
| Апельсиновый сок | 4 |
| Томаты, виноград | 4,2 |
| Черный кофе | 5 |
| Дождевая вода | 5,6 |
| Яйца | 8 |
| Пищевая сода | 8,7 |
| Мыльные растворы | 10,5 |
| Средства для удаления волос | 13 |
2. Рассчитайте концентрацию катиона водорода в разбавленной серной кислоте с рН=1,79.
-
Вычислите концентрацию ионов водорода в водном растворе где концентрация гидроксид-ионов равна 0,02 моль/л.
-
Домашнее задание
Выучить параграф № 15, стр. 156 упражнения №6, 7
VI. Комментарий оценок
Здесь представлен конспект к уроку на тему «Ионное произведение воды. Водородный показатель», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (11 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

