Конспект урока «Вода» по химии для 8 класса
Муниципальное бюджетное общеобразовательное учреждение
«Краснощёковская средняя общеобразовательная школа№1»
Краснощековского района
Алтайского края
Конспект урока по химии
в 8 классе
«Вода»
подготовила
учитель химии и биологии
Гревцова Валентина Александровна
с.Краснощеково
2013
Оглавление
-
Введение …………………………………………………..2
2. Основная часть
2.1 План конспект урока…………………………………6
3.Список использованной литературы………………………13
5. Приложение
Приложение 1 ……………………………………………...14
Приложение 2 ……………………………………………...17
Приложение 3 ……………………………………………...18
Приложение 4 ……………………………………………...19
Приложение 5 ……………………………………………...20
Приложение 6………………………………………………21
Пояснительная записка.
Этот урок был проведен в 8 классе при изучении темы «Вода» c использованием интерактивной доски Smart Notebook. Урок дает возможность выявить межпредметные связи с физикой, биологией, географией.
На данном уроке учащиеся развивают умения сравнивать, обобщать, устанавливать причинно-следственные связи, способствует развитию навыков самостоятельной работы с дополнительной литературой, раздаточным материалом.
Урок позволяет развивать познавательную активность учащихся через подготовку сообщений о биологической роли воды, о памяти воды; приобщить школьников к чтению научно-популярной литературы;
Не менее ценным является возможность развития на уроке коммуникативных умений: научить принимать самостоятельные решения, работать в группе, выполнять различные социальные роли и навыков работы на интерактивной доске.
Предварительная подготовка к уроку:
Учащиеся делятся на 4 группы. В качестве домашнего задания каждой группе предлагалось найти интересные сведения о воде; о значении воды для жизни на Земле, о том, где вода встречается в природе.
Обеспечение занятия:
Мультимедийная установка, интерактивная доска, (презентационное сопровождение, выполненное в программе Smart Notebook )
DVD- фильм «Великая тайна воды» фильм 1, презентации, выполненные учащимися, таблицы по темам: «Водородная связь», «Свойства воды», «Справочник по элементарной физике».
Оборудование для практической работы в группах лёд, тонкая стеклянная трубка, монетки, вода, химические стаканы с водой.
Оборудование для лабораторных опытов «Химические свойства воды»: пробирки в штативе, вода, фенолфталеин, спиртовки, металлы (кальций, железо, медь) оксиды металлов (оксид кальция, оксид магния).
метилоранж, оксиды неметаллов (оксид фосфора (V), оксид кремния).
Цели урока:
- Обобщить и систематизировать знания по теме, закрепить практические навыки при выполнении экспериментов, повысить интерес к предмету и мотивацию обучения.
- Продолжить формирование у учащихся критического, логического мышления и умения делать обоснованные выводы.
- Научить принимать самостоятельные аргументированные решения, работать в команде, выполнять различные социальные роли.
- Cоздать условия для усвоения нового материала, используя проблемно - деятельностное обучение, мотивационные приемы.
Задачи:
- Повторить материал о физических свойствах воды.
- Обобщить знания о нахождении воды в природе и ее значении для живых организмов.
- Изучить химические свойства воды.
- развивать познавательный интерес, реализуя межпредметные связи курсов биологии, химии, литературы;
- Определить уровень овладения знаниями, провести коррекцию знаний, умений и навыков.
- Отработать навыки работы на интерактивной доске.
Методы обучения: беседа, объяснение, самостоятельная работа, экспериментальная работа.
Тип урока: урок изучения нового материала.
Вид урока: комбинированный
Ход урока:
I.Организационный момент.
Учитель: Сегодня у нас необычный урок – урок, на котором мы будем рассматривать вопрос, который изучается и в курсе химии и физики.
II.Мотивация урока
Показывается фрагмент DVD – фильма «Великая тайна воды». Фильм 1
Учитель:
- И так что на сегодняшнем уроке будет объектом нашего обсуждения? (Вода)
-Другие мнения есть?
- Вы согласны с ответом? (Да)
-Конечно, наш разговор пойдёт о воде.
II. Подготовка к усвоению нового материала. Целепологание.
Слайд 1
Тема урока: «Вода»
Запись числа и темы урока.
Слайд 2
Учитель:
– С водой мы встречаемся каждый день и по несколько раз в день .
Вода вещество, без которого не могут жить люди, животные, растения.
Об этом говорят слова Экзюпери, которые являются эпиграфом нашего урока.
«... Тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое!
Нельзя сказать, что ты необходима для жизни. Ты – сама жизнь.
Ты наполняешь нас радостью, которую не объяснить нашими чувствами.
С тобой, возвращаются к нам силы, с которыми мы уже простились.
Ты – самое большое богатство в мире!»
Учитель:
-В природе нет вещества более известного, чем вода. О воде вы говорили на уроках природоведении, географии и биологии.
-А что бы вы хотели узнать о воде на сегодняшнем уроке?
( Ответы учащихся)
Слайд 3
Цель урока:
- обобщить, углубить имеющиеся знания о воде из области природоведения, биологии, географии.
- расширить представления о свойствах воды
- узнать, что - то нового и даже необычного об этом веществе.
План урока:
1.Роль воды в жизни человека.
2.Физические свойства воды и их аномальность.
3.Химические свойства воды.
4.Интересное о воде.
III. Подготовка к работе, актуализация знаний.
Учитель:
-Вода наиболее распространённое и обыкновенное вещество, привычное в нашей повседневной жизни. Но такое ли уж оно обычное? Что вы знаете о воде? Вам в качестве домашнего задания предлагалось найти и приготовить сообщение о роли воды в нашей жизни. Кто готов поделиться своими мыслями? Сообщения учащихся.
Учитель:
- Вода в организме как видите, выполняет две роли растворителя и переносчика веществ. Потеря 20-25% воды от массы тела ведёт к гибели человека.
Учитель : А какие свойства воды вам известны?
(Вода - жидкость без цвета, без запаха, без вкуса, это единственное вещество,которое может находиться в трех агрегатных состояниях (жидкость, пар, лед) ; t-ра кипения воды-100, t-ра плавления льда-0;)
III.Получение новой информации, осознание и осмысление.
Учитель :
-Но это не все свойства, которыми вода обладает, вот с ними мы и будем знакомиться на сегодняшнем уроке.
Практическая работа в группах: (См.приложение 1)
Каждая группа получает задание и в течение 4-5 минут работает, затем представители от каждой группы зачитывают отчёт по своему заданию.
(В процессе отчета учащиеся заполняют таблицу «Физические свойства воды»)
(См.приложение 2 «Физические свойства воды»)
Учитель: Выполняя данные опыты, вы выяснили основные физические свойства воды. И если внимательно изучить заполненную вами таблицу, то станет видно, что эти свойства аномальны.
- Какие же особенности строения молекулы воды обеспечивают эти свойства?
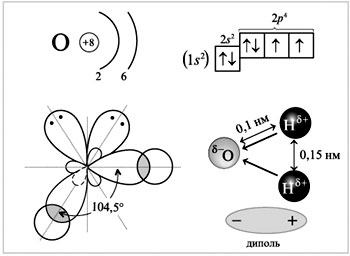
- Рассмотрим строение молекулы воды. (См . приложение 3)
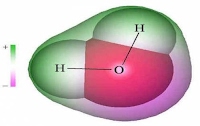
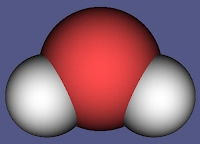
Молекула воды из атома кислорода и двух атомов водорода, присоединившихся к нему под углом 104,50 .
Кроме того молекулы воды, образованные ковалентной сильно полярной связью, электростатически притягиваются друг к другу, и образуют «ажурные» структуры. Такое взаимодействие называют водородной связью.
- Обратите внимание: (см.приложение 3) полярность связи Н-О и угловая форма создают полярность всей молекулы в целом. Угол 104,50 между связями в молекуле воды обуславливает рыхлость льда и жидкой воды и как следствие аномальную зависимость плотности от температуры..
Именно поэтому крупные водоёмы не промерзают до дна, что делает возможным существование в них жизни.
Учитель:
- А какими еще свойствами обладают вещества?
(химическими)
- Рассматривая химические свойства веществ мы, о чем говорим?
( О взаимодействии данного вещества с другими веществами).
Учитель:
- Нам предстоит рассмотреть, с какими веществами взаимодействует вода.
- Для этого давайте вспомним, как классифицируются вещества?
Слайд 5
Классификация веществ.
(Дети, используя схему слайда, классифицируют вещества: простые (металлы и неметаллы) и сложные ( оксиды: основные и кислотные, кис лоты, основания, соли)
Лабораторные опыты:( Прежде чем ребята приступят к выполнению опытов они повторяют технику безопасности.)
Учитель :
- Рассмотрим взаимодействие воды с металлами и оксидами металлов и неметаллов. (Каждая группа выполняет свой опыт, делая выводы).
(Прежде чем ребята приступят к выполнению опытов, они повторяют технику безопасности.)
- 1-ая группа учащихся - демонстрирует опыты с металлами (Ca, Fe, Cu).
(Активными, малоактивными и неактивными). (См. приложение № 4)
Записываются уравнения реакций в тетрадях и на доске- для всего класса.
Ca + 2 H2O = Ca (O H)2 + H2 - реакция замещения
Вывод: активные металлы –Li,Na,K,Rb,Cs,Fr,Ca,Sr,Ba,Ra +Al - реагируют так Me + H2O = Me (O H)n + H2
основание
Fe + H2O = FeO + H2 - реакция замещения
Вывод: металлы средней активности, стоящие в ряду активности до (Н2)
Be,Mg,Fe,Pb,Cr,Ni,Mn,Zn - реагируют так
Me + H2O = Me хOу + H2
Оксид металла
Cu + H2O = нет реакции
Вывод: металлы, стоящие в ряду активности после водорода, не реагируют с водой.
2-ая группа демонстрирует опыт взаимодействия воды с оксидами металлов (оксид кальция, оксид магния) (см. приложение № 4)
Записываются уравнения реакций в тетрадях и на доске- для всего класса.
BaO + H2O = Ba (O H)2 реакция соединения
MgO+ H2O = нет реакции
Вывод: H2O + основный оксид = Me (O H)п
Al2O3 + H2O = нет реакции
BeO + H2O = нет реакции
MgO + H2O = нет реакции
3-я группа демонстрирует опыты взаимодействия воды с оксидами не металлов (оксид фосфора (V), оксид кремния) (См. приложение № 4)
Записываются уравнения реакций в тетрадях и на доске -для всего класса.
P2 O5 + 3H2O = H 3PO4 реакция соединения
Вывод: H2O + кислотный оксид = кислота
Si O2 + H2O = нет реакции
Задание 4-й группе (теоретическое)
Взаимодействие воды с неметаллами. (См. приложение № 4)
Задание: С какими неметаллами может реагировать вода?
Напишите уравнения проделанных реакций.
C + H 2O = H2 + CO (при сильном нагревании)
Учитель:
-Да, поистине вода – удивительнейший из природных материалов, образцы которого не экспонируются ни в одном из минералогических музеев мира. Почти все свойства воды – исключение в природе.
И все - таки, в чем ее исключительность и необычность?
( Только вода может находиться в трех агрегатных состояниях: твердом жидком, и газообразном. Вода - может гореть).
Учитель.
- Послушайте сообщение об уникальных свойствах воды.
«Удивительное вещество – вода». (См.приложение6)
(Сообщение ученика)
Учитель: Ещё одним необычным свойством обладает вода - памятью.
-Сообщение учащегося о памяти воды.
IV.Отработка нового материала.
Учитель: 2
Слайд 6
Задание: Разделите вещества на группы:
Fe,Ca,BaO,Hg,Al,CuO,Ag,K,Cu,Fe,Na 2 O,MgO;
А). взаимодействуют с водой;
Б). не взаимодействуют с водой;
Слайд 7
Учитель:
Задание: - Вставьте нужные слова вместо точек. (См.приложение 5)
V.Домашнее задание.
Физика: переписать физические свойства воды в тетрадь;
Химия: стр.83-86,записи в тетради.
Творческие задания о воде: придумать ребусы и кроссворд и нарисовать, найти пословицы и поговорки о воде (по желанию)
VI.Подведение итогов урока.
Оценивание учащихся: учитывается активность учащихся, точность ответов, не исключается возможность повышения оценки учащимся.
Рефлексия:
- Какова была цель урока?
- Как вы считаете, достигли мы этой цели?
- Как добились реализации цели?
- Что нового и полезного вы узнали на уроке?
- Были ли трудности, и какие?
- Что помогало в достижении цели?
- Что мешало?
- Сегодня вы работали много и хорошо.
- Молодцы!
- Всем спасибо за урок!
Список использованной литературы:
1 Еремина Е.А.,Еремин, Е.Е.,Кузьменко Н.Е. Химия Справочник школьника по химии 8-11класс; М. Дрофа.
2.Учебно - методический журнал для учителей химии и естествознания №2 2012 стр.42
3.Крицман В.А. Книга для чтения по неорганической химии. М. Просвещение, 1983.
4.Лидин Р.А. Справочник по общей и неорганической химии. М. Просвещение, 1997.
5.Рудзитис Г.Е, Фельдман Ф.Г. Химия 8 класс, М. «Просвещение» 2012г.
6. Тыльдсепп А.А., В.А. Корк, «Мы изучаем химию», М.,»Просвещение» 1988 г.
Интернет ресурсы:
7.http://www.google.ru/search?
8.http://mirfactov.com/wp-content//prezentacii.org/upload/cloud2/tip_of_the_iceberg.jpg
9.http://old.kpfu.ru/nilkto/cell/rasdel1/water.gif
Приложение
Приложение 1
Практическая работа в группах.
Задание 1-й группе
-
Опустите кусочки льда в стакан с водой. Что вы наблюдаете? Что вы можете сказать о плотности воды и льда? Конкретные сведения о плотности воды и льда можно получить из «Справочника по элементарной физике» (Енохович). С какими особенностями воды вы познакомились?
Кратко прокомментируйте свои результаты.
По окончании исследования афишируйте свои выводы в любой интересной для вас форме (текст, рисунок, стих, представление). Предположите, какую роль в живых системах может выполнять вода благодаря этому свойству?
Отчет 1-й группы
-
Кусочки льда не тонут в воде. При замерзании молекулы воды расположены таким образом, что между ними возникают большие пустоты, и поэтому лед, легче, чем жидкая вода. По справочнику мы определили, что плотность воды равна 1 г/см3, а плотность льда равна 0,92 г/см3 Плотность льда меньше плотности жидкой воды, следовательно, лед легче воды.
Вывод (афиширование):
1) Лед легче воды и может плавать на ее поверхности.
Задание 2-й группе
-
В стакан с водой медленно опустите стеклянную трубку малого диаметра. Что вы наблюдаете?
Кратко прокомментируйте свои результаты. По окончании исследования афишируйте свои выводы в любой интересной для вас форме (текст, рисунок, стих, представление).
Отчет 2-й группы
-
По тонкой стеклянной трубке вода поднялась на высоту, превышающую ее уровень в стакане с водой. Думаем, что она удерживается на этой высоте из-за притяжения молекул воды стенками стеклянной трубки. Итак, молекулы воды благодаря водородным связям между молекулами - диполями подниматься по тонким трубочкам-капиллярам. Т.Е. мы имеем дело с капиллярностью. Капиллярность-это физическое явление поднятия и удержания воды в тонких капиллярных трубках, порах, трещинах г. п. и почв под воздействием сил поверхностного натяжения, развивающихся на границе твердой и жидкой фаз.
Вывод:
2) Благодаря водородным связям вода обладает капиллярностью.
Задание 3-й группе
Вам известно, что вода закипает и переходит в парообразное состояние, при температуре 100 °С. Используя «Справочник по элементарной физике», сравните температуру кипения воды с температурой кипения других жидкостей. Объясните полученные результаты. Предположите, какую роль в живых системах может выполнять вода благодаря этому свойству?
Кратко прокомментируйте свои результаты.
По окончании исследования афишируйте свои выводы в любой интересной для вас форме (текст, рисунок, стих, представление).
Отчет 3-й группы
Из данных, приведенных в справочнике, следует, что вода имеет высокую теплоемкость, т.к. температура кипения воды одна из самых высоких среди жидкостей. Например, температура кипения этилового спирта 78. °С, эфира 34,5 °С. Мы думаем, что высокая температура кипения воды объясняется способностью ее молекул образовывать друг с другом водородные связи. Для того, чтобы заставить молекулы воды двигаться со скоростью, достаточной для разрыва водородных связей, требуется затратить много тепловой энергии. Чтобы нагреть грамм воды на один градус, необходима одна калория, или 4,19 Дж. Это больше чем вдвое превышает теплоемкость любого химического соединения.
Вывод:
Среди существующих в природе жидкостей вода обладает наибольшей теплоемкостью, а так же имеет высокую теплоту парообразования.
Задание 4-й группе
Налейте в стакан воду до самого верха, а затем аккуратно бросайте монетки в стакан пока не образуется «горка» из воды. Почему это стало возможно? Объясните результаты опыта. С каким свойством воды вы познакомились? Предположите, какую роль в живых системах может выполнять вода благодаря этому свойству?
По окончании исследования афишируйте свои выводы в любой интересной для вас форме (текст, рисунок, стих, представление).
Отчет 4-й группы
Нам удалось налить воду в стакан «с верхом». Поверхность воды как бы покрыта «пленкой», так как молекулы воды, находящиеся на поверхности, удерживаются за счет водородных связей, возникающих между ними и молекулами, находящимися внутри. Среди существующих в природе жидкостей вода обладает высоким поверхностным натяжением. (Поверхностное натяжение воды уступает только ртути)
Вывод: Вода обладает большим поверхностным натяжением.
Приложение 2
Физические свойства воды
| Значение свойства | |
| Температура кипения воды | 1000С |
| Температура плавления льда | 0 °С |
| Плотность (t = 4 °C) | 1,000 г/см3 |
| Плотность льда (t = 0 °С) | 0,917 г/см3 |
| Теплопроводность | Плохая |
| Электропроводность | Плохая, если нет примесей |
| Теплоемкость | Высокая = 4200 Дж/кг*0 С, в 3100 раз превышает теплоемкость воздуха |
| Поверхностное натяжение | Большое поверхностное натяжение |
| Способность растворять вещества | Растворяет многие простые и сложные вещества |
| Летучесть | Легко испаряется; возможно содержание водяного пара в воздухе до 30 г/м3 (абсолютная влажность в тропиках) |
| Цвет | Без цвета (чистая вода) |
| Запах | Без запаха (чистая вода) |
Приложение 3
Рис.1
Приложение 4
Лабораторные опыты: «Химические свойства воды».
Задание 1-й группе
Взаимодействие воды с металлами.
Оборудование и реактивы: пробирки в штативе, вода, фенолфталеин, спиртовка, металлы (кальций, железо, медь)
Задание: Прилейте воду в 3 пробирки с металлами. Какой металл реагирует при обычных условиях? Подогрейте оставшиеся металлы. Какой металл не будет реагировать даже при нагревании. Определите индикатором продукт реакции. Почему нет изменений в другой пробирке? Напишите уравнения реакций.
Задание 2-й группе
Взаимодействие воды с оксидами металлов.
Оборудование и реактивы: пробирки в штативе, вода, фенолфталеин, оксиды металлов (оксид кальция, оксид магния)
Задание: Прилейте воду к оксидам. В какой пробирке идет реакция? Определите индикатором продукт реакции. Почему нет изменений в другой пробирке? Напишите уравнения проделанных реакций.
Задание 3-й группе
Взаимодействие воды с оксидами неметаллов.
Оборудование и реактивы: пробирки в штативе, вода, метилоранж, оксиды неметаллов (оксид фосфора (V), оксид кремния)
Задание: Прилейте воду к оксидам. В какой пробирке идет реакция? Определите индикатором продукт реакции. Почему нет изменений в другой пробирке? Напишите уравнения проделанных реакций.
Задание 4-й группе (теоретическое)
Взаимодействие воды с неметаллами.
Задание: С какими неметаллами может реагировать вода?
Напишите уравнения возможных реакций.
Приложение 5
Задание:
Допишите предложения, вставив нужные слова вместо точек:
-
Вода при нагревании………………………………………………….
-
Вода при охлаждении…………………………………………………
-
Вода кипит при температуре…………………………………………..
-
Процесс превращения жидкой воды в газообразную – это…………
-
Процесс превращение пара в воду – это…………………………….
6. Какой сосуд для длительного хранения воды нужно взять: с широким или узким горлом (подчеркнуть)
_____________________________________________________________
Задание:
Допишите предложения, вставив нужные слова вместо точек:
-
Вода при нагревании………………………………………………….
-
Вода при охлаждении…………………………………………………
-
Вода кипит при температуре…………………………………………..
-
Процесс превращения жидкой воды в газообразную – это…………
-
Процесс превращение пара в воду – это…………………………….
6. Какой сосуд для длительного хранения воды нужно взять: с широким или узким горлом (подчеркнуть)
_____________________________________________________________
Задание:
Допишите предложения, вставив нужные слова вместо точек:
-
Вода при нагревании………………………………………………….
-
Вода при охлаждении
-
Вода кипит при температуре…………………………………………..
-
Процесс превращения жидкой воды в газообразную – это…………
-
Процесс превращение пара в воду – это………………………
6. Какой сосуд для длительного хранения воды нужно взять: с широким или узким горлом (подчеркнуть)
________________________________________________________
Задание:
Допишите предложения, вставив нужные слова вместо точек:
1. Вода при нагревании………………………………………………….
-
Вода при охлаждении…………………………………………………
-
Вода кипит при температуре…………………………………………..
-
Процесс превращения жидкой воды в газообразную – это…………
-
Процесс превращение пара в воду – это…………………………….
6. Какой сосуд для длительного хранения воды нужно взять: с широким или узким горлом (подчеркнуть)
Приложение 6
Удивительное вещество – вода.
(сообщение ученика)
Вода обладает многими удивительными свойствами, резко отличающими ее от всех других жидкостей. И если бы вода вела себя «как положено», то Земля стала бы просто неузнаваемой.
Все тела при нагревании расширяются, при охлаждении сжимаются. Все, кроме воды. В интервале температур от 0 до +4 °С вода при охлаждении расширяется, а при нагревании сжимается. При +4 °С вода имеет наибольшую плотность, равную 1000 кг/м3. При более низкой и более высокой температуре плотность воды несколько меньше. Благодаря этому осенью и зимой в глубоких водоемах конвекция происходит своеобразно. Вода, охлаждаясь сверху, опускается вниз, на дно, только до тех пор, пока ее температура не достигнет +4 °С. Тогда в стоячем водоеме устанавливается распределение температуры, изображенное на рисунке. Благодаря этому под слоем льда, покрывающим водоем сверху, живут в воде рыбы и другие обитатели водоемов.
Чтобы нагреть 1 г воды на 1 °С, ей необходимо отдать в 5, 10, 30 раз большее количество теплоты, чем для нагревания 1 г любого другого вещества, т. е. вода имеет очень большую удельную теплоемкость. Вследствие этого вода является хорошим теплоносителем. Вспомните, например, водяное отопление у вас дома или «отопление» Европы теплым течением Гольфстрим. Медленное повышение температуры воды при нагревании и соответственно выделение значительных количеств теплоты при охлаждении смягчают колебания температуры вблизи больших водоемов.
Здесь представлен конспект к уроку на тему «Вода», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (8 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.