Презентация "Алюминий" (11 класс) по химии – проект, доклад
Презентацию на тему "Алюминий" (11 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 22 слайд(ов).
Слайды презентации
Список похожих презентаций
Алюминий как химический элемент и как простое вещество
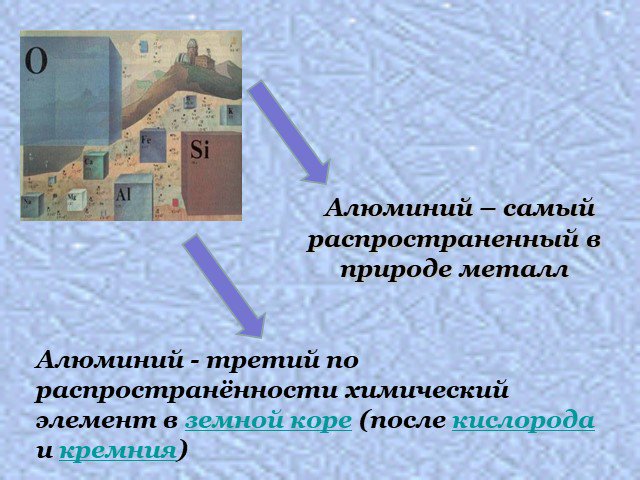
AL. Элемент III(A) группы таблицы Д.И.Менделеева. Элемент с порядковым № 13. Элемент 3 -его периода. Третий по распространенности в земной коре. Впервые ...Алюминий, его Свойства и применение
Al 13. Алюминий (лат. Aluminium). 3 8 2 26,9815 3s2 3p1. Был впервые получен датским физиком Х.К. Эрстедом в 1825 г. Название этого элемента происходит ...Алюминий и его соединения
Учителя химии: Гершановская Евгения Владимировна ГБОУ СОШ № 880 Город Москва Попова Светлана Анатольевна ГБОУ СОШ № 1465 Город Москва. СОДЕРЖАНИЕ. ...Алюминий и его характеристика
Цель урока. Рассмотрение характеристики алюминия по трем формам существования химических элементов: атомов, простых и сложных веществ. Задачи урока. ...Алюминий и его соединения
Положение в Периодической системе. Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная ...Алюминий и его соединения
Стартовое задание. Выполнение задания А оценивается одним баллом. Выполнение задания В оценивается 2 баллами. Выполнение задания С оценивается 3 баллами. ...Алюминий .Строение.Свойства
Строение атома:. Из истории открытия:. Алюминий был впервые получен датским Физиком Х.Эрнстедом.(1825)название элемента происходит от латинского алюмен. ...Алюминий
Структура презентации. Положение в таблице Получение Физические свойства Химические свойства Нахождение в природе Производство Применение. Положение ...Алюминий
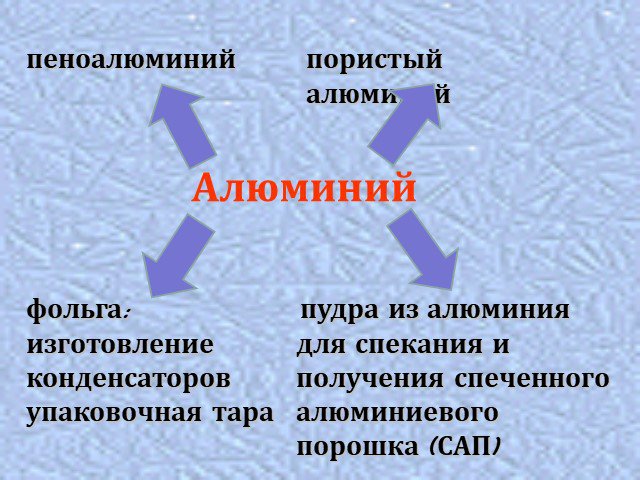
химические свойства алюминия. получение алюминия. Применение алюминия. ...Алюминий – металл ХХ века. Физические и химические свойства
Алюминий. Алюминий вы найдете В ложке, кружке, самолете. Нужен легонький металл, Чтобы самолет летал! Самолет парит легко, Небосвод пронзает синий, ...Алюминий
Алюминий — элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Обозначается символом Al(лат. Aluminium). Относится к группе ...Алюминий
Повторение темы «Элементы I и II группы А» Практикум (15 минут). 1 вариант: 1.Напишите строение электронной оболочки атома натрия. 2. Подтвердите ...Алюминий
Открытие алюминия. Впервые был получен датским физиком Эрстедем в 1925 году. Название было дано от латинского «alume»,так в древности назывались квасцы ...Алюминий!
Великие законы мирозданья в сущности, наивны и просты. И порой Вам не хватает знанья для разгадки этой простоты. Прослушав легенду, попробуйте отгадать ...Алюминий и его свойства
Алюминий и его свойства. ППС. Химическая активность. Взаимодействие с простыми веществами. Взаимодействие с сложными веществами. получение лабораторное ...Химия Алюминий
Я алюминий. Видели меня, Металл я лёгкий и блестящий, Хороший проводник я электричества, А также и тепла. Химический мой знак Al А атомный мой вес ...Алюминий
алюминий- мягкий лёгкий металл серебристо-белого цвета. По некоторым исследованиям поступление алюминия в организм человека было сочтено фактором ...Конспекты
Алюминий, его физические и химические свойства. Применение алюминия
. . Тема урока «Алюминий, его физические и химические свойства. Применение алюминия». Цель урока. . *продолжить формирование ключевых компетенций: ...Алюминий, его физические и химические свойства
. МБОУ «СОШ №3». г. Александровск, пгт. Яйва,. . Алюминий, его физические и химические свойства. . . Литвиненко ...Алюминий, его физические и химические свойства
План – конспект урока. Тема урока:. Алюминий, его физические и химические свойства. Тип урока:. изучение нового материала. Цель:. обучающиеся ...Алюминий и его соединения
Урок по теме "Алюминий и его соединения". Цели урока:. Общеобразовательные:. через систему познавательных задач расширить и углубить знания ...Алюминий и его соединения
КГУ "Общеобразовательная школа-лицей при ПГК им. М. Жумабаева". Урок химии. Тема:. Алюминий и его соединения. 9 ...Алюминий и его соединения
А.К. 11 класс. 1 вариант. 1. По формуле 1S. 2. 2S. 2. 2P. 6. 3S. 2. 3P. 6. 4S. 2. 3d. 10. 4P. 2. укажите местоположение элемента в периодической ...Алюминий и его соединения
Технологическая карта урока по химии. подготовила учитель химии МБОУ СОШ № 1 г.Тимашевск. . ИСПАЛОВА НАТАЛЬЯ СЕРГЕЕВНА. Тема урока. . Алюминий ...Алюминий
. МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ. . «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №7. . ГОРОДА НИЖНЕКАМСКА РЕСПУБЛИКИ ТАТАРСТАН. . . ...Алюминий – металл будущего
План-конспект урока химии 9класс. Алюминий – металл будущего. Цели урока:. . . - изучить свойства металлов 3 А группы на примере алюминия,. ...Алюминий
Вывод: . У его соединений. И металла – молодца,. Как давно уже открыто,. В самом деле – два лица. Гидроксид и кислота. Растворяет без труда. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:ученики: Садыков Данила и Розанов Игорь
Классы:
Содержит:22 слайд(ов)
Поделись с друзьями:
Скачать презентацию




























![Алюминий растворяется в соляной и серной кислотах, а также в водных растворах щелочей. 2Al + 6HCl = 2AlCl3 + 3H2 2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2. 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 Алюминий растворяется в соляной и серной кислотах, а также в водных растворах щелочей. 2Al + 6HCl = 2AlCl3 + 3H2 2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2. 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2](https://prezentacii.org/upload/cloud/14/09/4592/images/thumbs/screen8.jpg)