Презентация "ХИМИЧЕСКИЙ ХАМЕЛИОН" по химии – проект, доклад
Презентацию на тему "ХИМИЧЕСКИЙ ХАМЕЛИОН" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 23 слайд(ов).
Слайды презентации
Список похожих презентаций
ХИМИЧЕСКИЙ ТРЕНАЖЁР
ХИМИЧЕСКИЙ ТРЕНАЖЁР. Условие задачи: Вычислить массу осадка, если в реакцию вступили 120 граммов сульфата натрия и 300 граммов хлорида бария. Для ...ХИМИЧЕСКИЙ
1.Определите признак, по которому все нижеперечисленные соединения, кроме одного, объединены в одну группу. Укажите «лишнее» химическое соединение. ...Органическая химия
история развития органической химии предмет органической химии особенности органических веществ Бутлеров теория строения органических соединений Бутлерова ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Незнайка в стране химия
Я – известный химик Незнайка. Я знаю все и все могу. Сейчас я взмахну волшебной палочкой и начнется извержение вулкана. Смотри! А теперь все за мной ...Сложные эфиры химия
Цели урока:. 1.Изучить строение сложных эфиров. 2.Познакомиться с механизмом реакции этерификации. Номенклатура. Названия сложных эфиров происходит ...Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Аналитическая химия
Определение. Аналити́ческая хи́мия — раздел химии, изучающий химический состав и структуру веществ; имеет целью определение элементов или групп элементов, ...Аналитическая химия
План доклада. Аналитическая химия (определение) Гармонизация терминологии по аналитической химии Роль терминологии Источники терминологии Цели и задачи ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...алюминий химия
получение алюминия. Применение алюминия. ...«Электролитическая диссоциация» химия
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...«Окислительно-восстановительные реакции» химия
СОДЕРЖАНИЕ:. 1. Какие реакции называются окислительно-восстановительными? 2. Что называют окислителем, восстановителем? 3. Окислительно-восстановительный ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Аналитическая химия
Цель программы:. Фундаментальная подготовка магистрантов в области аналитической химии со знанием современных физико-химических методов анализа (хроматографических, ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Белки химия
Содержание. Определение Функции белков Источники аминокислот Строение полипептидной цепи Структура белка Химические свойства Превращения белков в ...Конспекты
СЕРА – ХИМИЧЕСКИЙ ЭЛЕМЕНТ И ПРОСТОЕ ВЕЩЕСТВО
Конкурс конспектов уроков учителей естественных предметов и географии «Урок. XXI. века». «СЕРА – ХИМИЧЕСКИЙ ЭЛЕМЕНТ И ПРОСТОЕ ВЕЩЕСТВО». ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:16 марта 2019
Категория:Химия
Содержит:23 слайд(ов)
Поделись с друзьями:
Скачать презентацию






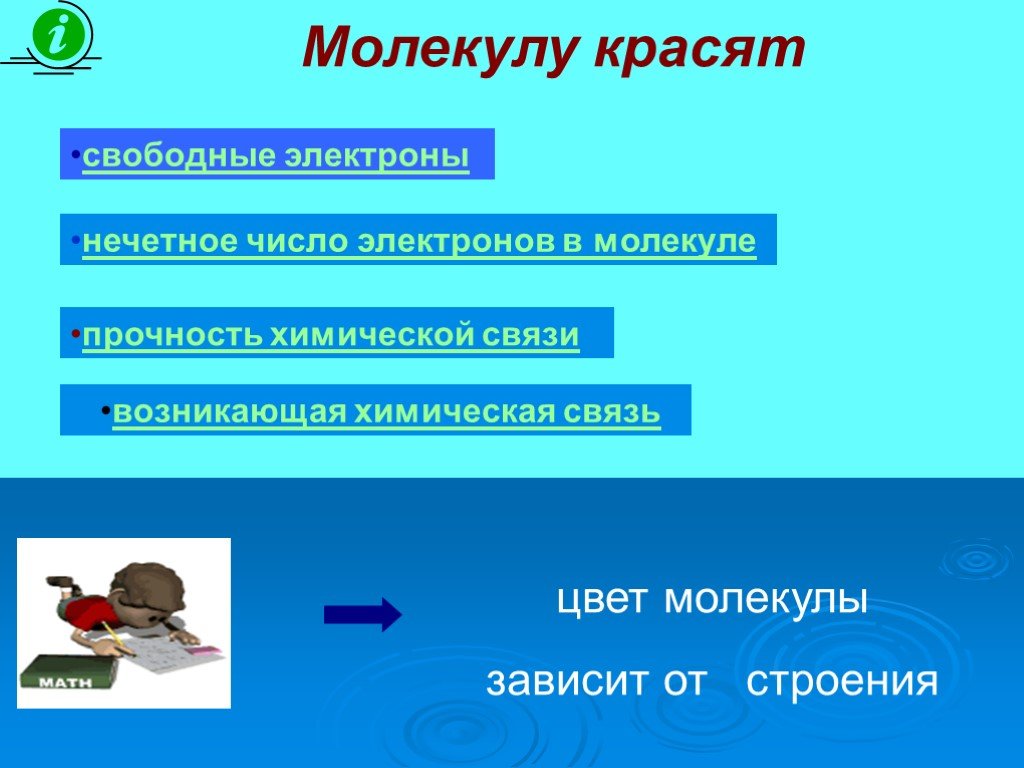




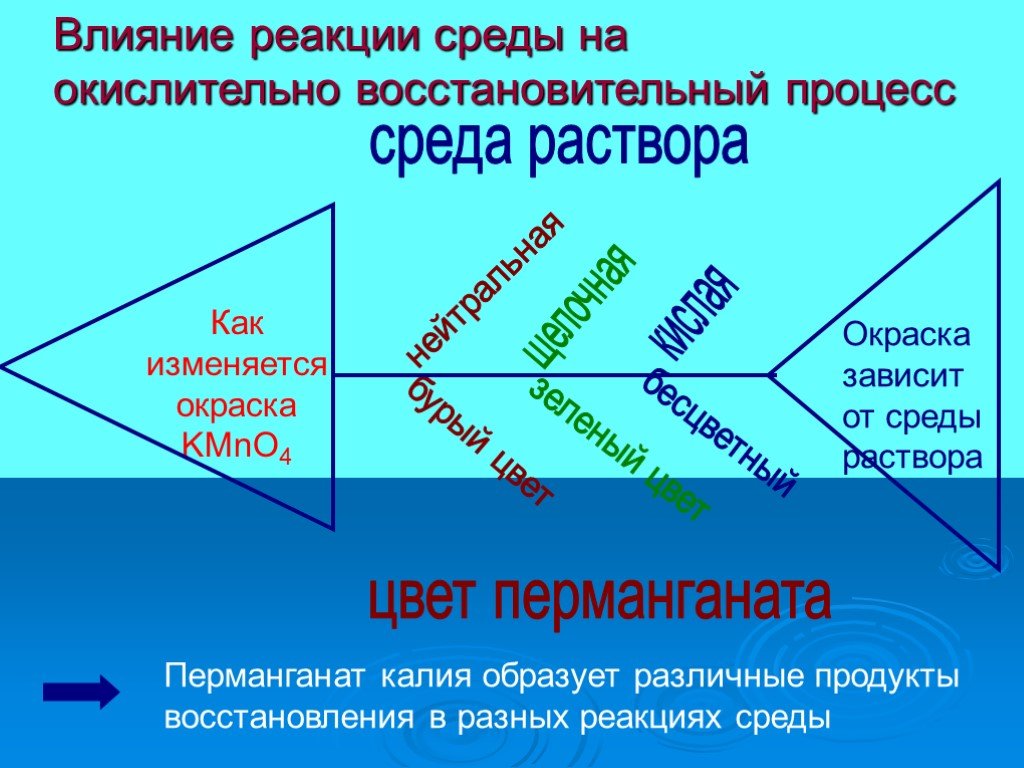

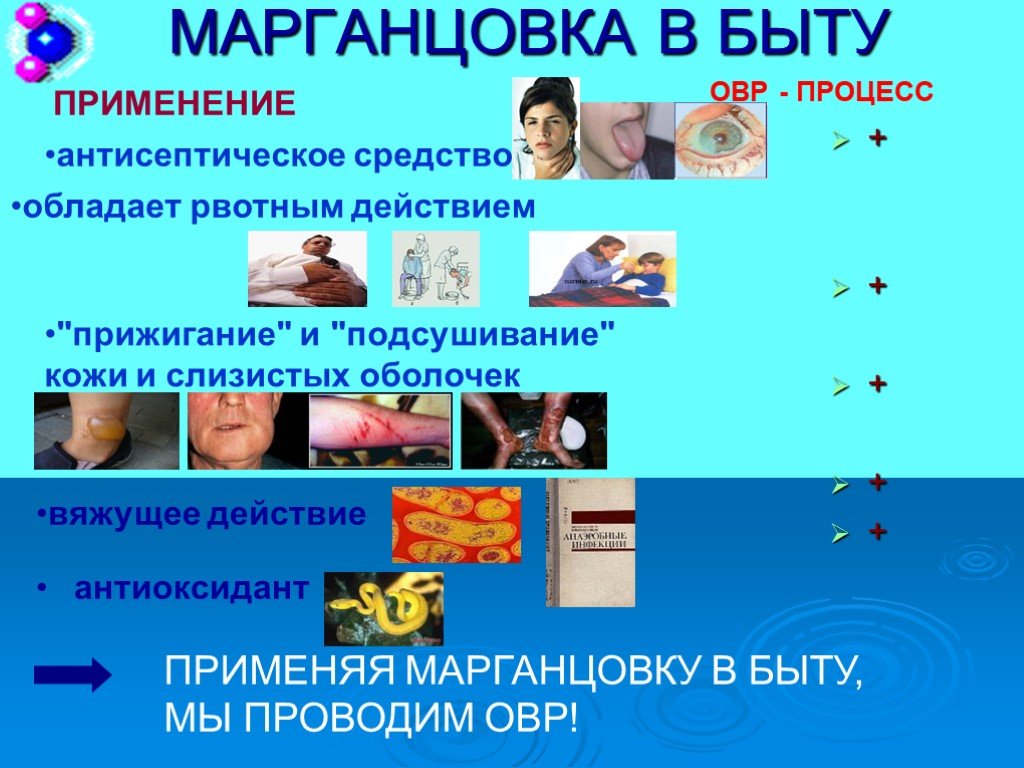




























![соединение, составленное из почти бесцветных слагающих частей, оказывается окрашенным. Так, ион Fe3+ бесцветен, ион Fe(CN)64 -, входящий в состав желтой кровяной соли, слабо окрашен в желтый цвет. А вот Fe4[Fe(CN)6]3, получающийся при сливании растворов, содержащих указанные ионы, имеет интенсивную соединение, составленное из почти бесцветных слагающих частей, оказывается окрашенным. Так, ион Fe3+ бесцветен, ион Fe(CN)64 -, входящий в состав желтой кровяной соли, слабо окрашен в желтый цвет. А вот Fe4[Fe(CN)6]3, получающийся при сливании растворов, содержащих указанные ионы, имеет интенсивную](https://prezentacii.org/upload/cloud/19/03/134799/images/thumbs/screen20.jpg)