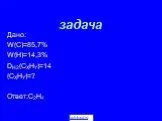
Презентация "ХИМИЧЕСКИЙ ТРЕНАЖЁР" () по химии – проект, доклад
Презентацию на тему "ХИМИЧЕСКИЙ ТРЕНАЖЁР" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 13 слайд(ов).
Слайды презентации
Список похожих презентаций
ХИМИЧЕСКИЙ ХАМЕЛИОН
вещества «Хамелеоны» существуют. ГИПОТЕЗА ПРОЕКТА. Ознакомиться с информационной литературой, провести анализ, сделать выводы Провести практические ...ХИМИЧЕСКИЙ
1.Определите признак, по которому все нижеперечисленные соединения, кроме одного, объединены в одну группу. Укажите «лишнее» химическое соединение. ...Конспекты
СЕРА – ХИМИЧЕСКИЙ ЭЛЕМЕНТ И ПРОСТОЕ ВЕЩЕСТВО
Конкурс конспектов уроков учителей естественных предметов и географии «Урок. XXI. века». «СЕРА – ХИМИЧЕСКИЙ ЭЛЕМЕНТ И ПРОСТОЕ ВЕЩЕСТВО». ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:2 апреля 2018
Категория:Химия
Содержит:13 слайд(ов)
Поделись с друзьями:
Скачать презентацию