Презентация "Подгруппа Селена" по химии – проект, доклад
Презентацию на тему "Подгруппа Селена" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 36 слайд(ов).
Слайды презентации
Список похожих презентаций
Подгруппа углерода
Химия. Подгруппа углерода. Положение элементов подгруппы углерода в периодической системе, строение их атомов. C, Si, Ge, Sn, Pb. Общая характеристика. ...Подгруппа углерода
Цель урока:. Выяснить насколько усвоен материал по теме, дополнить знания учащихся об оксидах углерода и кремния и других соединениях. Совершенствовать ...Подгруппа кислорода
Реактивы: сульфат натрия, сульфат меди (ll), лакмус, фенолфталеин, хлорид бария, гидроксид калия, серная кислота Оборудование: набор пробирок (ПХ-14, ...Подгруппа углерода
Загадка: Из меня состоит все живое: Я – графит, антрацит и алмаз, Я на улице, в школе и в поле, Я в деревьях и в каждом из вас. Работа с учебником ...Подгруппа азота. История открытия элементов
Четырежды открытый. Генри Кавендиш (1732 – 1810). Джозеф Пристли (1733 – 1804). Карл Шееле (1742-1786). Даниель Резерфорд (1749 – 1819). Британский ...Подгруппа азота (V - А группа)
N P As Sb Bi - азот - фосфор. - мышьяк ( арсеникум). - сурьма (стибиум) - висмут. Чем похожи и чем различаются элементы главной подгруппы V группы? ...Подгруппа азота
Выбери игру.Управление презентацией. 1. Главный слайд - № 2 (по гиперссылке необходимо перейти на любую из игр).
На главный слайд (№ 2).
Завершить ...
Подгруппа углерода и азота
Цель урока:. Закрепить и обобщить знания об основных физических и химических свойствах углерода, азота и их соединений. Продолжить формировать умение ...Подгруппа азота
1.С ростом порядкового номера элемента кислотные свойства оксидов в ряду…. N2O - P2O3 - As2O3 - Sb2O3 -Bi2O3. а) усиливаются б) ослабевают в) остаются ...Задачи Подгруппа кислорода
Практическая работа№2 Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: опытным путем определить растворы следующих веществ: H2SO4 ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Сложные эфиры химия
Цели урока:. 1.Изучить строение сложных эфиров. 2.Познакомиться с механизмом реакции этерификации. Номенклатура. Названия сложных эфиров происходит ...Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...Коллоидная химия
Признаки объектов коллоидной химии. Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц (l). Дисперсность ...Кто ты и откуда химия?
Откуда пошло слов химия? Хи́мия (от араб. کيمياء, предположительно от египетского «chemi» — чёрный, откуда также греческое название Египта, чернозёма ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...Конспекты
Подгруппа кислорода
Дата_____________ Класс_______________. Тема:. . Практическая работа №2 Решение экспериментальных задач по теме «Подгруппа кислорода». Цели урока:. ...Подгруппа углерода. Углерод как простое вещество
Тема: «Подгруппа углерода. Углерод как простое вещество». Цель урока. :. Дать общую характеристику элементам. VI. А группы, показать аллотропные ...Подгруппа кислорода
Конспект урока. Краснова Оксана Владимировна. Предмет. Химия. Класс. 9. . Тема урока. . «Подгруппа кислорода». Цель. : Дать общую характеристику ...Подгруппа кислорода
Урока по химии 9 класс по теме:. «Подгруппа кислорода». Составлен учителем химии. МОУ «СОШ №5 г.Кировска». Зудковой Верой Сергеевной. Цель ...Подгруппа галогенов
Конспект урока. Аттестуемый педагог Краснова Оксана Владимировна. Предмет Химия. Класс 9. . Тема урока. «Подгруппа галогенов». Цель. : ...Подгруппа азота
АЗОТ. Тема. : подгруппа азота. Тема урок. : азот. Цели. . . . 1. . Образовательная. . Выявление и оценка степени овладения учащимися системой ...Подгруппа азота
Урок-семинар в 9 классе. по теме: «Подгруппа азота». Девиз урока: « Мало знать, надо и применять. Мало хотеть, надо и делать» (Гёте). Цели ...Подгруппа Азота
Итоговый урок по теме: « Подгруппа Азота» . ( урок для учащихся 9 классов по неорганической химии, изучаемый в разделе «Подгруппа азота» на который ...Подгруппа азота
Конспект урока по химии в 9 классе. Гребенюк Татьяна Николаевна,. . . учитель химии высшей категории. МОУ СОШ №5 «Образовательный центр». ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:21 февраля 2019
Категория:Химия
Содержит:36 слайд(ов)
Поделись с друзьями:
Скачать презентацию



































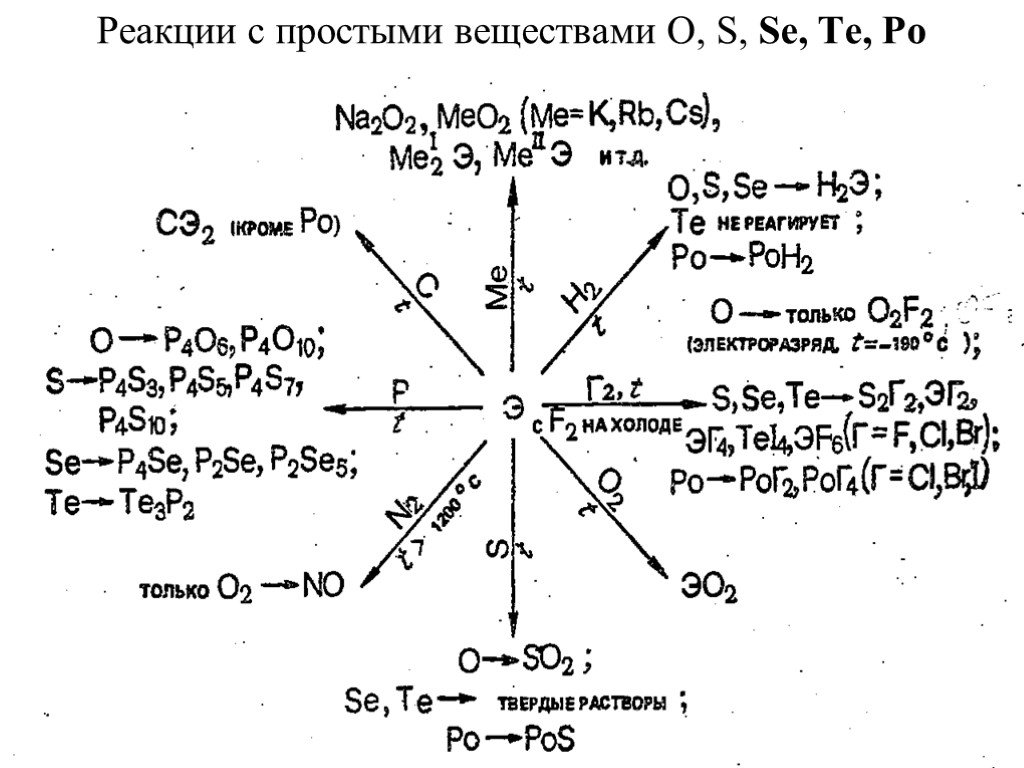


















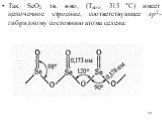
![Соединения селена (IV), теллура (IV) и полония (IV). Степень окисления +4 селена, теллура и полония проявляется в диоксидах ЭО2, тетрагалогенидах ЭНаl4, оксодигалогенидах ЭОНаl2, а также соответствующих анионных комплексах, например, типа [ЭО3]2-, [ЭНаl6]2-. Для полония (IV), кроме того, характерны Соединения селена (IV), теллура (IV) и полония (IV). Степень окисления +4 селена, теллура и полония проявляется в диоксидах ЭО2, тетрагалогенидах ЭНаl4, оксодигалогенидах ЭОНаl2, а также соответствующих анионных комплексах, например, типа [ЭО3]2-, [ЭНаl6]2-. Для полония (IV), кроме того, характерны](https://prezentacii.org/upload/cloud/19/02/127770/images/thumbs/screen19.jpg)
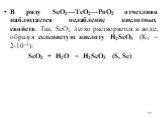
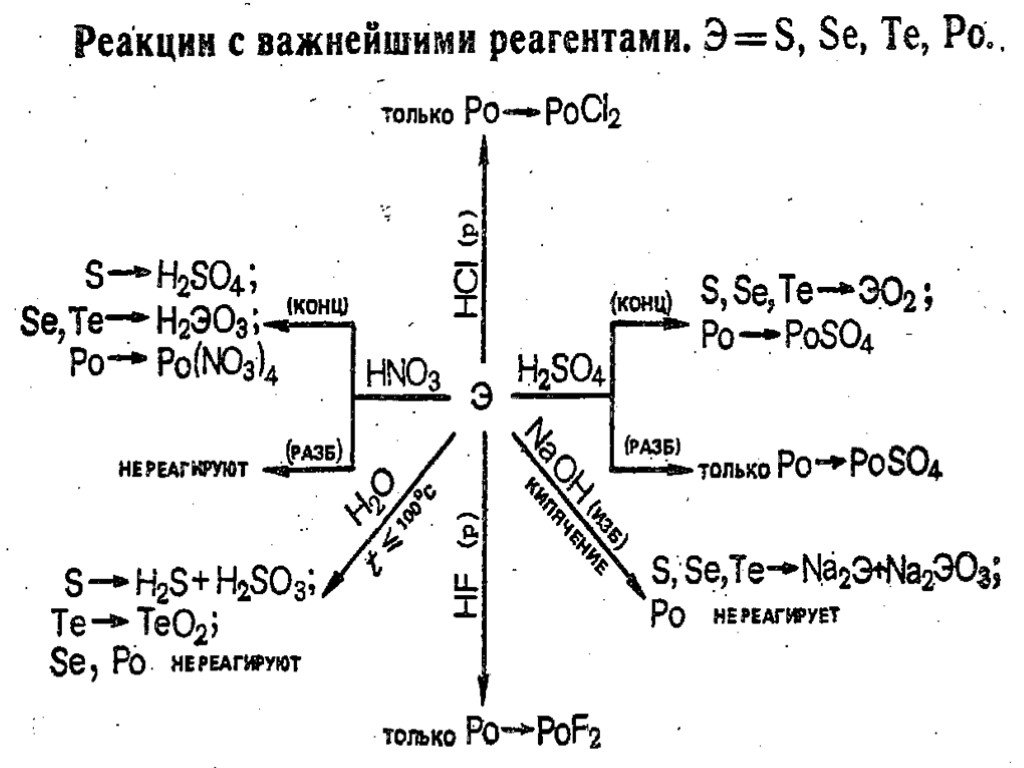
![ТеО2 в воде не растворяется, но взаимодействует с растворами щелочей: ТеО2 + 2КОН + 2Н2О = К2[Те(ОH)6] РоО2 с щелочами реагирует только при сплавлении ЭО2 + КОН = К2ЭО3 + Н2О (Э = Se, Te, Po) Производные ЭО32- — называются селенитами, теллуритами и полонитами. Po с кислотами взаимодействует как осно ТеО2 в воде не растворяется, но взаимодействует с растворами щелочей: ТеО2 + 2КОН + 2Н2О = К2[Те(ОH)6] РоО2 с щелочами реагирует только при сплавлении ЭО2 + КОН = К2ЭО3 + Н2О (Э = Se, Te, Po) Производные ЭО32- — называются селенитами, теллуритами и полонитами. Po с кислотами взаимодействует как осно](https://prezentacii.org/upload/cloud/19/02/127770/images/thumbs/screen22.jpg)




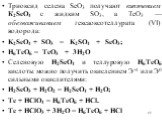

![Гексаоксотеллурат (VI) водорода H6TeO6 белое кристаллическое вещество, хорошо растворимое в горячей воде. Теллуровая кислота очень слабая (К1 = 210-8, К2 = 510-11). При нейтрализации Н6ТеО6 щелочью образуются гидротеллураты например: М+1[ТеО(ОН)5] - (М+1Н5ТеO6), М2+1[ТеО2(ОН)4] - (М2+1H4ТеО6). Пол Гексаоксотеллурат (VI) водорода H6TeO6 белое кристаллическое вещество, хорошо растворимое в горячей воде. Теллуровая кислота очень слабая (К1 = 210-8, К2 = 510-11). При нейтрализации Н6ТеО6 щелочью образуются гидротеллураты например: М+1[ТеО(ОН)5] - (М+1Н5ТеO6), М2+1[ТеО2(ОН)4] - (М2+1H4ТеО6). Пол](https://prezentacii.org/upload/cloud/19/02/127770/images/thumbs/screen29.jpg)