Презентация "Все о предельных одноатомных спиртах" по химии – проект, доклад
Презентацию на тему "Все о предельных одноатомных спиртах" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 23 слайд(ов).
Слайды презентации
Список похожих презентаций
Все о спиртах
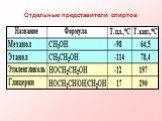
Реши задачу! Определите молекулярную формулу соединения содержащего углерода- 52,2% водорода -13% кислорода-34,8%. Проверьте себя С2Н6О. Задание: ...Все о многоатомных спиртах
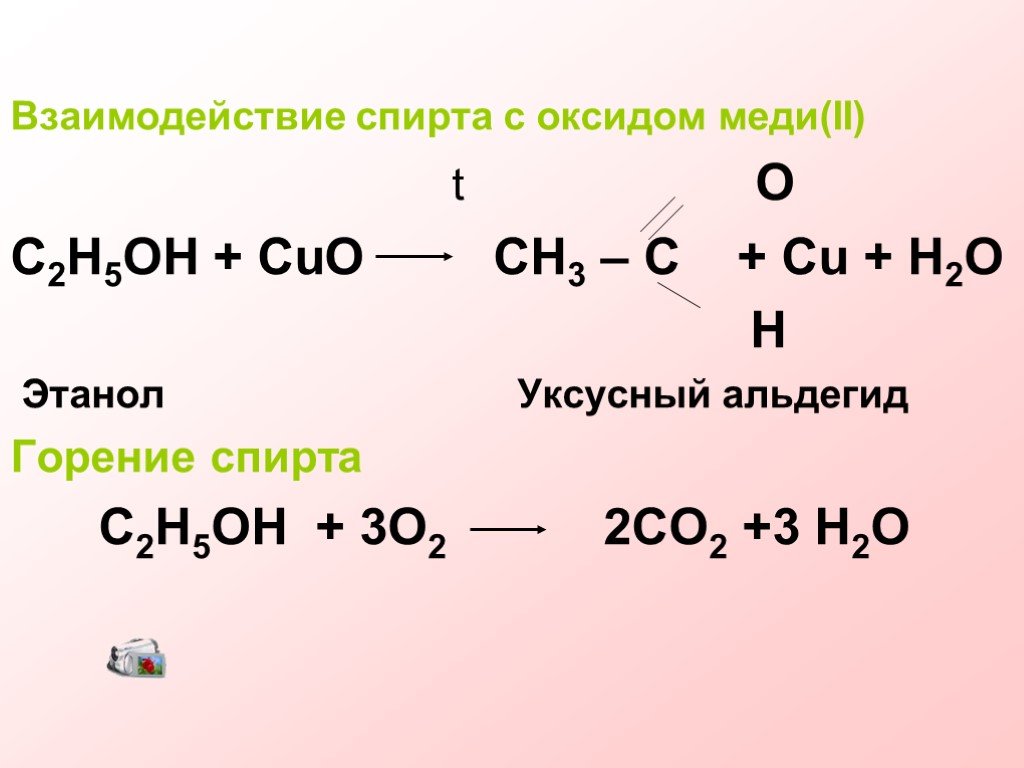
Цели урока:. Закрепить полученные знания об одноатомных спиртах. Познать новое (многоатомные спирты) в сравнении с одноатомными, найти в общем частное, ...Химические свойства и получение насыщенных одноатомных спиртов
Проверка домашнего задания Упражнение 5б. 1 2 3 Н3С – СН – СН3 1) | ОН 4 3 2 1 Н3С – СН2 – СН – СН2ОН 2) | СН3 ОН 1 2 3| 3) Н3С – СН2 – СН 4| 5 СН2 ...Строение и свойства предельных и непредельных углеводородов
Разминка. I I Вариант. 1.Углеводороды, содержащие. только простые связи. 2.Вещесва, сходные по строению, но отличающие на одну или несколько групп ...Ряд предельных углеводородов
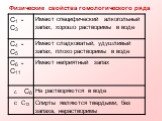
Цель урока:. рассмотреть гомологический ряд предельных УВ, строение молекул алканов. ознакомить учащихся с изомерией предельных УВ. физическими свойствами ...проект: Все для фронта, все для Победы
«Наука есть источник высшего блага человечества в период труда. Но она и самое грозное оружие защиты и нападения во время войны» Н.Д.Зелинский Справедливо ...Обобщение знание и умений и предельных и непредельных углеводородах
Цели урока:. повторить, обобщить и закрепить полученные знания и умения по темам «Предельные и непредельные углеводороды» изучить генетическую связь ...Все об алюминии
АЛЮМИНИЙ. нахождение в природе. Алюмосиликаты: Глина – Al2O3*nSiO2*mH2O Бокситы – Al2O3*nH2O. Строение атома. 27+13Al 2 8 3 1s22s22p1 *3 3 Al°-3ê ...Все о чае
История. Первоначально чай использовался в качестве лекарственного средства. Его употребление в качестве напитка широко распространилось во время ...Все о природном и попутном газе
Классификация газов. добывают из газовых месторождений. растворены в нефти и добываются вместе с ней. 23.02.2019. . Мировая добыча природного газа ...Все о пищевых добавках класса Е
С древних времён люди понимали важность питания для здоровья: «Ты есть то, что ты ешь», говорили они. Главные питательные вещества нашей пищu. Как ...Все о нуклеиновых кислотах
Проблемный вопрос. Подумайте и выскажите ваши предположения: А) Почему (в силу каких причин) именно молекулы ДНК, а не РНК выполняют функцию хранения ...Химические свойства предельных углеводородов
Алканы CnH2n+2. Химические свойства. 1. Реакции замещения: CH₄ + Cl₂ → CH₃Cl + HCl Реакции протекают по радикальному механизму. 3.Реакции дегидрирования: ...Все о железе и его соединения
Урок-проект в 9 классе подготовила Яскевич В.А. учитель химии МОУ «Кадетская школа «Патриот» г.Энгельса 2010 г. План изучения вещества. Железо как ...Многоликая химия
«Счастливый случай». игра. Гейм I. «Многоликая химия». Общие химические знания. 1. Как называют вещества, которые изменяют скорость химической реакции ...Одноатомные спирты
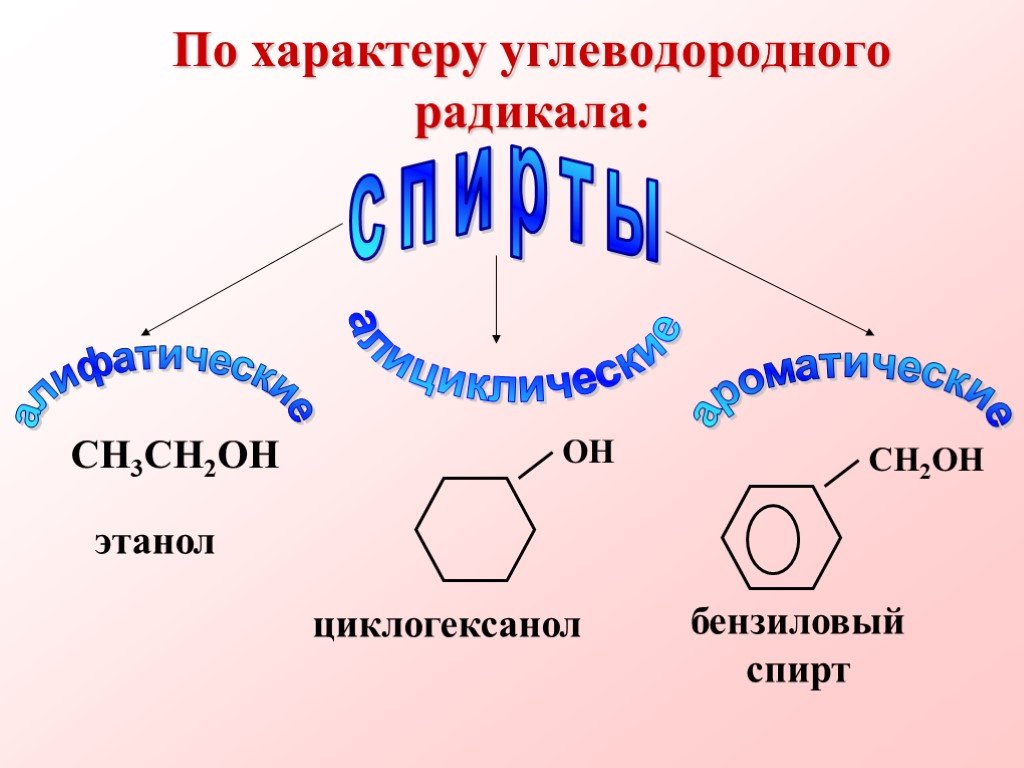
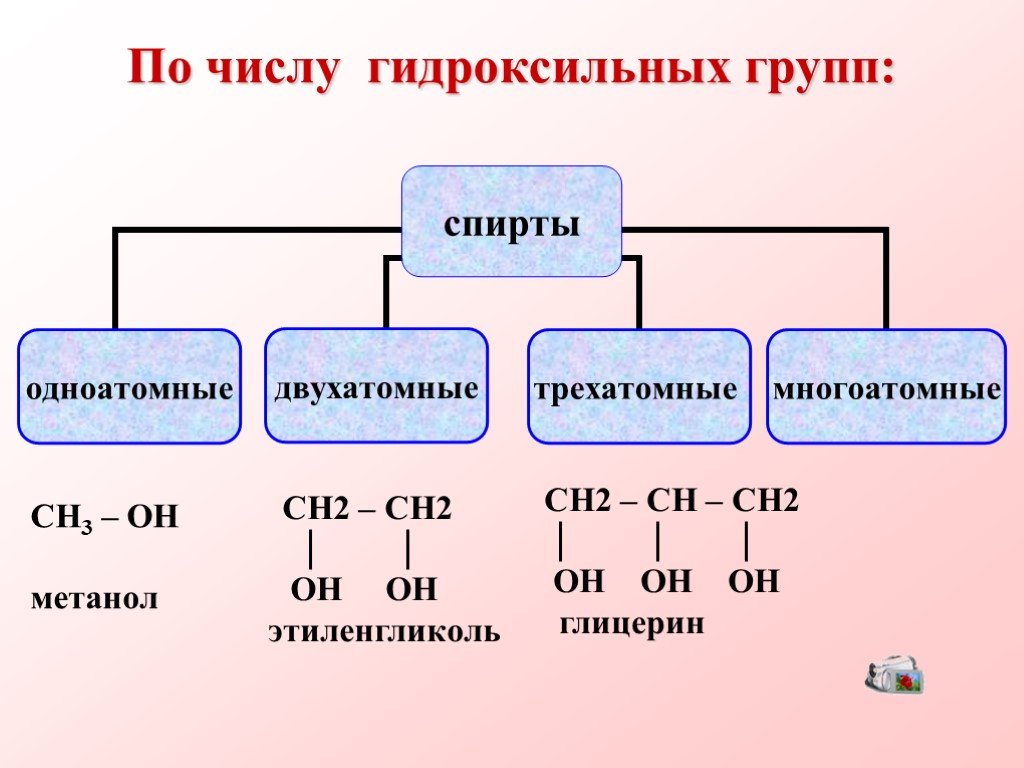
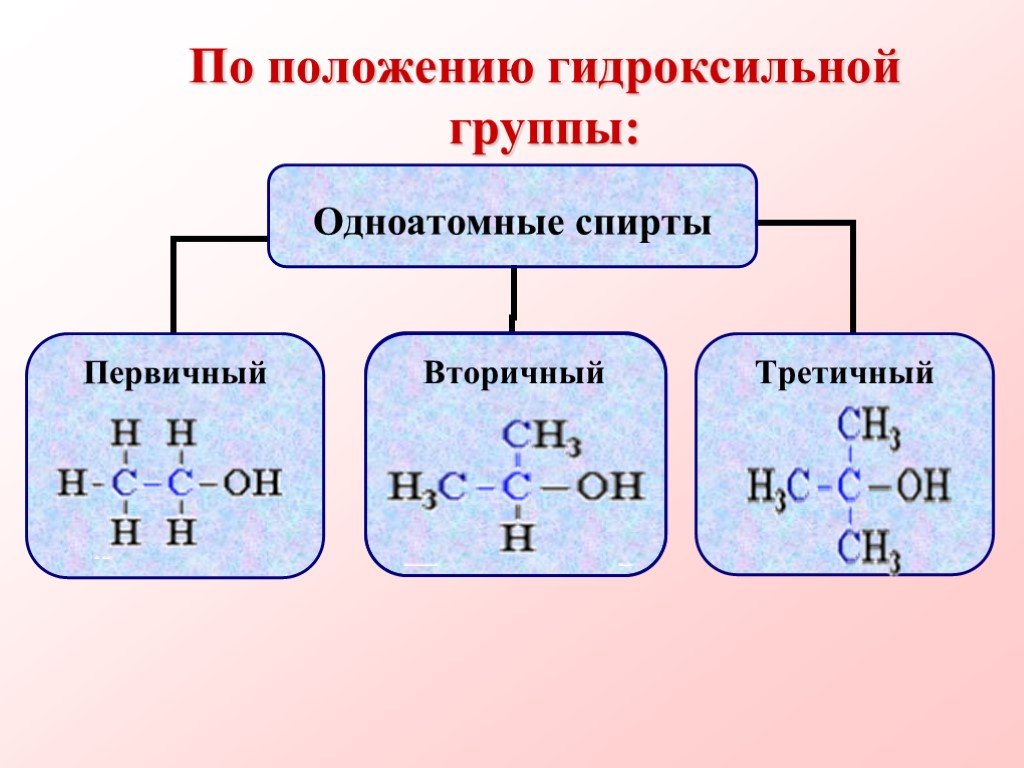
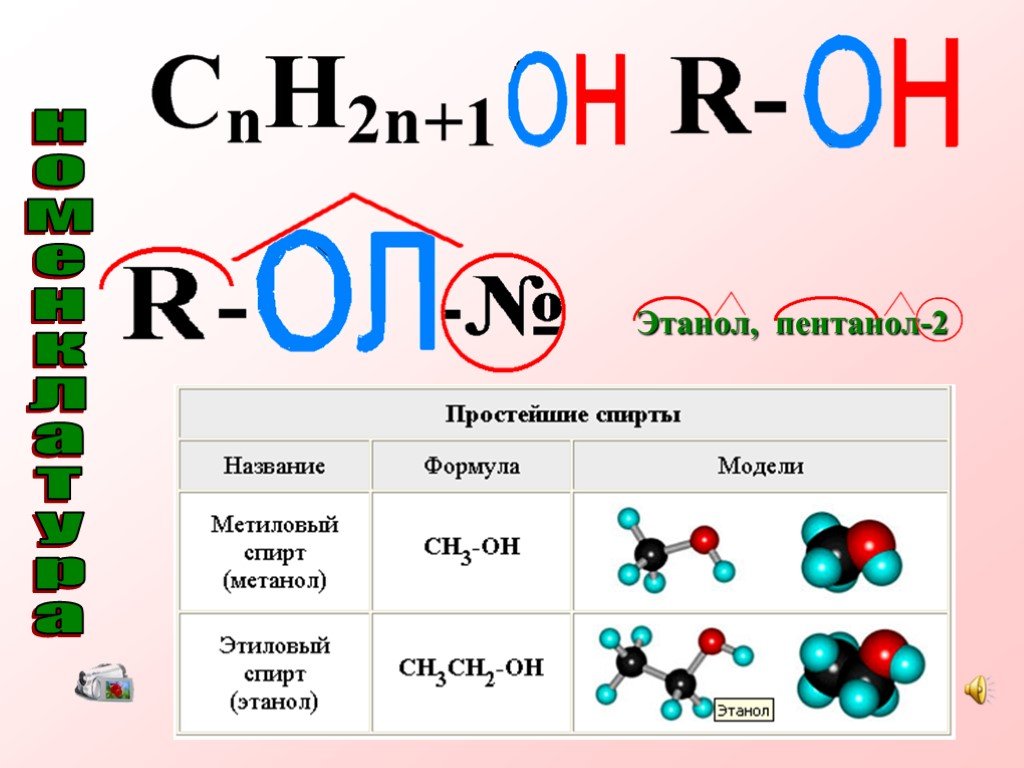
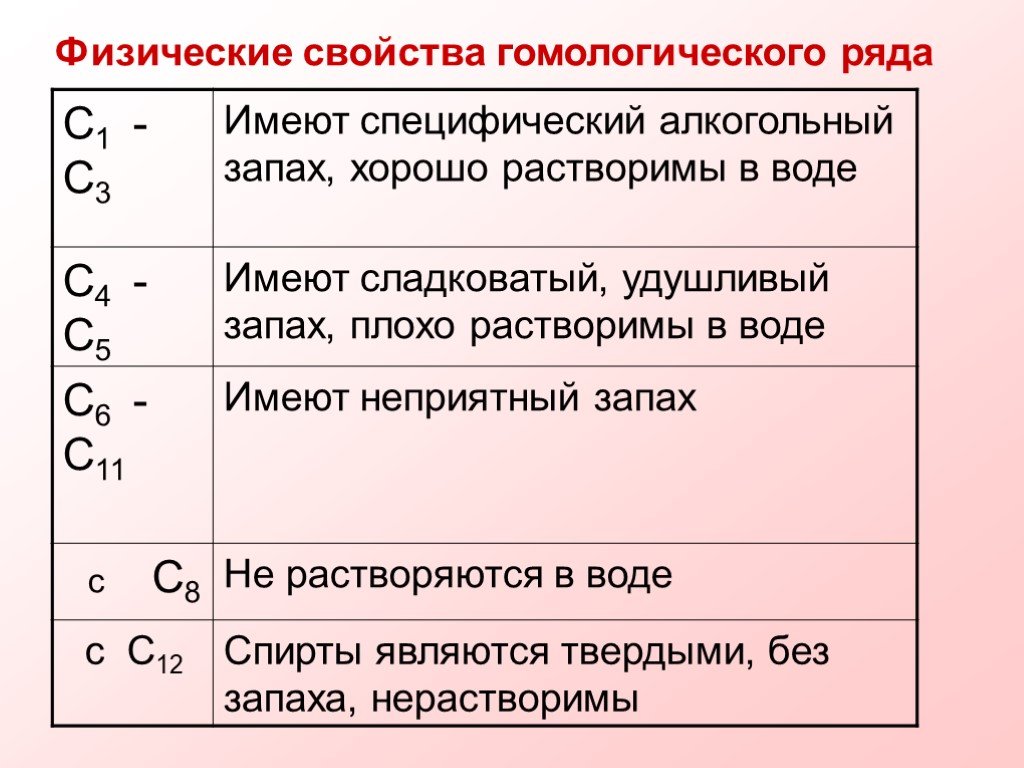
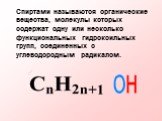
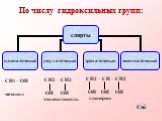
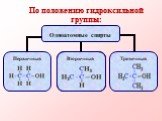
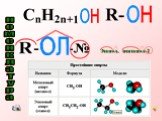
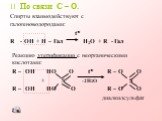
Спиртами называются соединения, содержащие одну или несколько гидроксильных групп. По их числу спирты подразделяются на одноатомные, двухатомные, ...Многоатомные спирты
Многоатомные спирты. Многоатомные спирты – это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных ...Многоатомные спирты
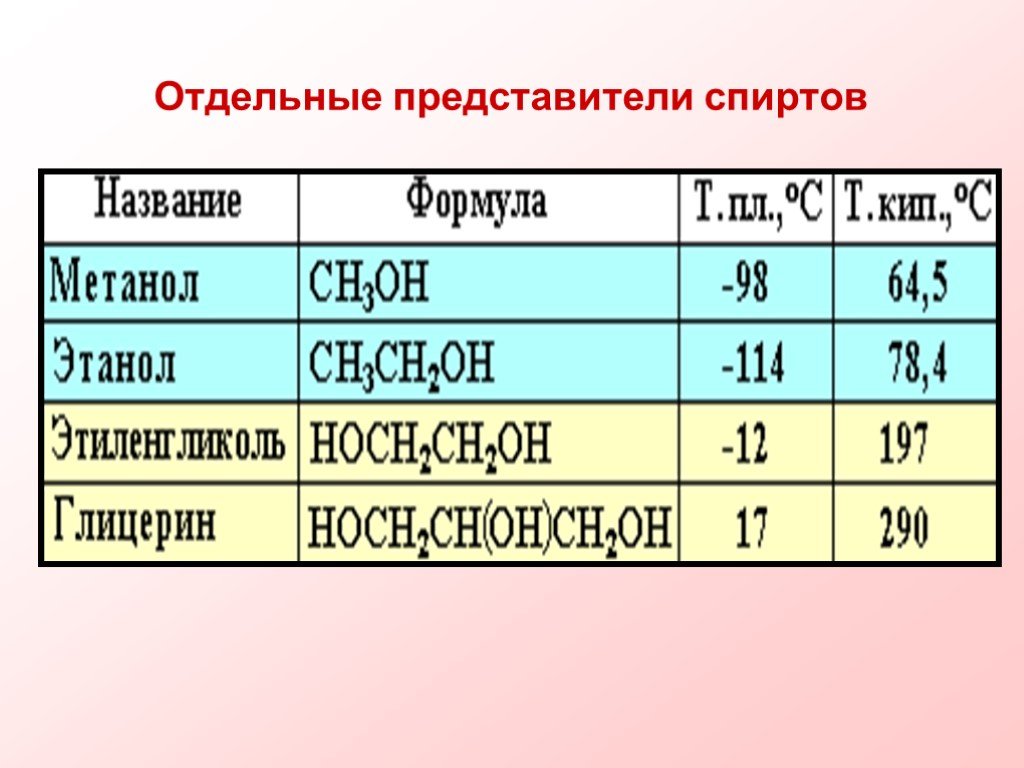
Термин. Представители многоатомных спиртов — этиленгликоль и глицерин. Двухатомные спирты, содержащие две гидроксильные группы—ОН, называются гликолями, ...М.В. Ломоносов и химия
- М.В. Ломоносов был создателем многих химических производств (неорганических пигментов, глазурей, стекла, фарфора). - Он разработал технологию и ...Многоатомные спирты
Многоатомные спирты — органические соединения класса спиртов, содержащие в своём составе более одной гидроксильной группы. Особое значение многоатомные ...Конспекты
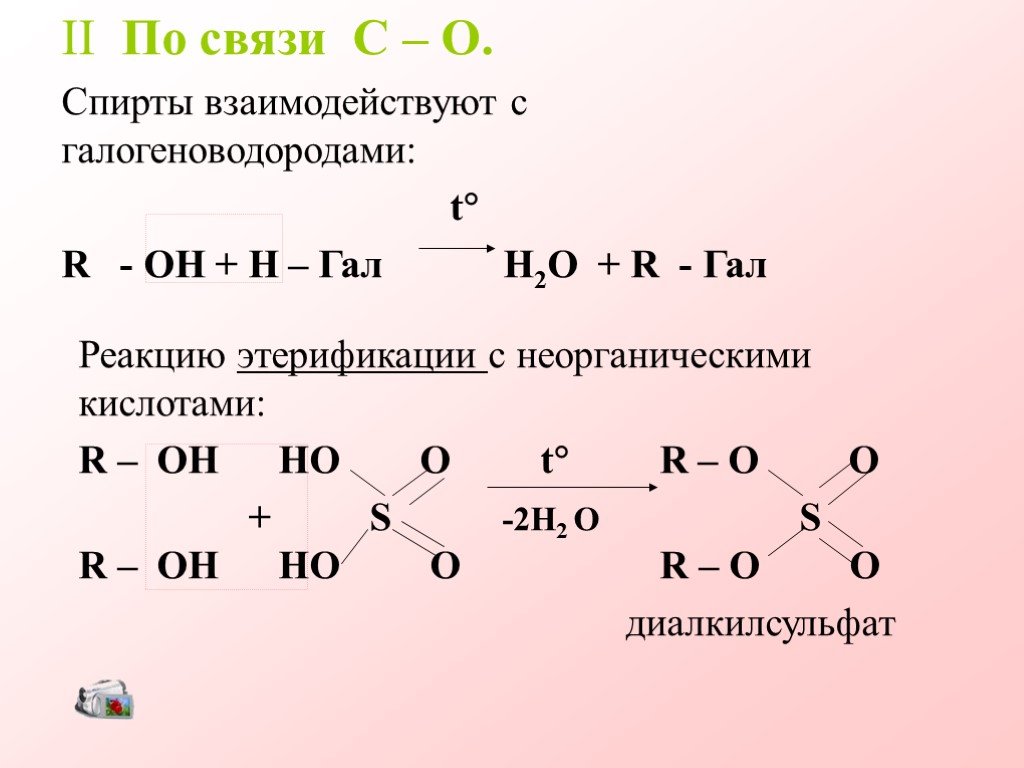
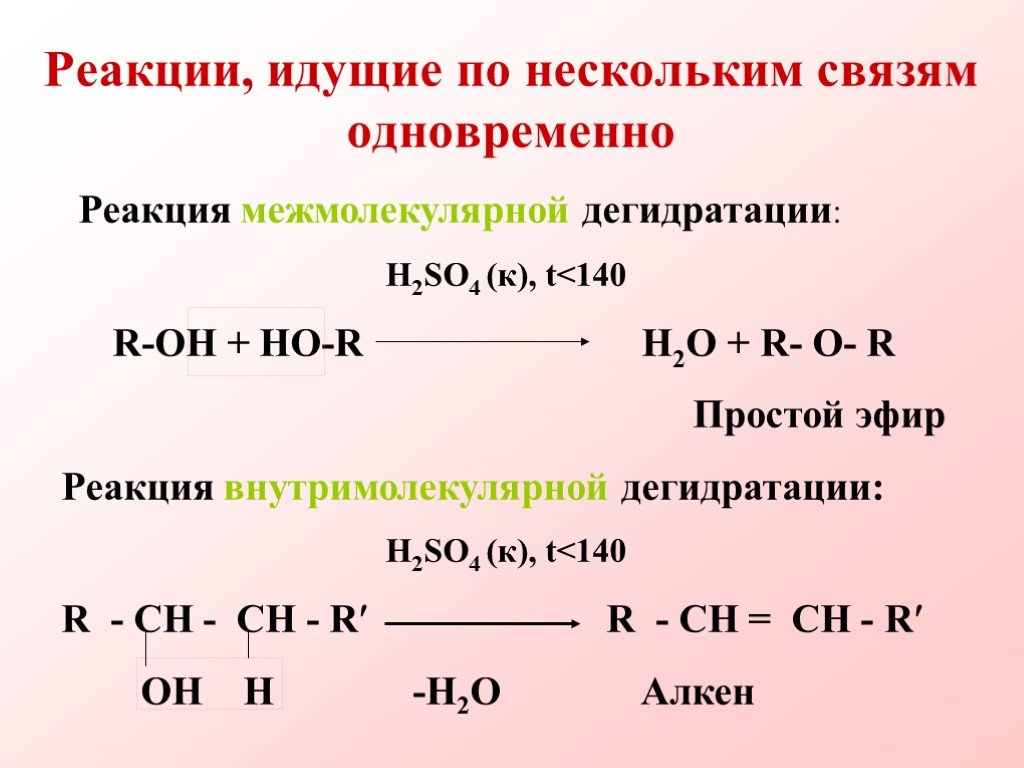
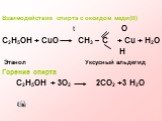
Химические свойства предельных одноатомных спиртов
МОУ « Лицей № 47» г. Саратов. . Никитина Надежда Николаевна - учитель химии. ПОДГОТОВКА К ЕГЭ ( 10, 11 класс). Лекция по теме: Химические свойства ...Строение предельных одноатомных спиртов. Изомерия и номенклатура
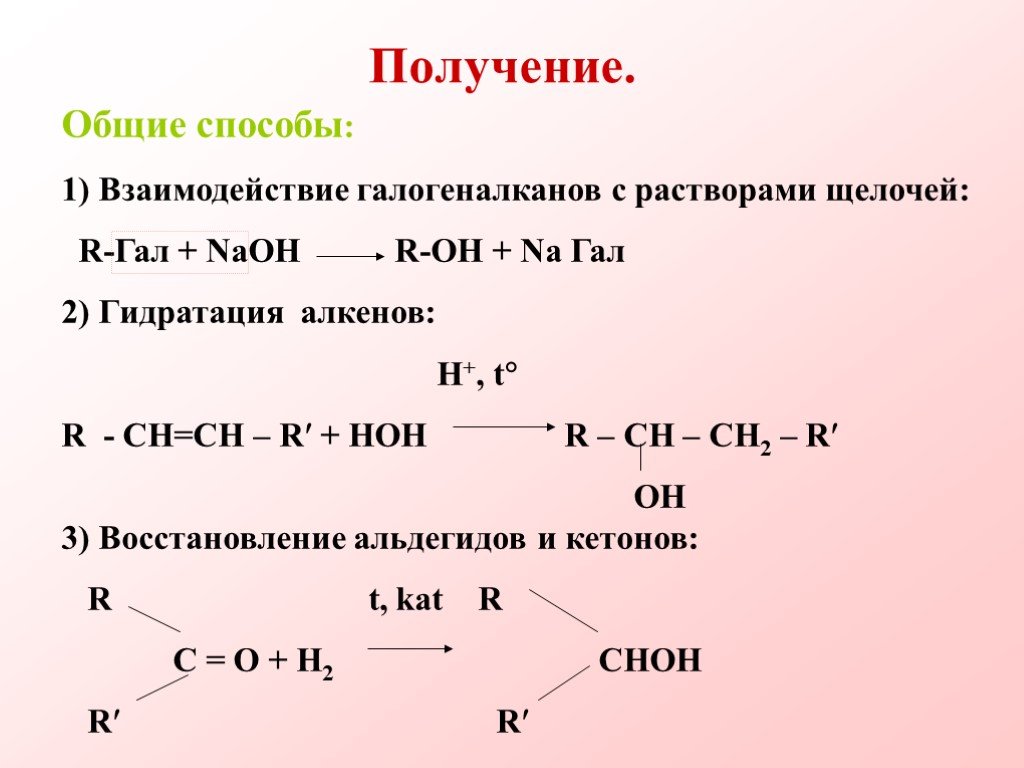
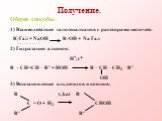
Урок 10 класса. . (по учебнику Г.Е. Рудзитиса). Тема: Строение предельных одноатомных спиртов. . . Изомерия и номенклатура. Цель:. . 1. ...Получение и применение предельных одноатомных спиртов
Урок по теме:. 10 класс. «Получение и применение. . предельных одноатомных спиртов». Хабибярова А.А., учитель химии. Цель урока:. п. ознакомить ...Химические свойства предельных карбоновых кислот. Разработка урока-исследования
МБОУ «Гимназия №44» г. Курска. «Химические свойства. . карбоновых кислот». (урок - исследование). Учитель химии высшей категории:. ...Химические свойства одноатомных спиртов
ПЛАН-КОНСПЕКТ. . урока химии (2 часа). Химические свойства одноатомных спиртов . Урок открытия новых знаний и построения системы знаний. ...Общая характеристика предельных углеводородов
Министерство образования Республики Карелия. ГАПОУ РК «Сортавальский колледж». МЕТОДИЧЕСКАЯ РАЗРАБОТКА УРОКА. Общая характеристика ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:8 февраля 2019
Категория:Химия
Содержит:23 слайд(ов)
Поделись с друзьями:
Скачать презентацию