Презентация "Молекулярно кинетическая теория идеальных газов" по физике – проект, доклад
Презентацию на тему "Молекулярно кинетическая теория идеальных газов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
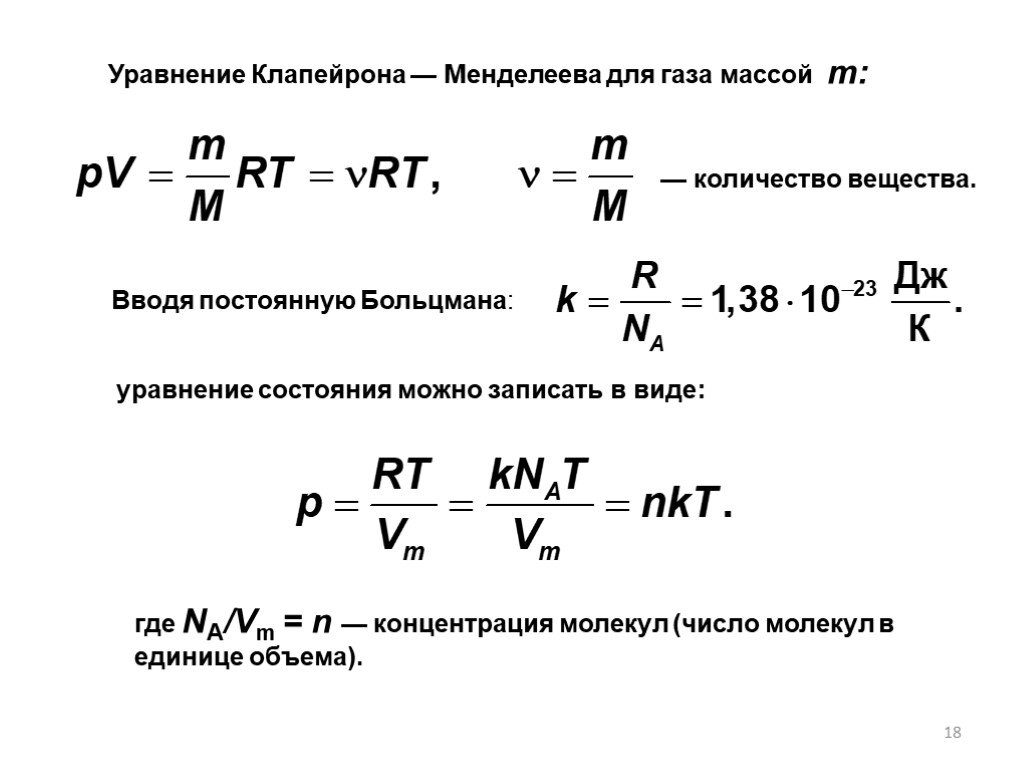
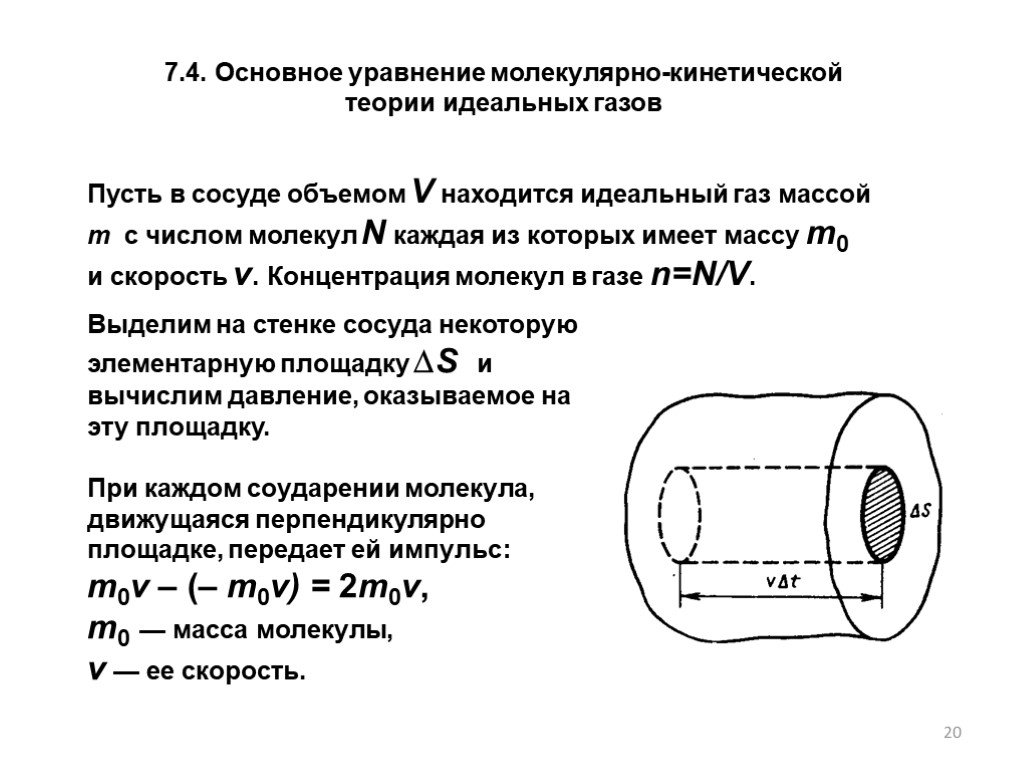
Молекулярно-кинетическая теория
Определение молекулярно-кинетической теории. Теория, объясняющая тепловые свойства макроскопических тел на основе представления об их атомно-молекулярном ...Кинетическая теория газов
Кроме того, предполагается, что между молекулами отсутствуют дальнодействующие силы взаимодействия, взаимодействие между молекулами проявляется только ...Три состояния вещества. Различие в молекулярном строении твердых тел, жидкостей и газов
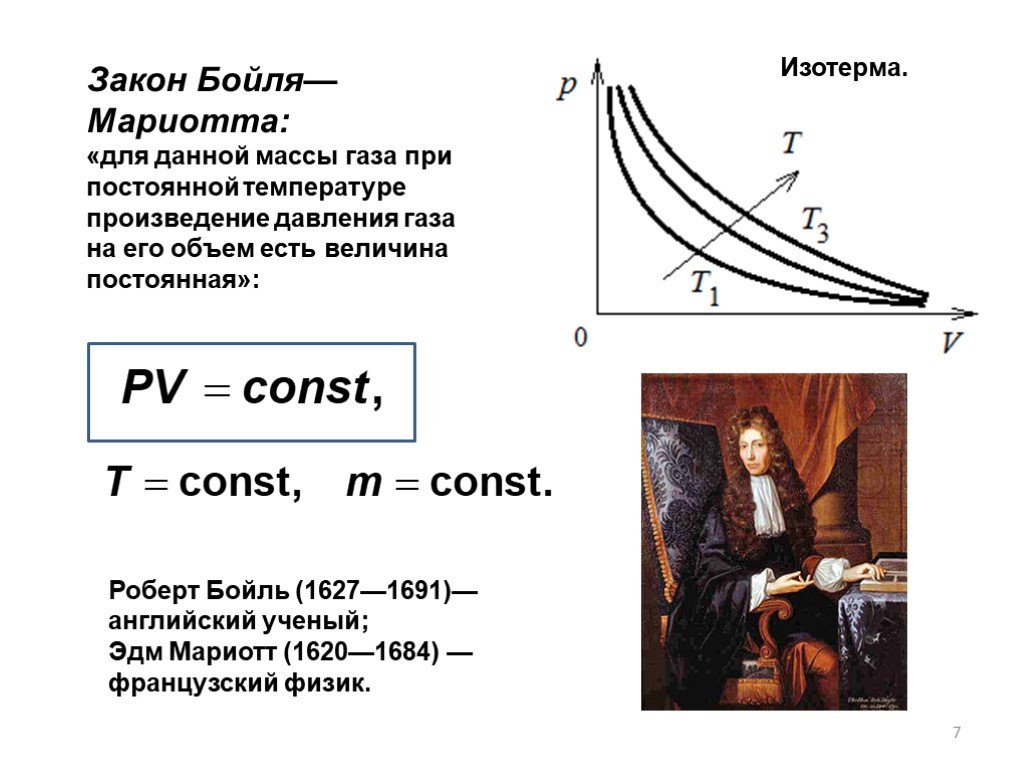
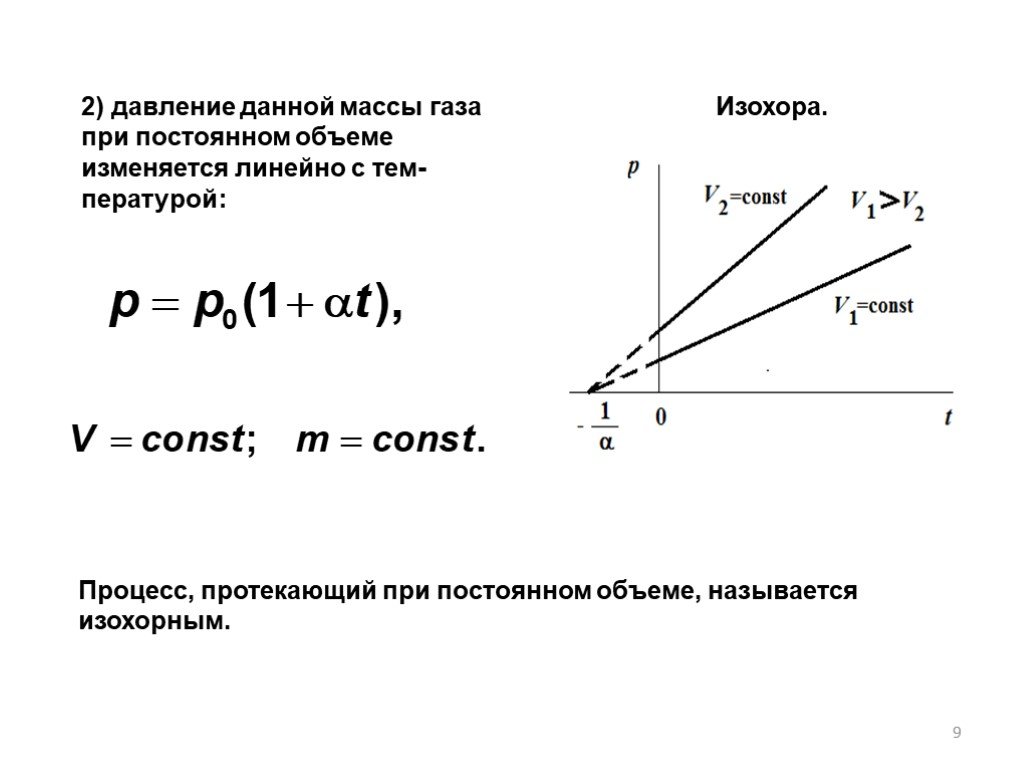
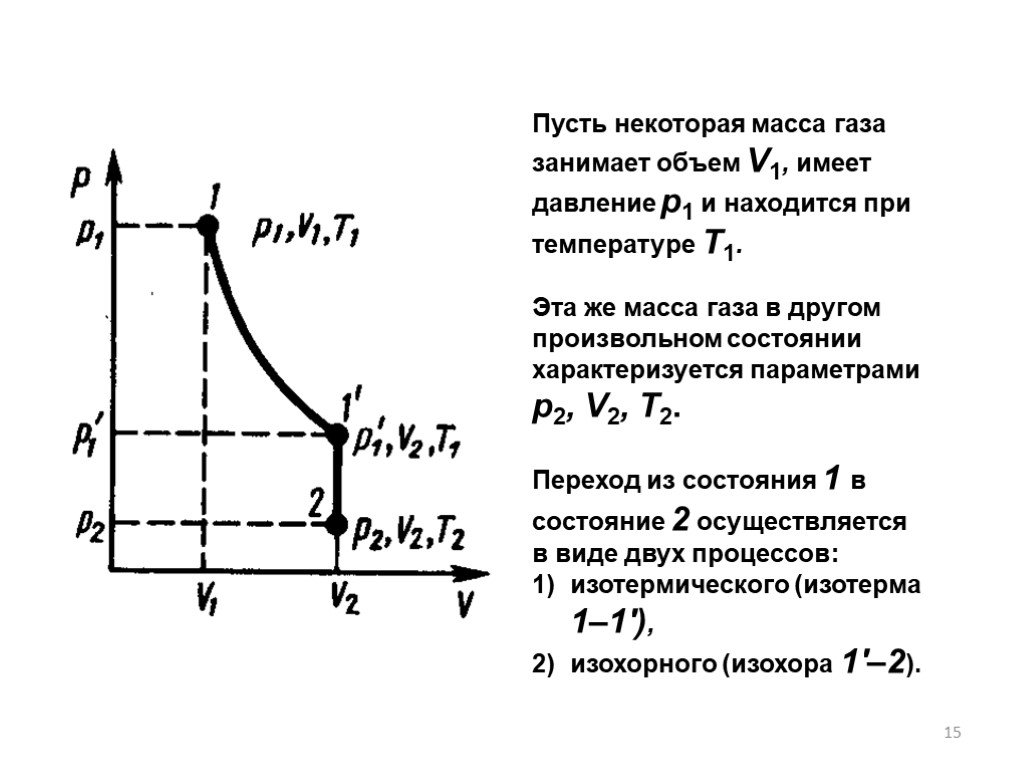
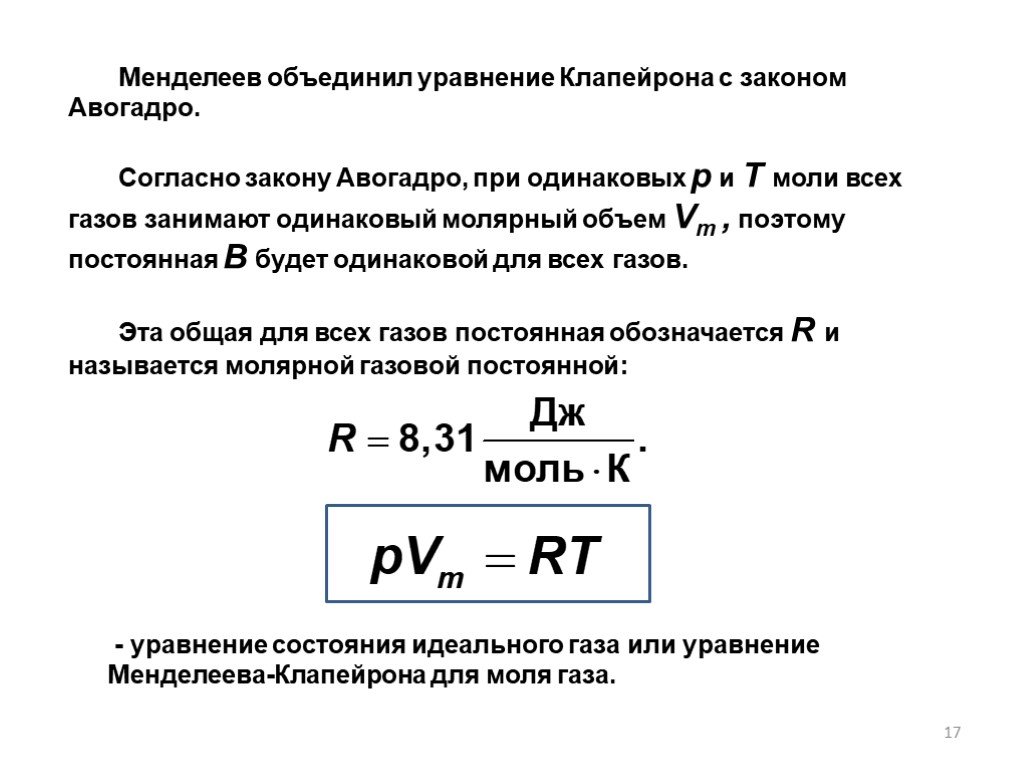
В природе вещества встречаются в трех состояниях:. в твердом в жидком в газообразном. Твердое тело имеет собственную форму и объем. Жидкости легко ...Законы идеальных газов
ГАЗОВЫЕ ЗАКОНЫ (10 класс). Цели урока. 1.Способствовать формированию у учащихся знания молекулярно-кинетической теории идеального газа; выявить причинно-следственные ...Специальная теория относительности
СТО. Специальная теория относительности (СТО) — теория, описывающая движение, законы механики и пространственно-временные отношения при произвольных ...Специальная теория относительности
Домашнее задание № 1. Г.Н. Степанова. Физика-11, ч.1 стр. 130 – Введение § 28 – знать: В чем проявляется относительность механического движения Принцип ...Свойства жидкостей, газов и твердых тел в пословицах
Из чего состоят окружающие нас предметы? «Из молекул и атомов»,-без запинки ответит сейчас каждый школьник. Это представляется нам сейчас очевидной ...Свойства газов
Закономерности броуновского движения. 1905 год - А.Эйнштейн на основе МКТ разработал теорию броуновского движения и доказал, что смещение частицы ...Реактивное движение. Потенциальная и кинетическая энергия. Закон сохранения энергии
План урока. 1. Реактивное движение. 2. Потенциальная энергия. 3. Кинетическая энергия. 4. Закон сохранения энергии. 5. Решение задач по теме. Реактивное ...Общая теория относительности Эйнштейна
Физика до теории относительности. Аристотель: движение – переход вещества в форму. Поведение тел определяется соотношением их составе «земли» и «огня». ...Общая теория относительности
Тема 9. ОСНОВНЫЕ ПОЛОЖЕНИЯ ОБЩЕЙ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ (ОТО). 9.1. Обобщение закона тяготения Ньютона 9.2. Принцип эквивалентности сил инерции и ...Давление жидкостей и газов
Цели урока:. расширение представлений о гидростатическом давлении; отработка практических навыков при решении задач; развитие логического мышления; ...Давление жидкостей и газов
( Эпиграф ). Тому, кто знает физику, Нетрудно дать ответ: Почему летает спутник, А мы с вами - нет? Почему в жидкости легче тело? Нам до всего есть ...Строение атома. Квантовая теория строения атома
Модели атома. Модель атома Томсона Модель атома Резерфорда Модель атома Бора Модель атома Шрёдингера. Модель атома Томсона. «Пудинг с изюмом». Джозеф ...Законы газов
. Материя Вещество Поле. Состояния вещества:. Твердое Жидкое Газ Плазма. Электрическое Магнитное Гравитационное Торсионное Биологическое Информационное. ...Давление твёрдых тел, жидкостей и газов
...Для того, чтобы усовершенствовать ум, надо больше размышлять, чем заучивать. Р.Декарт. Почему ...Давление твердых тел, жидкостей и газов
Науку всё глубже постигнуть стремись, Познанием вечного жаждой томись. Лишь первых познаний блеснет тебе свет, Узнаешь: предела для знания нет. Фирдоуси, ...Давление твёрдых тел, жидкостей и газов
Проверим домашнее задание. Будет ли действовать выталкивающая сила на тело, погруженное в жидкость, в состоянии невесомости? Ответ обоснуйте. Попробуйте ...Давление твердых тел , жидкостей , газов, закон Архимеда
Физические величины. Давление-это…. Давление: p=F/S; Па. Давление жидкостей. . Атмосфера. Азот-78% Кислород-21% Аргон-0,93% Углекислый газ-0,03%. ...Корпускулярная и волновая теория света. Скорость света
Длительное время параллельно друг другу развивались две теории световых явлений. Волновая Корпускулярная. Теории света. корпускулярная волновая Свет ...Конспекты
Молекулярно- кинетическая теория в нашей жизни
Муниципальное общеобразовательное бюджетное учреждение средняя общеобразовательная школа с. Первомайский муниципального района Благоварский район ...Молекулярно – кинетическая теория
Данный урок я провожу после изучения раздела «Молекулярно – кинетическая теория» в группах учащихся 1 курса. Этот урок обобщения и систематизации ...Три состояния вещества. Различие в молекулярном строении твердых тел, жидкостей и газов
МОУ ПАДОВСКАЯ средняя общеобразовательная школа. ПЕСТРАВСКОГО РАЙОНА САМАРСКОЙ ОБЛАСТИ. Урок по физике в 7 классе. Тема: «Три состояния ...Три состояния вещества. Различие в молекулярном строении твердых тел, жидкостей и газов
Три состояния вещества. Различие в молекулярном строении твердых тел, жидкостей и газов. Цель урока –. . познакомить учащихся со свойствами твердых ...Энергия. Потенциальная и кинетическая энергия
7 класс. § 62, 63 Энергия. Потенциальная и кинетическая энергия. Тип урока:. по основной дидактической цели: у. рок повторения изученного ...Физическая теория
Физика 7кл . Тема урока. : Физическая теория . Цели и задачи урока:. ученик должен усвоить: - понятие физическая теория; - основную задачу физической ...Свойства твёрдых тел, жидкостей и газов
Тема: Свойства твёрдых тел, жидкостей и газов. Цель: Закрепить знания о состояниях тел. Задачи:. . Рассмотреть свойства твёрдых тел, жидкостей ...Свойства жидкостей, газов и твердых тел
Тема. : Свойства жидкостей, газов и твердых тел. Тип урока:. урок-конференция. Цели урока:. . Обучающие:. проверить уровень усвоения вопросов ...Решение задач. Потенциальная и кинетическая энергии
Урок по теме. «Решение задач. Потенциальная и кинетическая энергии.». Тип урока – ролевая игра ( с использованием РК). Цель. :. Образовательная:. ...Научные методы изучения природы.Физический эксперимент. Физическая теория
Предмет: Физика. . Класс: 7 рус. План занятия №. _. 5. __. Дата. 17. 09. 2013 год. Тема:. Научные методы изучения природы.Физический эксперимент. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:3 ноября 2018
Категория:Физика
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию