Презентация "Основные газовые законы" по физике – проект, доклад
Презентацию на тему "Основные газовые законы" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 27 слайд(ов).
Слайды презентации
Список похожих презентаций
Газовые законы (изопроцессы в газах)
Урок – путешествие по мотивам нартских сказаний. Тема урока: Решение задач. Цель: закрепить с учащимися знания газовых законов, уравнения состояния ...Газовые законы
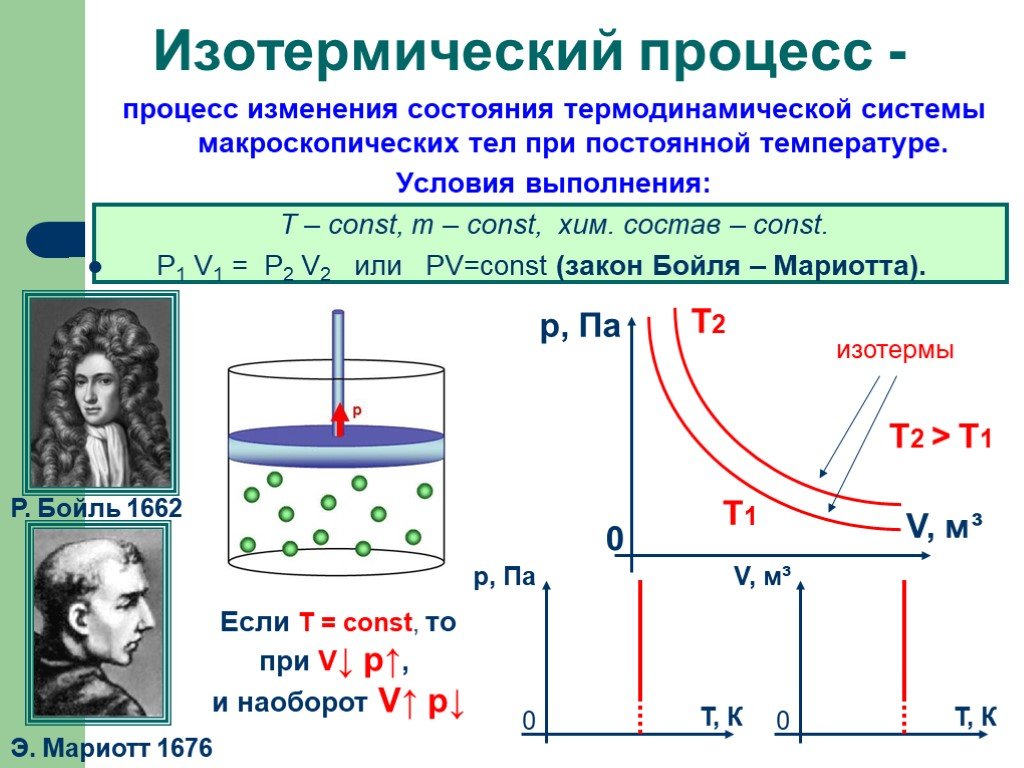
в 1662 г. Р. Бойлем; в 1676 г. Э. Мариоттом. Роберт Бойль. Закон Бойля-Мариотта. Эдм Мариотт. При постоянной температуре давление данной массы газа ...Газовые законы
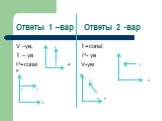
Давайте вспомним. Какие величины характеризуют состояние макроскопических тел? Что называют уравнением состояния? ответы 1.давление - P, объем – V, ...Газовые законы
2013 Очер Бавкун Т.Н. Идеальный газ Исторические данные Закон Бойля – Мариотта Закон Шарля Закон Гей – Люссака Сводная таблица Разбор задачи на построение ...Газовые законы
Определение задач Изотермический процесс Изобарный процесс Изохорный процесс Домашнее задание Пример решения задачи. содержание. уравнение состояния ...Газовые законы
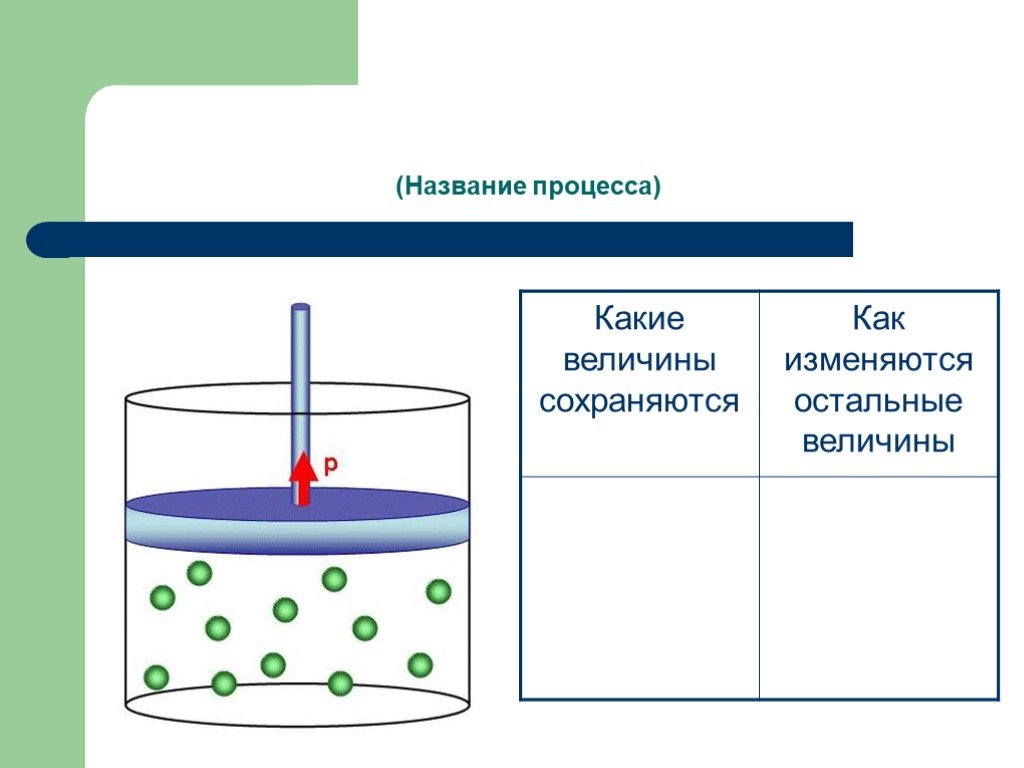
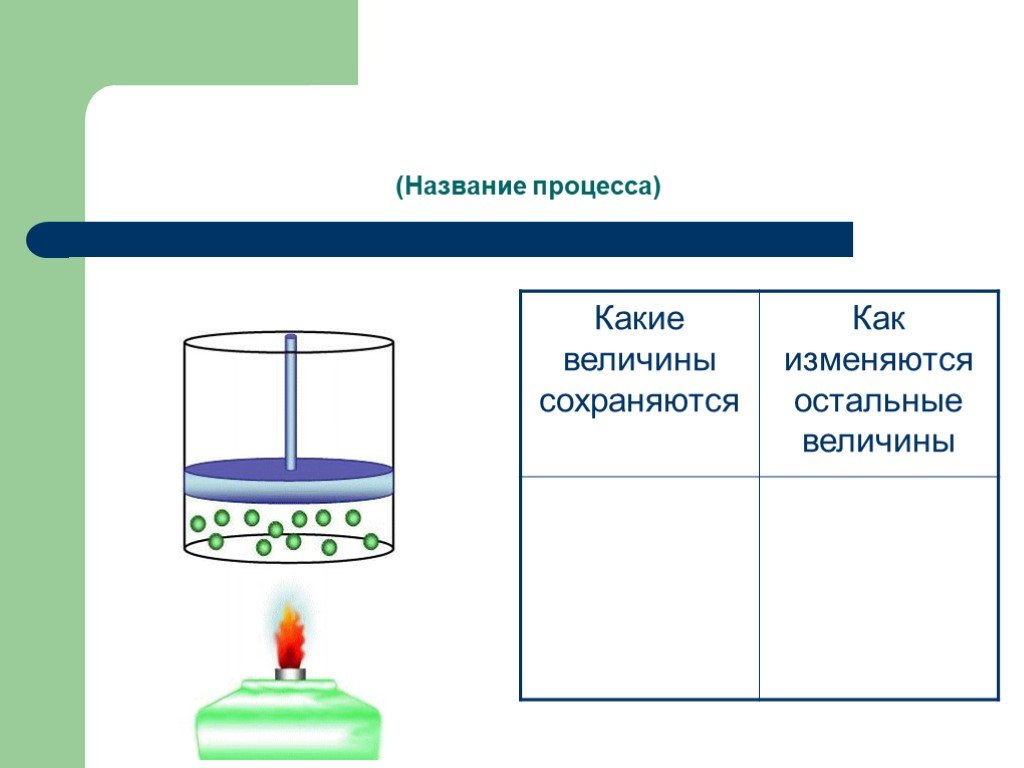
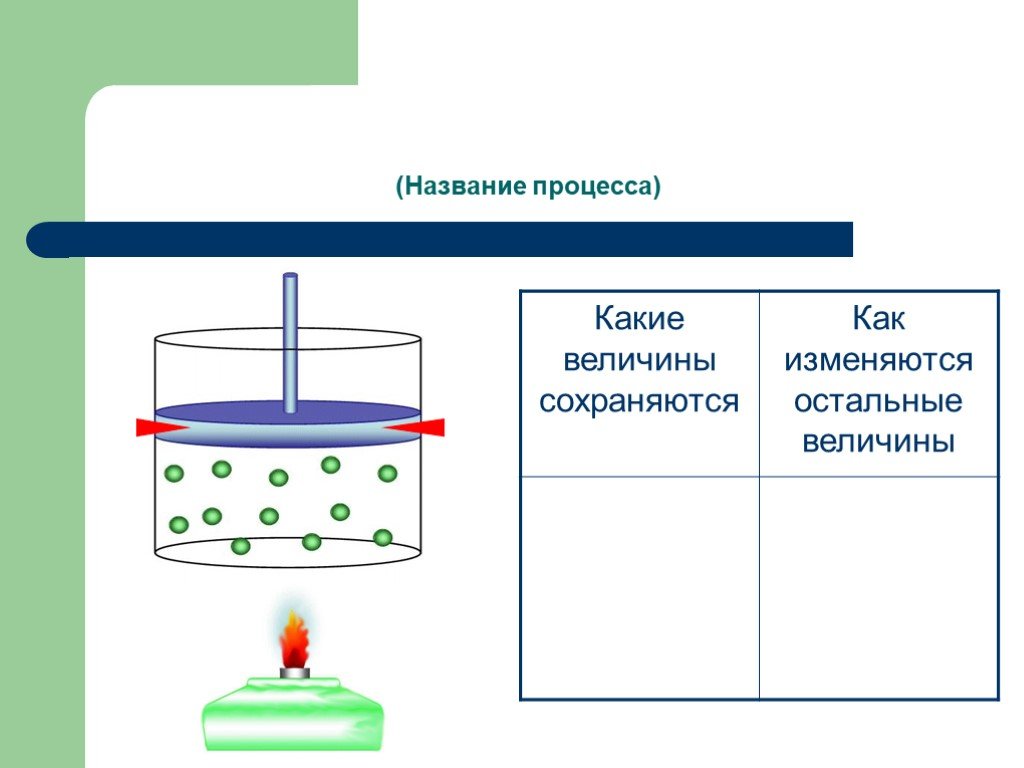
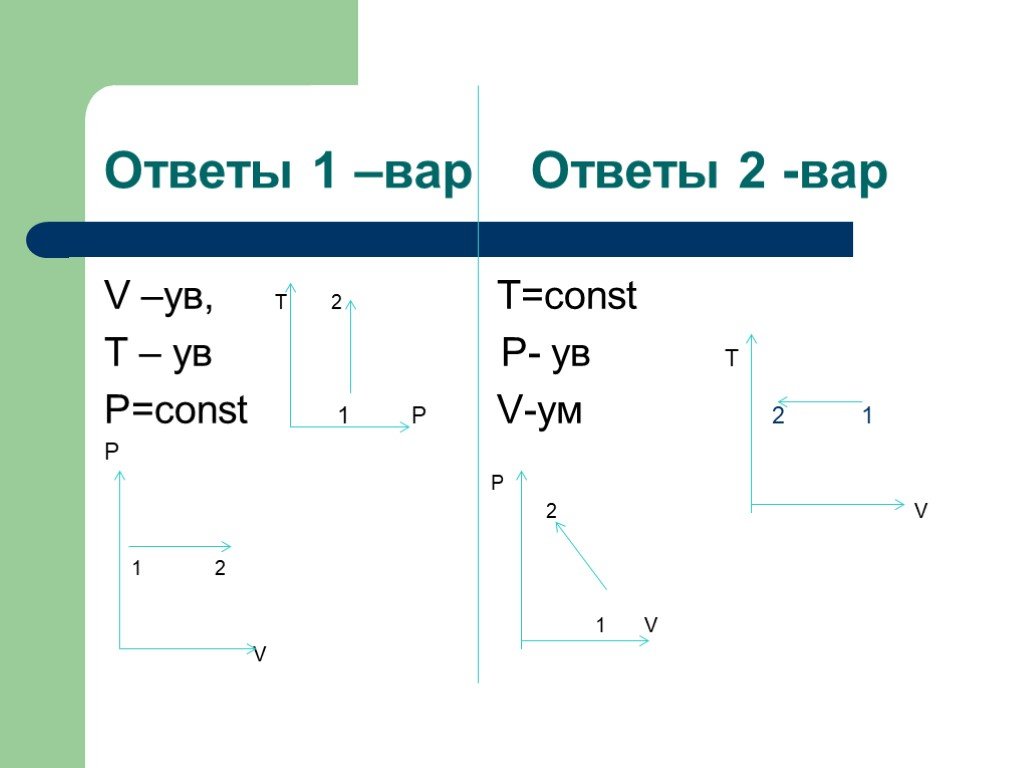
Изопроцессы Изотермический Изобарный Изохорный. Закон Бойля-Мариотта Постоянные температура и масса Переменные давление и объем. Изотермический процесс. ...газовые законы
Повторение. Перечислите основные положения МКТ. Дайте определение относительной молекулярной массы. Что такое количество вещества? Что такое молярная ...Газовые законы
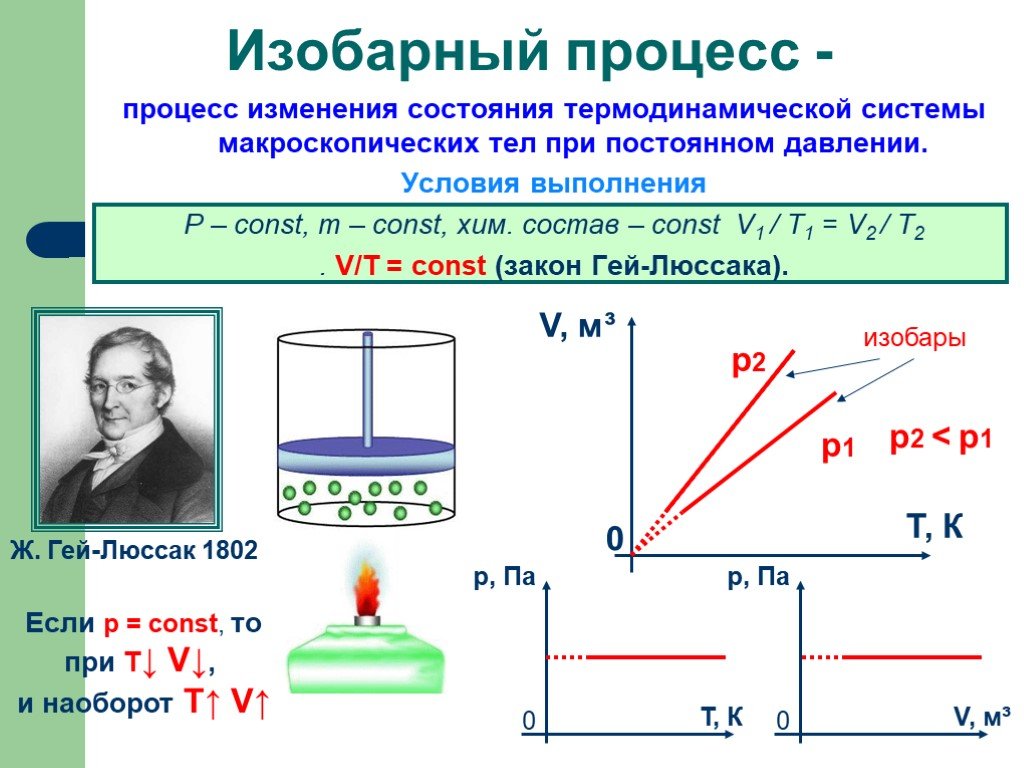
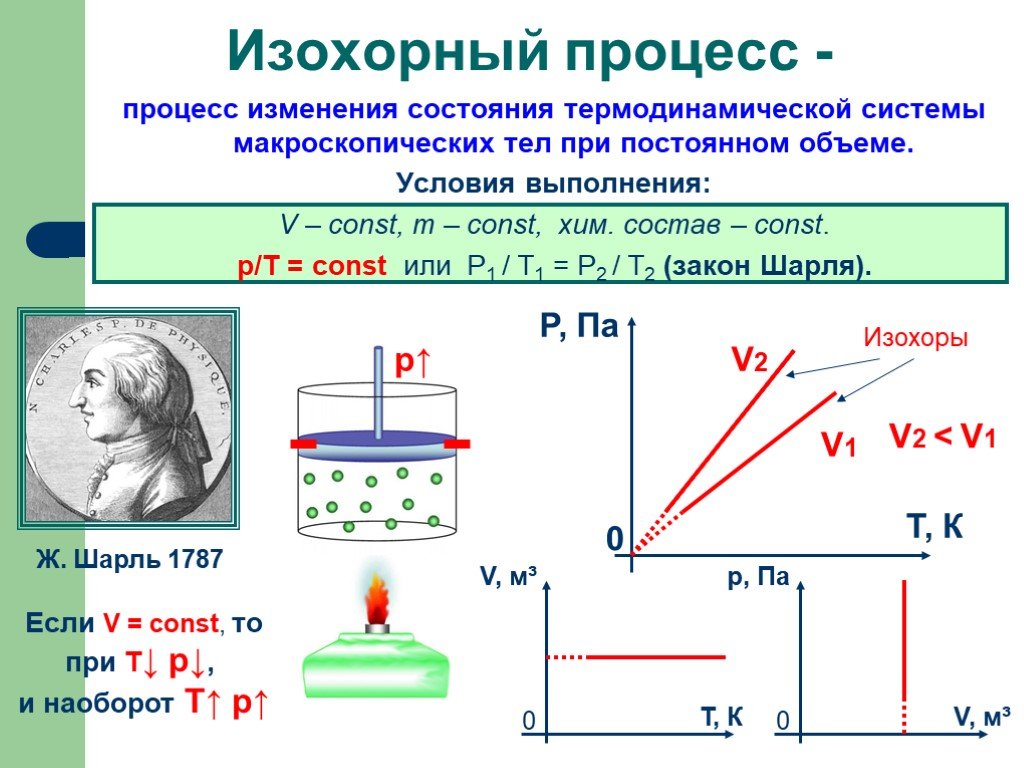
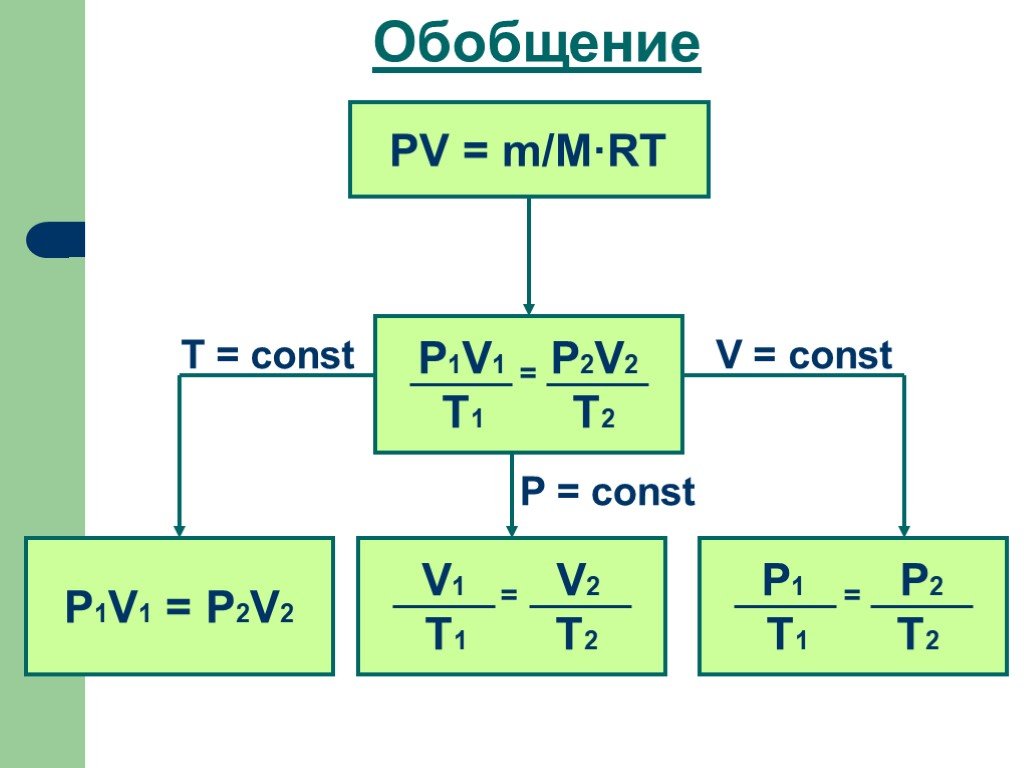
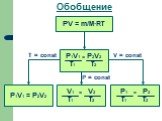
Основные газовые законы. Закон Бойля-Мариотта: PV=const при t0=const Закон Шарля: P/T=const при V=const Закон Гей-Люссака: V/T=const при P=const ...Газы, газовые законы
Цели урока: 1. Закрепление знаний об идеальном газе, изопроцессах. 2. Формирование умений решения задач на применение уравнения состояния идеального ...Основные законы электротехники
65 I11 – 25 I22 – 30I33 = 80 – 25 I22 – 75 I22 – 35I33 = – 50 – 30 I33 – 35 I11 – 85I22 = 60. Решить систему трех уравнений с тремя неизвестными с ...Уравнение состояния идеального газа. Газовые законы
Макроскопические параметры – это…:. Масса, давление, объем, температура. давление, объем, температура. Состояние газа данной массы характеризуется ...Алгоритм решения графических задач по теме "Газовые законы"
Дан график зависимости давления от температуры. Изобразить график этой зависимости в координатах P от V и V от T. Появление новых рисунков и записей ...Основные понятия и законы электростатики
Электромагнитные силы – силы притяжения и отталкивания, возникающие между электрически заряженными частицами и телами. Электродинамика – раздел физики, ...Уравнение состояния идеального газа. Газовые законы
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА ГАЗОВЫЕ ЗАКОНЫ. На титульный лист. Состояние данной массы газа характеризуется тремя макроскопическими параметрами: ...Оптика. Основные законы геометрической оптики
Основные законы геометрической оптики. Закон прямолинейного распространения света Закон отражения света Закон преломления света. относительный показатель ...Основные понятия и законы динамики
Галилео Галилей (1564-1642). На основе экспериментальных исследований движения шаров по наклонной плоскости. Скорость любого тела изменяется только ...Основные понятия и законы динамики
Относительность движения. Задание: Выяснить - в чём основное отличие геоцентрической и системы от гелиоцентрической? Аристотель 384 - 322 г. до н. ...Основные положения молекулярно-кинетической теории (МКТ). Абсолютная температура.
Молекулярная физика. Раздел, в котором изучают свойства макроскопических тел в различных агрегатных состояниях на основе МКТ. Демокрит (около 460 ...Случайные величины: законы распределения
Что было: понятие о случайной величине. СЛУЧАЙНОЙ ВЕЛИЧИНОЙ называется величина, которая в результате испытания примет одно и только одно возможное ...Оптика Световые явления и законы
Содержание. Свет - это электромагнитная волна Солнце – естественный источник света Закон распространения света Маяк Закон отражения света Отражения ...Конспекты
Молекулярная физика. Газовые законы
МОДЕКУЛЯРНАЯ ФИЗИКА. ГАЗОВЫЕ ЗАКОНЫ. (решение задач повышенной сложности). 10 класс. Учителя: Юдинцева Ольга Васильевна. ...Изопроцессы. Газовые законы
Подробный конспект урока. . Организационная информация. Тема урока. . Изопроцессы. Газовые законы. . . Предмет. . Физика. . ...Изопроцессы. Газовые законы
Тема урока:. "Изопроцессы. Газовые законы". Цели урока:. Создать условия по изучению изопроцессов термодинамических параметров, графики изопроцессов, ...Газовые законы и их применение
ИНТЕГРИРОВАННОЕ ЗАНЯТИЕ ПО ФИЗИКЕ. Учитель физики Бахчисарайской ОШ № 4, Республика Крым:. . Марынич Н.Н. Тип занятия. : комбинированный. Тема ...Газовые законы
Урок разработан Соловьевой Н.Н.,. учителем физики МБОУ «Спешковская ООШ». Очерского района Пермского края. Тема урока: «. Газовые законы». ...Газовые законы
Открытый урок по физике. . «Газовые законы». 10 класс. Учитель Касьянова Майя Валентиновна. Тип урока: . урок изучения и первичного закрепления ...Газовые законы
Газовые законы. Цели урока. . . Образовательная:. Изучить изопроцессы (история открытия, графики изопроцессов, математическую запись законов ...Физические явления и законы
Физические явления и законы. 1. На рисунке представлены графики зависимости смещения . x. грузов от времени . t. при колебаниях ...Основные сведения о строении атома
Конспект урока с применением ЛСМ (логико-смысловой модели). Тема «Основные сведения о строении атома». . 11 класс (базовый уровень). Цель: ...Основные положения молекулярно-кинетической теории и ее опытное подтверждение.Масса и размеры молекул
Бегимбаева Жумагуль Купжасаровна. Учитель физики сш №5. Актюбинская область. . Города Шалкар. Тема урока:. "Основные положения ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:30 сентября 2018
Категория:Физика
Содержит:27 слайд(ов)
Поделись с друзьями:
Скачать презентацию