Презентация "Уравнение состояния идеального газа. Газовые законы" (10 класс) по физике – проект, доклад
Презентацию на тему "Уравнение состояния идеального газа. Газовые законы" (10 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
Уравнение состояния идеального газа. Газовые законы
Макроскопические параметры – это…:. Масса, давление, объем, температура. давление, объем, температура. Состояние газа данной массы характеризуется ...Уравнение состояния идеального газа
Физический диктант. Что называют идеальным газом? Какие параметры называют макроскопическими? Как определяется давление идеального газа? С чем связывают ...Уравнение состояния идеального газа
Цель урока:. Вывести зависимость между макроскопическими параметрами, характеризующими состояние газа. Проверить экспериментально уравнение состояния ...Уравнение состояния идеального газа
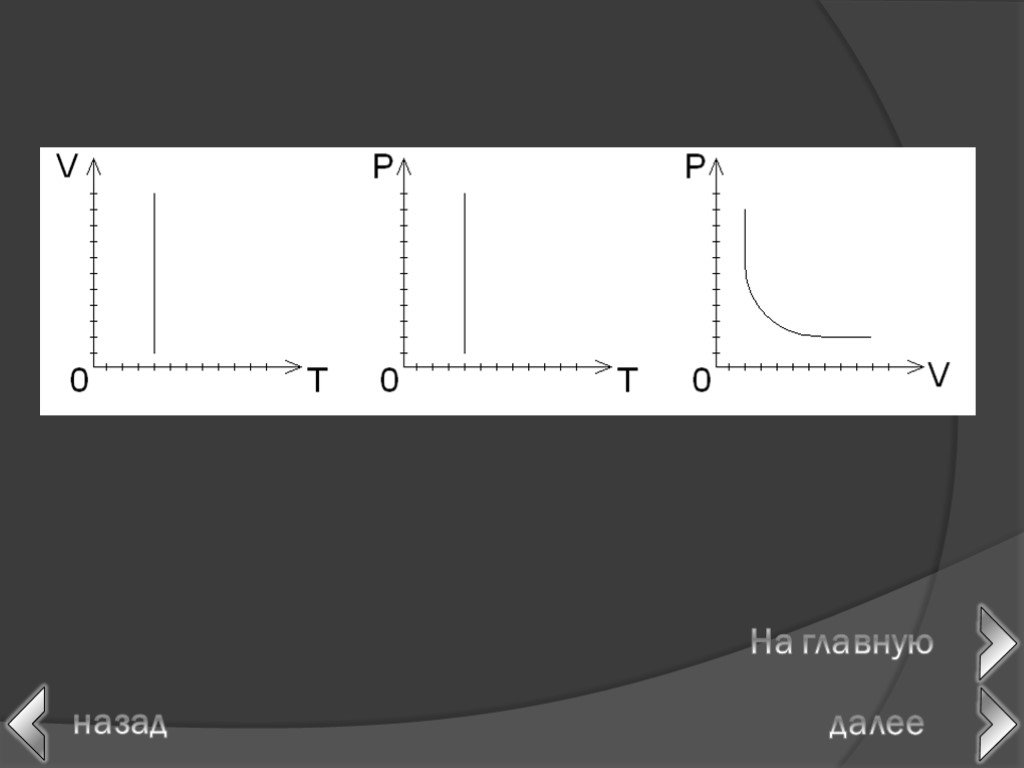
Как уже указывалось, состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением р, объемом V и температурой T. Между ...Газовые законы (изопроцессы в газах)
Урок – путешествие по мотивам нартских сказаний. Тема урока: Решение задач. Цель: закрепить с учащимися знания газовых законов, уравнения состояния ...Решение задач: уравнение газового состояния
ПОВТОРИМ ФОРМУЛЫ. ЗАДАЧА 1. Дать названия процессам, указать изменение параметров, построить в других осях р 2 0 Т. 1. Дать названия процессам, указать ...Газы, газовые законы
Цели урока: 1. Закрепление знаний об идеальном газе, изопроцессах. 2. Формирование умений решения задач на применение уравнения состояния идеального ...Основы МКТ идеального газа
Ни пуха, ни пера! Часть 1. В этой части необходимо ответить на вопросы с выбором ответа. Время ответа на каждый вопрос ограничено в зависимости от ...Газовые законы
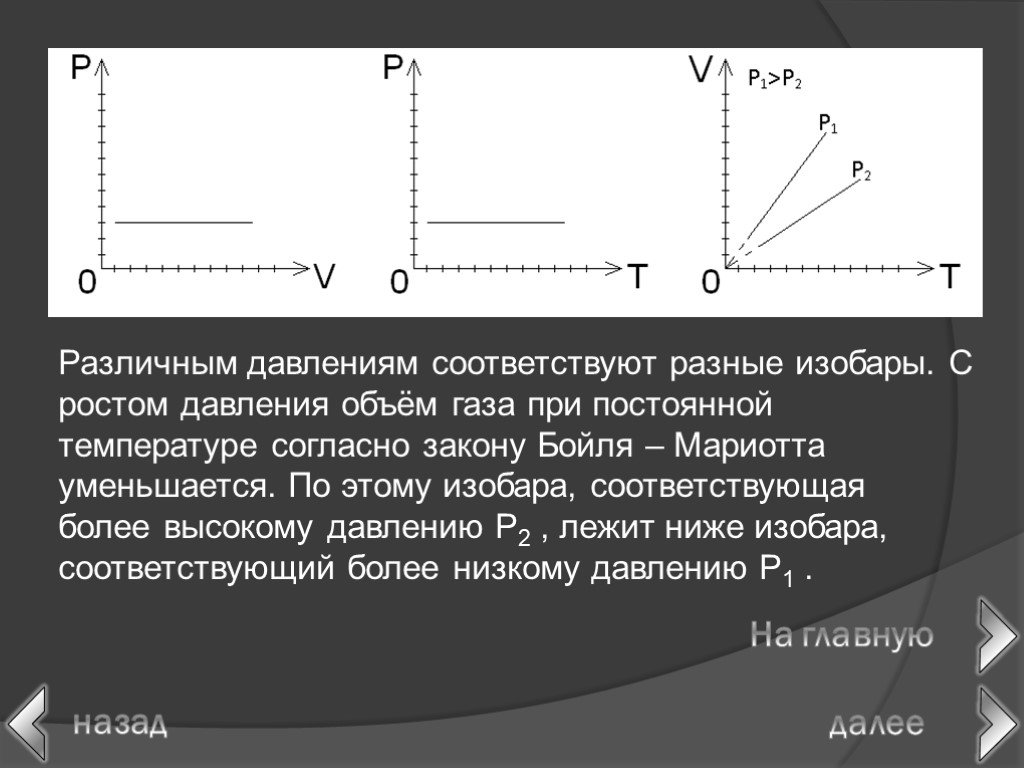
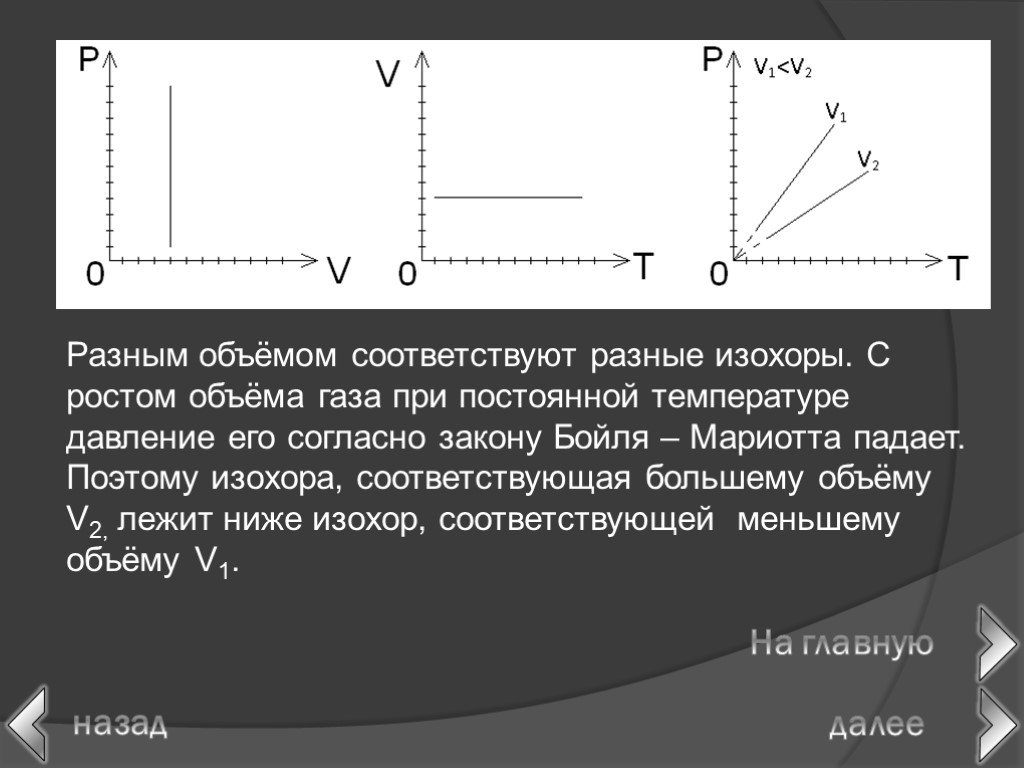
в 1662 г. Р. Бойлем; в 1676 г. Э. Мариоттом. Роберт Бойль. Закон Бойля-Мариотта. Эдм Мариотт. При постоянной температуре давление данной массы газа ...Газовые законы
Давайте вспомним. Какие величины характеризуют состояние макроскопических тел? Что называют уравнением состояния? ответы 1.давление - P, объем – V, ...Газовые законы
Определение задач Изотермический процесс Изобарный процесс Изохорный процесс Домашнее задание Пример решения задачи. содержание. уравнение состояния ...«Работа идеального газа» группа А (первый уровень)
№1: Какой из нижеприведенных графиков наиболее точно отражает зависимость работы идеального газа при изобарном расширении от изменения его объема? ...Газовые законы
2013 Очер Бавкун Т.Н. Идеальный газ Исторические данные Закон Бойля – Мариотта Закон Шарля Закон Гей – Люссака Сводная таблица Разбор задачи на построение ...Основные газовые законы
Цели урока:. изучить газовые законы; научиться объяснять законы с молекулярной точки зрения; изображать графики процессов; продолжить обучение решать ...Температура. Уравнение состояния
Если обозначить среднюю энергию молекулы, приходящуюся на одну степень свободы через , то полная кинетическая энергия поступательного движения всех ...газовые законы
Повторение. Перечислите основные положения МКТ. Дайте определение относительной молекулярной массы. Что такое количество вещества? Что такое молярная ...Газовые законы
Изопроцессы Изотермический Изобарный Изохорный. Закон Бойля-Мариотта Постоянные температура и масса Переменные давление и объем. Изотермический процесс. ...Газовые законы
Основные газовые законы. Закон Бойля-Мариотта: PV=const при t0=const Закон Шарля: P/T=const при V=const Закон Гей-Люссака: V/T=const при P=const ...Алгоритм решения графических задач по теме "Газовые законы"
Дан график зависимости давления от температуры. Изобразить график этой зависимости в координатах P от V и V от T. Появление новых рисунков и записей ...Работа газа и пара при расширении. КПД тепловых двигателей
Подумай и ответь! Демонстрация: оба конца стеклянной трубки закрываем картофельными пробками. Нагреваем середину трубки в пламени спиртовки. Пробки ...Конспекты
Уравнение состояния идеального газа
Урок физики. Тема:. . Уравнение состояния идеального газа. Цели:. 1. Добиться понимания уравнения состояния идеального газа и научить решать ...Уравнение состояния идеального газа
Уравнение состояния идеального газа. . Цель. :. сформировать умение описывать состояние термодинамической системы данной массы газа с помощью 3 макропараметров. ...Уравнение состояния идеального газа
Власова Надежда Ивановна. учитель физики. МКОУ Петропавловская СОШ. Тема урока. «Уравнение состояния идеального газа». ...Газовые законы. Изотермический процесс
«Газовые законы. Изотермический процесс». Цели урока:. Обучающая:. - установить связь между двумя термодинамическими параметрами при неизменном ...Газовые законы. Закон Бойля-Мариотта
Областное бюджетное образовательное учреждение. среднего профессионального образования. «Курский монтажный техникум». Преподаватель: Шелкова ...Изопроцессы. Газовые законы
Подробный конспект урока. . Организационная информация. Тема урока. . Изопроцессы. Газовые законы. . . Предмет. . Физика. . ...Молекулярная физика. Газовые законы
МОДЕКУЛЯРНАЯ ФИЗИКА. ГАЗОВЫЕ ЗАКОНЫ. (решение задач повышенной сложности). 10 класс. Учителя: Юдинцева Ольга Васильевна. ...Изопроцессы. Газовые законы
Тема урока:. "Изопроцессы. Газовые законы". Цели урока:. Создать условия по изучению изопроцессов термодинамических параметров, графики изопроцессов, ...Газовые законы
Урок разработан Соловьевой Н.Н.,. учителем физики МБОУ «Спешковская ООШ». Очерского района Пермского края. Тема урока: «. Газовые законы». ...Газовые законы и их применение
ИНТЕГРИРОВАННОЕ ЗАНЯТИЕ ПО ФИЗИКЕ. Учитель физики Бахчисарайской ОШ № 4, Республика Крым:. . Марынич Н.Н. Тип занятия. : комбинированный. Тема ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:17 сентября 2018
Категория:Физика
Классы:
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию